

安徽省皖江名校2024届高三上学期第二次联考(A)化学试卷(含答案)
展开
这是一份安徽省皖江名校2024届高三上学期第二次联考(A)化学试卷(含答案),共15页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
一、单选题
1、2023年,中国航天科技集团计划安排60余次宇航发射任务!发射200余个航天器!长征系列运载火箭累计发射次数将突破500次。下列说法正确的是( )
A.宇航员携带的只含有离子键
B.月球表面的与地球上常见的是同素异形体
C.火星上存在的铁与地壳中含有的铁化学性质不同
D.飞船燃料联氨一个分子的电子数为18个
2、化学中有许多哲学观念,下列化学事实与对应的哲学观点不相符合的是( )
A.AB.BC.CD.D
3、传统的燃油[主要成分为多种烃]汽车必须解决、等污染问题。为此科学家提出在排气管内设置催化剂,使污染气体转化为大气成分后再排出(反应过程如图)。以下判断错误的是( )
A.净化后的燃油是一种新型化合物
B.反应①、②均为氧化还原反应
C.CO、NO都不是酸性氧化物
D.②的化学方程式为
4、中国古代文化博大精深,下列有关文献描述中涉及到氧化还原反应的是( )
A.《新修本草》:“本来绿色,烧之赤色……”
B.《天工开物》:“凡石灰,经火焚炼为用”
C.《本草经集注》:“以火烧之,紫青烟起,乃真硝石也”
D.《韩非子・内储说上》:“丽水之中生金”
5、化学方程式是一种重要的化学语言。下列化学方程式能够正确表示对应变化的是( )
A.AB.BC.CD.D
6、A、B、C、D是原子序数依次增大的短周期主族元素,A、B、D在周期表中的位置如图,B的族序数是周期数的三倍,C的原子半径在短周期主族元素中最大。下列叙述正确的是( )
A.简单离子半径:
B.单质熔点:
C.最高价氧化物对应水化物的碱性:
D.简单氢化物的稳定性:A>B
7、代表阿伏加德罗常数的值,工业上实现碳中和的一种反应原理为。下列叙述正确的是( )
A.标准状况下,中存在的化学键总数为
B.,压强为时,所含的原子数目小于
C.该反应中,甲烷是还原产物,水是氧化产物
D.通常条件下,含有质子数为
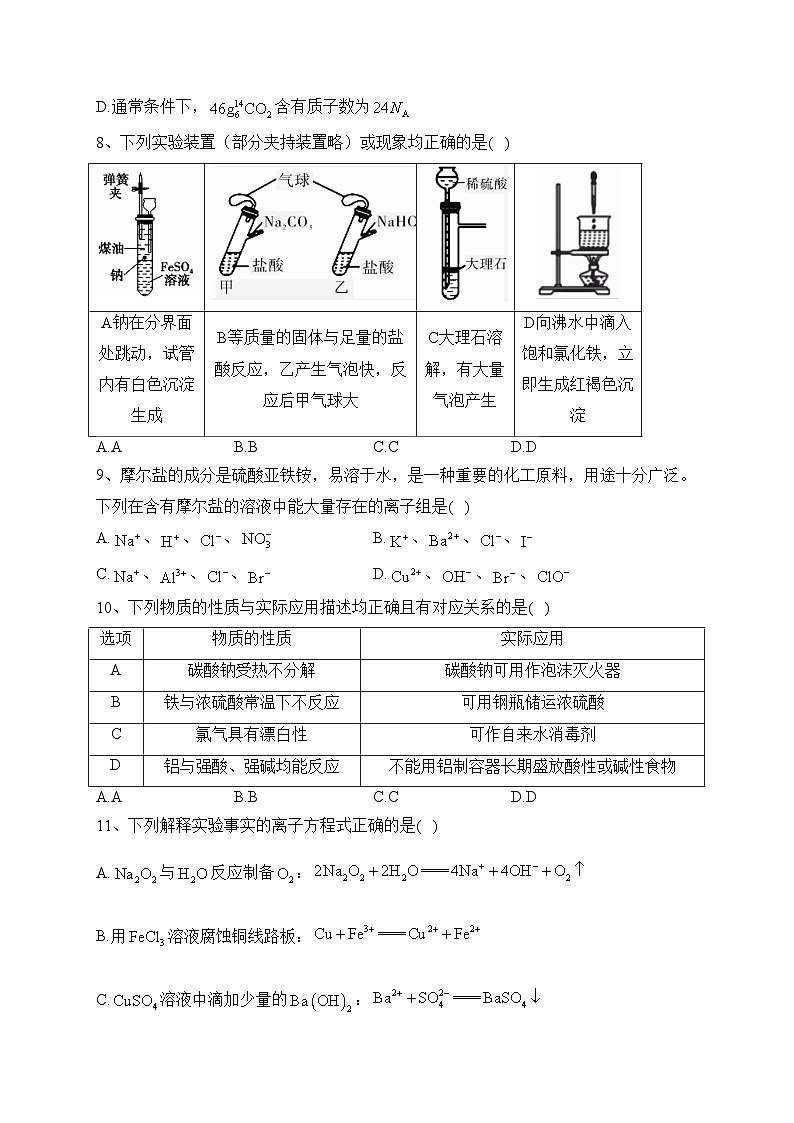
8、下列实验装置(部分夹持装置略)或现象均正确的是( )
A.AB.BC.CD.D
9、摩尔盐的成分是硫酸亚铁铵,易溶于水,是一种重要的化工原料,用途十分广泛。下列在含有摩尔盐的溶液中能大量存在的离子组是( )
A.、、、B.、、、
C.、、、D.、、、
10、下列物质的性质与实际应用描述均正确且有对应关系的是( )
A.AB.BC.CD.D
11、下列解释实验事实的离子方程式正确的是( )
A.与反应制备:
B.用溶液腐蚀铜线路板:
C.溶液中滴加少量的:
D.溶液中加入足量稀盐酸:
12、科学探究与创新意识是化学研究工作者的必备素养。根据所学知识判断下列探究肯定没有意义的是( )
A.利用新制氯水和盐酸探究的漂白性
B.利用和的沸点探究F、的非金属性
C.利用氯化钡溶液探究碳酸钠和碳酸氢钠的鉴别方法
D.钠、镁与冷水反应,探究两种金属的金属性强弱
13、皓矾是一种无色晶体,主要用作收敛剂、防腐剂、颜料。工业上利用烧锌渣制备皓矾的流程如下:
下列有关说法正确的是( )
A.酸溶的目的是除去金属氧化物
B.双氧水在反应中体现还原性
C.一系列操作包括蒸发结晶、过滤、洗涤等
D.沉铁时离子方程式为
14、常温下,将铝粉加入到蒸馏水中,未见明显现象,再加入适量的,可明显看到有气泡产生,反应原理为:,下列说法不正确的是( )
A.在反应中作氧化剂
B.铝和冷水未见明显现象,不能说明二者不反应
C.在水溶液中能够电离出,属于强碱
D.标准状况下,产生,转移电子数目为
二、填空题
15、硫酸铜可用于游泳池消毒,碱式硫酸铜(波尔多液有效成分)可用于植物驱虫。工业上一种利用含铜矿石(含、、以及少量等)制备硫酸铜晶体的流程如下。
已知:金属硫化物在空气中焙烧,常生成金属氧化物和二氧化硫。
回答下列问题:
(1)硫在周期表中的位置是第______周期、第______族。
(2)检验洗涤液中含有的试剂是______(填化学式);配制的硫酸和配制硫酸共同需要的仪器名称为______。
(3)酸溶后,溶液中的阳离子有______。
(4)写出滤渣与稀硫酸、双氧水反应的离子方程式__________________;一系列操作包括____________;不能将试剂双氧水换为硝酸的原因是________________________。
(5)硫酸铜晶体结晶水的测定:准确称量硫酸铜晶体质量,低温加热至晶体全部变为白色,冷却至室温后称量,再加热再称量,最终质量恒定为,则结晶水______(设化学式为,用字母表示)。
16、氯及其化合物在工农业生产中应用广泛,部分含氯物质的分类与相应化合价关系如图所示。
回答下列问题:
(1)写出D、E的化学式:______、______。
(2)A与G在常温下可以用于制取B,写出该反应的离子方程式:______。
(3)F为84消毒液的主要成分,在生活中不能与洁则灵(主要成分为A)混合使用,原因是________________________。
(4)工业上可用G和双氧水制备D,相同条件下,生成的D和另一种气体的体积比为______;生成的D可将废水中的锰离子氧化为二氧化锰除去(氯元素降为最低价),反应中每消耗,可处理为的废水______L。
(5)消毒效率是用单位质量的消毒剂得电子数来表示的。的消毒效率是氯气的______倍。(计算结果保留两位小数)
17、元素周期表是学习化学的基础,下表列出了常见的十种短周期主族元素的分布位置:
回答下列问题:
(1)⑤的氢化物是常见的供氢剂,写出其化学式:______。
(2)元素②③④⑨形成的气态氢化物中,最稳定的是______(填化合物的化学式)。
(3)元素①⑤⑥⑦的最高价氧化物的水化物中,碱性最强的是______(填化合物的化学式)。
(4)写出能说明⑨、⑩元素非金属性强弱的离子方程式:__________________。
(5)工业上常采用电解⑤或⑥与⑩形成的化合物制备其对应的单质,但是不使用⑦与⑩形成的化合物制备⑦,原因是______________________________。
(6)工业上常用⑤和氯化钾在高温下反应制取钾(相关物质的熔沸点见表格),制取钾的温度范围最好控制在______,检验制得的钾中是否含有可能的杂质,最好的方法是______。
(7)实验室欲用⑤的氧化物对应的水化物配制的对应溶液。在配制过程中,其他操作都是正确的,下列操作会引起所配溶液浓度偏高的是______(填序号),取上述配制好的溶液,与足量的⑦单质反应,可产生标准状况下氢气______。
①没有洗涤烧杯和玻璃棒②转移溶液时不慎有少量洒到容量瓶外面③容量瓶不干燥,含有少量蒸馏水④定容时俯视刻度线⑤定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
三、实验题
18、某化学兴趣小组同学在学习了铁的化学性质知识后,对铁和水蒸气反应后的黑色固体产物成分提出质疑,探究过程如下:
(一)定性分析
(1)同学甲认为该固体不可能是氧化铁,理由是________________________。
(2)同学乙设计实验确认黑色固体成分中存在四氧化三铁,具体操作为________________________。
(二)定量分析
(3)图中盛放氢氧化钠溶液的仪器名称是______,装置A中橡皮管的作用是________________________,A装置发生反应的离子方程式为__________________。
(4)B、D处碱石灰的作用分别是______、______。
(5)实验时,取黑色固体置于C中,装置D质量增加,则氧化物的化学式为______。若装置中无干燥管,则会使测得的氧化物中铁的含量______(填“偏大”“偏小”或“无影响”)。
参考答案
1、答案:D
解析:A.过氧化钠中含有共价键,A错误;B.二者互为同位素,B错误;C.元素的化学性质与最外层电子数有关,二者化学性质相同,C错误;D.联氨分子的电子数为18个,D正确。
2、答案:A
解析:A.二氧化碳由二氧化碳分子构成,A错误;B.二氧化硫和浓硫酸中硫为相邻价态,不能反应,B正确;C.根据硫守恒,含有,理论上最多可生成,C正确;D.钠露置空气中发生化学反应最终变为碳酸钠,D正确。
3、答案:A
解析:A.燃油含有多种烃的混合物,A错误;B.两个反应均涉及元素化合价的变化,均为氧化还原反应,B正确;C.CO和NO都属于不成盐氧化物,C正确;D.一氧化碳和一氧化氮反应生成氮气和二氧化碳,D正确。
4、答案:A
解析:A.将绿矾加热,得到红色的氧化铁,铁的化合价发生改变,涉及到氧化还原反应,A正确;B.将碳酸䥻高温煅烧得到生石灰和二氧化碳,该过程中没有任何一种元素的化合价发生变化,因此没有涉及到氧化还原反应,B错误;C.焰色试验属于物理变化,C错误;D.金在自然界以游离态存在,金的冶炼属于物理变化,D错误。
5、答案:D
解析:A.工业上制取漂白粉反应的化学方程式:,A错误;B.与水发生氧化还原反应生成和,根据得失电子守恒和原子守恒配平化学方程式为:,B错误;C.铁和氯气反应只能生成氯化铁,C错误;D.反应物为、、,生成物有,铁元素的化合价降低,则中碳元素的化合价升高,产物中有,根据元素守恒知,产物中还有,配平后为,D正确。
6、答案:B
解析:A、B、C、D是原子序数依次增大的短周期主族元素,B的族序数是周期数的三倍,为0,结合周期表的位置,可知A为氮、D为铝;C的原子半径在短周期主族元素中最大,则C为钠。A.核外电子排布相同的离子,序大径小,故离子半径:氧离子大于钠离子大于铝离子,A错误;B.单质熔点D大于C,B正确;C.氢氧化钠的碱性比氢氧化铝强,C错误;D.非金属性越强,气态氢化物越稳定,故氨气的稳定性比水弱,D错误。
7、答案:B
解析:A.标准状况下,水不是气体,A错误;B.常温下,气体摩尔体积大于,物质的量小于,故所含的原子数目小于,B正确;C.甲烷既是氧化产物有是还原产物,C错误;D.物质的量为,质子数为,D错误。
8、答案:A
解析:A.钠的密度介于水和煤油之间,故在分界面处跳动,钠与水反应生成和,与溶液反应生成白色絮状沉淀,A正确;B.等质量的碳酸钠和碳酸氢钠,碳酸钠产生二氧化碳少,B错误;C.生成的硫酸钙微溶,覆盖在大理石表面,阻碍反应的进行,C错误;D.生成的是胶体不是沉淀,D错误。
9、答案:C
解析:A项中、能将摩尔盐溶于水后产生的氧化为;B项中与不能大量共存;D项中与不能大量共存。
10、答案:D
解析:A.碳酸钠不能用于泡沫灭火器,A错误;B.常温下,铁遇浓硫酸钝化,不是不反应,B错误;C氯气没有漂白性,C错误;D.铝能与酸、碱反应,故不能用铝制容器长期盛放酸性或碱性食物,D正确。
11、答案:A
解析:A.与反应制备,反应的离子方程式为,A正确;B.用溶液腐蚀铜线路板,铁离子和铜反应生成亚铁离子和铜离子,反应的离子方程式为:,B错误;C.氢氧化钡和硫酸铜溶液反应生成硫酸钡和氢氧化铜,该反应的离子方程式为:,C错误;D.碳酸氢根不能拆开,D错误。
12、答案:B
解析:A、氯水中含有三种分子、四种离子,盐酸中只有水分子和三种离子,可以探究有漂白性,A不选;B、氢化物的沸点不能代表非金属性,B满足题意;C、只有碳酸钠和氯化钡反应生成沉淀,可以鉴别,C不选;D、钠活泼,能与冷水发生置换反应,镁不能,D不选。
13、答案:C
解析:酸溶是金属阳离子进入溶液,A说法错误;双氧水作用是氧化亚铁离子,B说法错误;从溶液中得到皓矾需加热浓缩,冷却结晶,过滤洗涤干燥,C说法正确;沉铁时,双氧水氧化亚铁离子,然后和氨水生成氢氧化铁沉淀,D说法错误。
14、答案:C
解析:A.在反应中的化合价降低,作氧化剂,A正确;B.铝和冷水未见明显现象,也可能是反应速率慢造成,B正确;C.在水溶液中很难电离出,属于盐,C错误;D.观察方程式,可知标准状况下,产生,转移电子数目为,D正确。
15、答案:(1)3;VIA
(2)(、和等);量筒、烧杯、玻璃棒
(3)、、
(4);蒸发浓缩、冷却结晶、过滤洗涤干燥;会产生污染性气体,同时引入硝酸根
(5)
解析:(1)硫是16号元素,其原子有3个电子层,最外层有6个电子,为第3周期、第六主族;
(2)检验亚铁离子,可选用溶液,产生蓝色沉淀;配制的硫酸需要量筒、烧杯和玻璃棒,配制硫酸需要量筒、烧杯、玻璃棒、容量瓶和胶头滴管;
(3)焙烧后固体为铁、铜以及硅的氧化物,加入稀硫酸溶解,溶液中阳离子有氢离子、铜离子和铁离子;
(4)铜在稀硫酸中被双氧水氧化为硫酸铜,故离子方程式为;从溶液中得到硫酸铜晶体的操作有蒸发浓缩、冷却结晶、过滤洗涤干燥;不能用稀硝酸溶解铜,因为会产生氮的氧化物污染大气,同时可能留下硝酸根,使产品不纯;
(5)根据关系式,可得结晶水数值为。
16、答案:(1);
(2)
(3)若混用会产生有毒气体氯气,同时降低使用效果(合理答案)
(4);
(5)0.95
解析:(1)为氯的氧化物,结合化合价,可知化学式;氯元素为+1价的酸是次氯酸,化学式为;
(2)与浓盐酸在常温下可用于制取,同时生成氯化钠和水,离子方程式为;
(3)具有强氧化性,能把浓盐酸中的氧化,生成,从而引发氯气中毒,同时降低消毒液和洁厕灵的使用效果;
(4)依题意,该反应的化学方程式为,可知生成的二氧化氯和氧气体积比为;与反应生成和,氯元素化合价从+4价降低到价,得到5个电子,锰元素化合价从+2价升高到+4价失去2个电子,则每消耗,可处理锰离子物质的量为,即为的废水;
(5)、在反应中得到电子被还原产生。由题干信息可得的消毒效率是的倍,
17、答案: (1)
(2)
(3)
(4)(合理都行)
(5)氯化钠和氯化镁为离子化合物,氯化铝为共价化合物
(6);焰色试验
(7)④ 1.68
解析:(1)元素⑤是,其氢化物为;
(2)非金属性越强,气态氢化物越稳定,元素②③④⑨的气态氢化物中,因O的非金属性最强,故最稳定的是;
(3)同周期从前到后金属性逐渐减弱,故碱性最强的是;
(4)氯的非金属性比硫强,故可通过置换反应体现出来;
(5)氯化钠、氯化镁为离子化合物,在融化时能够导电;氯化铝为共价化合物,融化时不导电;
(6)的金属性不如,能够制取钾主要是利用的沸点比的低,而控制温度使气化,其余三种物质均为液体,便于生成的蒸气不断逸出,使反应向生成的方向进行而制得。所以温度应该高于的沸点,高于其余三种物质中熔点最高的的熔点,而低于其余三种物质中沸点最低的的沸点,综上分析,合适的温度范围应大于,小于;由于钾蒸汽和钠蒸汽的沸点差别不是特别大,所以制备的钾蒸汽中可能含有少量的钠蒸汽。检验金属钠可以用焰色试验,钠的焰色为黄色;
(7)①没有洗涤烧杯和玻璃棒,溶质损耗,浓度偏低;②转移溶液时不慎有少量酒到容量瓶外面溶质损耗,浓度偏低;③容量瓶不干燥,含有少量蒸馏水,没有影响;④定容时俯视刻度线,溶液体积偏小,浓度偏大;⑤定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,溶液体积偏大,浓度偏小。根据,可知产生标准状况下氢气为。
18、答案: (1)氧化铁为红棕色,而生成的固体是黑色的
(2)用磁铁吸引(合理即可)
(3)分液漏斗;维持气压,便于液体流下;
(4)除去氢气中的水蒸气,防止干扰试验;吸收水蒸气
(5);偏小
解析:通过装置生成氢气,装置可以除去氢气中混入的水蒸气,在装置中氢气和铁的氧化物发生反应,通过装置吸收反应后生成的水,装置可以防止空气中的水蒸气和二氧化碳进入装置,从而保证实验的准确性。
(1)氧化铁为红色粉末,由题意可知,生成物为黑色固体,故不可能是氧化铁;
(2)氧化亚铁和四氧化三铁的区别是四氧化三铁具有铁磁性,故可用磁铁吸引进行判断。
(3)观察装置,可知为分液漏斗;皮管上下联通,能够维持气压,便于液体流下;铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,故离子方程式为。
(4)由于A中产生的中混有水蒸气,必须干燥除去,防止干扰后续实验,所以的作用是干燥,D中装碱石灰,目的是吸收水蒸气,通过水蒸气的质量计算铁的氧化物中氧的含量。
(5)U形管的质量增加的是水,其物质的量是,则铁氧化物中含氧的质量为,则设的物质的量为,则氧化物的化学式为;干燥管的作用是防止空气中的水和二氧化碳对实验干扰,若无干燥管,空气中的水蒸气和二氧化碳被吸收,使所测水的质量增大,导致氧的含量增大,导致的质量将偏小。
选项
化学事实
哲学观
A
二氧化碳由1个碳原子和2个氧原子构成
微粒观
B
可以用浓硫酸干燥
价态观
C
理论上最多可生成
守恒观
D
钠露置在空气中最终变为白色粉末
变化观
A
工业上制备漂白粉
B
供氢剂与水反应
C
过量铁和氯气反应
D
A
B
D
A钠在分界面处跳动,试管内有白色沉淀生成
B等质量的固体与足量的盐酸反应,乙产生气泡快,反应后甲气球大
C大理石溶解,有大量气泡产生
D向沸水中滴入饱和氯化铁,立即生成红褐色沉淀
选项
物质的性质
实际应用
A
碳酸钠受热不分解
碳酸钠可用作泡沫灭火器
B
铁与浓硫酸常温下不反应
可用钢瓶储运浓硫酸
C
氯气具有漂白性
可作自来水消毒剂
D
铝与强酸、强碱均能反应
不能用铝制容器长期盛放酸性或碱性食物
IA
IIA
IIIA
IVA
VA
VIA
VIIA
一
二
①
②
③
④
三
⑤
⑥
⑦
⑧
⑨
⑩
物质
熔点
沸点
97.81
890
63.65
770
801
1465
776
1437
相关试卷
这是一份安徽省皖豫名校联盟2023-2024学年高三上学期12月第二次考试化学试卷含答案,共19页。试卷主要包含了某物质的结构如图所示,某可充电电池的原理如图所示等内容,欢迎下载使用。
这是一份2024安徽省皖豫名校联盟高三上学期第二次联考化学试卷含解析,文件包含安徽省皖豫名校联盟2023-2024学年高三上学期毕业班第二次考试化学试卷含解析docx、安徽省皖豫名校联盟2023-2024学年高三上学期毕业班第二次考试化学试卷无答案docx等2份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。
这是一份2024安徽省皖豫名校联盟高三上学期第二次联考化学试卷含解析,文件包含安徽省皖豫名校联盟2023-2024学年高三上学期毕业班第二次考试化学试卷含解析docx、安徽省皖豫名校联盟2023-2024学年高三上学期毕业班第二次考试化学试卷无答案docx等2份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。









