
人教版化学九年级下册同步讲义金属资源的利用和保护(提高) 巩固练习(含解析)
展开金属资源的利用和保护(提高)
撰稿:熊亚军 审稿:于洋
【巩固练习】
一、选择题 (每小题只有一个选项符合题意)
1.(兰州中考)下列说法中正确的是( )
A.废旧电池可以随意丢弃 B.铁矿石可以随意开采
C.被腐蚀的铁制品应该加以回收利用 D.铁丝在氧气中燃烧生成氧化铁
2.(兰州中考)铁在下列哪种情况下最容易生锈( )
A.在干燥的空气中 B.部分浸入食盐水中
C.在潮湿的空气中 D.浸沉在植物油中
3.人类每年从自然界中提取大量的金属铁。下列关于铁的说法正确的是( )
A.炼铁的过程是把单质铁变成氧化铁
B.钢是很纯的铁
C.生铁是含少量碳的铁合金
D.被腐蚀的铁制品属于不可回收垃圾
4.关于铁生锈的下列说法中正确的是( )
①铁生锈是铁在干燥的空气中与氧发生反应
②铁锈的成分就是Fe2O3
③铁锈很疏松,易吸水
④全世界每年因生锈而损失的钢铁占世界钢铁年产量的四分之一
A.①② B.②③ C.③④ D.①④
5.下列有关金属或金属资源的叙述中正确的是( )
A.钢是指更纯净的铁
B.废弃易拉罐无回收价值
C.铝合金硬度大、密度小,可做门窗、飞机等
D.赤铁矿的主要成分是四氧化三铁
6.过量的铁粉投入盛有硫酸和硫酸铜的混合溶液的烧杯里,反应完毕后过滤,在滤液里含有的物质是( )
A.Fe2(SO4)3 B.CuSO4 C.FeSO4 D.H2SO4
7.在氧化铜和铁粉的混合物中,加入一定量的稀硫酸,微热,待反应停止后过滤,再向滤液中入一枚铁钉,过一会儿取出,发现铁钉无变化,根据上述现象作出的判断中正确的是( )
A.不溶物一定是铜 B.不溶物一定是铁
C.滤液是硫酸亚铁溶液 D.滤液是硫酸亚铁和硫酸铜的混合溶液
8.用2000t含Fe2O375%的赤铁矿石,可炼出含杂质3%的生铁( )
A.1082.5t B.1600t C.1096t D.1050t
9.2.8g一氧化碳在高温下跟5.8g某种铁的氧化物恰好完全反应,这种氧化物是( )
A.FeO B.Fe2O3 C.Fe3O4 D.Fe2O3·nH2O
二、填空题
10.下列做法能防止铁制品生锈的是 (填序号)。
①在铁制水管外镀锌;②切完菜后,尽快将菜刀洗净擦干;③炒完菜后,立即刷锅用余热使锅烘干;④把铁制容器置于室外,让雨水经常冲洗
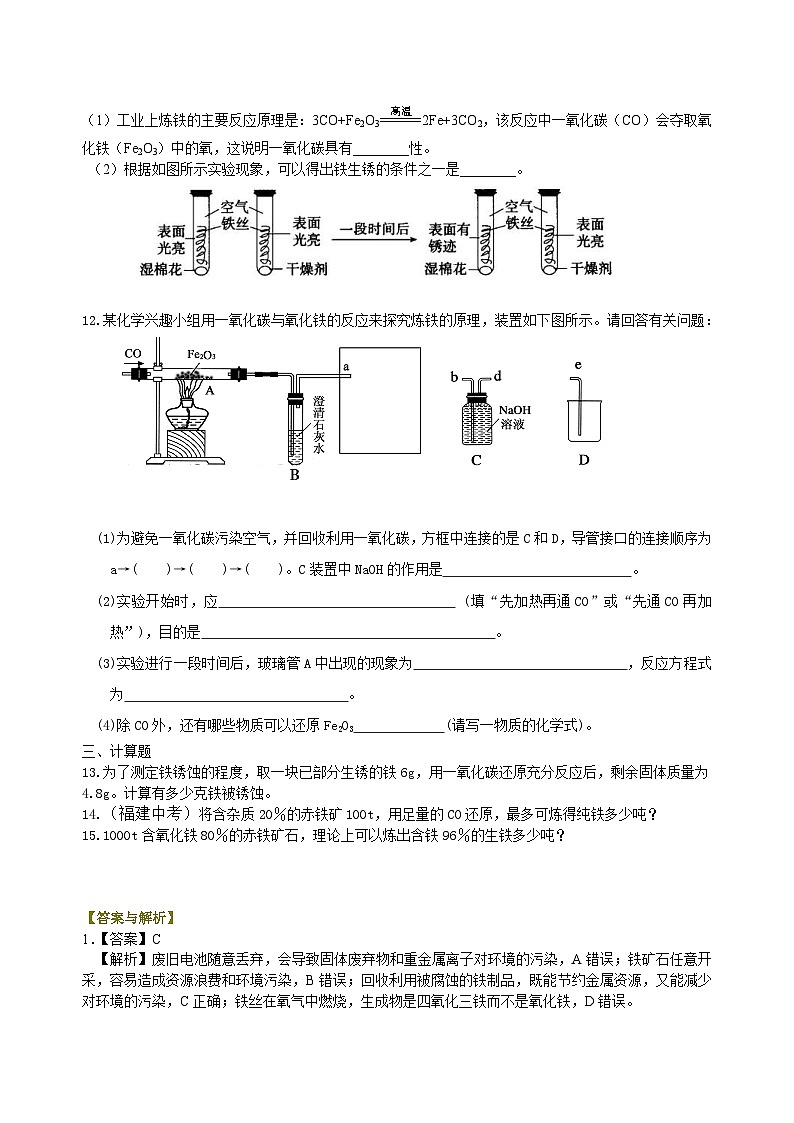
11.(浙江中考)铁的使用非常广泛,但较容易锈蚀。
(1)工业上炼铁的主要反应原理是:3CO+Fe2O32Fe+3CO2,该反应中一氧化碳(CO)会夺取氧化铁(Fe2O3)中的氧,这说明一氧化碳具有________性。
(2)根据如图所示实验现象,可以得出铁生锈的条件之一是________。
12.某化学兴趣小组用一氧化碳与氧化铁的反应来探究炼铁的原理,装置如下图所示。请回答有关问题:
(1)为避免一氧化碳污染空气,并回收利用一氧化碳,方框中连接的是C和D,导管接口的连接顺序为a→( )→( )→( )。C装置中NaOH的作用是 。
(2)实验开始时,应 (填“先加热再通CO”或“先通CO再加热”),目的是 。
(3)实验进行一段时间后,玻璃管A中出现的现象为 ,反应方程式为 。
(4)除CO外,还有哪些物质可以还原Fe2O3 (请写一物质的化学式)。
三、计算题
13.为了测定铁锈蚀的程度,取一块已部分生锈的铁6g,用一氧化碳还原充分反应后,剩余固体质量为4.8g。计算有多少克铁被锈蚀。
14.(福建中考)将含杂质20%的赤铁矿100t,用足量的CO还原,最多可炼得纯铁多少吨?
15.1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁多少吨?
【答案与解析】
1.【答案】C
【解析】废旧电池随意丢弃,会导致固体废弃物和重金属离子对环境的污染,A错误;铁矿石任意开采,容易造成资源浪费和环境污染,B错误;回收利用被腐蚀的铁制品,既能节约金属资源,又能减少对环境的污染,C正确;铁丝在氧气中燃烧,生成物是四氧化三铁而不是氧化铁,D错误。
2.【答案】B
【解析】A项缺少水,铁不易生锈;B项铁与氧气、水同时接触,容易生锈,食盐还会加速铁的锈蚀;C项铁与氧气、水同时接触,容易生锈;D项隔绝空气和水,铁不易生锈。故最容易生锈的是B。
3.【答案】C
【解析】生铁和钢都是铁碳合金,当然其中还有一些别的合金元素,所以B错C对;而A所说刚好相反,炼铁的原理可表示为:Fe2O3 + 3CO2Fe + 3CO2。
4.【答案】C
【解析】铁锈的主要成分是氧化铁。铁锈很疏松,易吸水。铁制品表面的锈如不及时除去,会加快铁制品的生锈速度。据估计,全世界每年因生锈而损失的钢铁占世界钢铁年产量的四分之一。
5.【答案】C
【解析】钢是铁与碳组成的合金,还含有其他元素;废弃易拉罐主要成分是铝,有回收价值;赤铁矿的主要成分是Fe2O3。
6.【答案】C
【解析】因为铁粉过量,发生两个置换反应:
Fe+CuSO4=FeSO4+Cu Fe+H2SO4=FeSO4+H2↑
铁单质参加置换反应时,生成的化合物中铁元素为+2价。上述反应滤液中只含有FeSO4,滤纸上留下的是Cu和Fe粉。
7.【答案】C
【解析】在氧化铜和铁粉的混合物中加入稀硫酸,可能发生的反应:CuO+H2SO4=CuSO4+H2O,Fe+H2SO4=FeSO4+H2↑,Fe+CuSO4=FeSO4+Cu。向滤液中加入铁钉无变化(不反应),说明滤液中无CuSO4和H2SO4,只含FeSO4,故C正确,D不正确。滤液中无CuSO4,说明生成的CuSO4又被铁粉反应掉Fe+CuSO4=FeSO4+Cu,所以不溶物中一定含铜,但铁粉也有可能过量,所以A、B不正确。
8.【答案】A
【解析】设可炼出含杂质3%的生铁的质量为X。依题意列式:(1-3%)x=2000t×75%×112÷160,解得x=1082.5t。
9.【答案】C
【解析】
10.【答案】①②③
【解析】铁制品在室外与空气接触,经过水淋湿很容易生锈,在其表面镀锌或保持铁制品表面洁净和干燥是防锈的好方法。
11.【答案】(1)还原 (2)与水接触
【解析】(1)能夺取氧化物中的氧的物质具有还原性。(2)仔细观察两个试管可看出,它们的不同之处是第一个试管中有水,第二个试管中没有水,因此可得出铁生锈要有水的参与。
12.【答案】(1)d、b、e 除去残余的二氧化碳
(2)先通一氧化碳再加热 赶尽玻璃管内的空气,防止加热爆炸
(3)固体由红棕色变成黑色 Fe2O3 + 3CO2Fe + 3CO2
(4)C或H2
13.【答案】2.8g
【解析】铁锈中氧元素的质量为6g-4.8g=1.2g,铁锈(Fe2O3)中与氧结合的铁元素质量为
14.【答案】
15.【答案】
解:1000t赤铁矿石中含氧化铁的质量为1000t×80%=800t。
设800t氧化铁理论上可以炼出铁的质量为x。
含铁96%的生铁的质量为:560t÷96%=583.3t
答:1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁583.3t。









