



人教版 (2019)必修 第一册第四章 物质结构 元素周期律第三节 化学键教学课件ppt
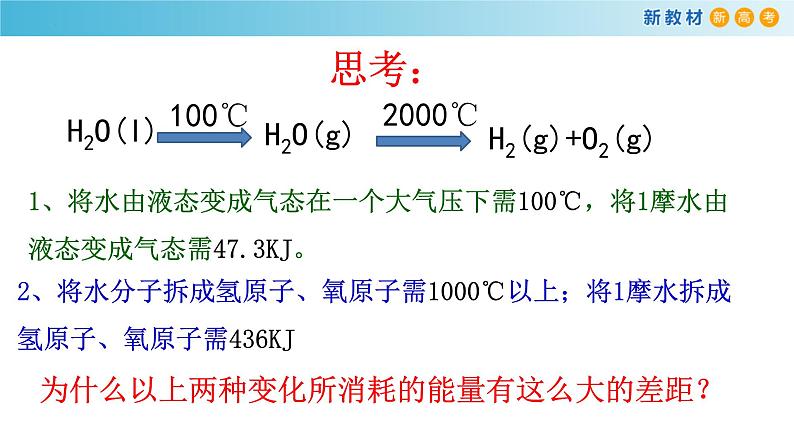
展开1、将水由液态变成气态在一个大气压下需100℃,将1摩水由液态变成气态需47.3KJ。
2、将水分子拆成氢原子、氧原子需1000℃以上;将1摩水拆成氢原子、氧原子需436KJ
为什么以上两种变化所消耗的能量有这么大的差距?
H2(g)+O2(g)
第3课时化学键 分子间作用力
认识化学键的断裂和形成是化学反应中物质变化的实质及能量变化的主要原因。
了解分子间作用力及简单应用
相邻的原子之间强烈的相互作用叫做化学键
形成性质各异的微粒和物质;一百多种元素的原子构成物质已超过1亿种
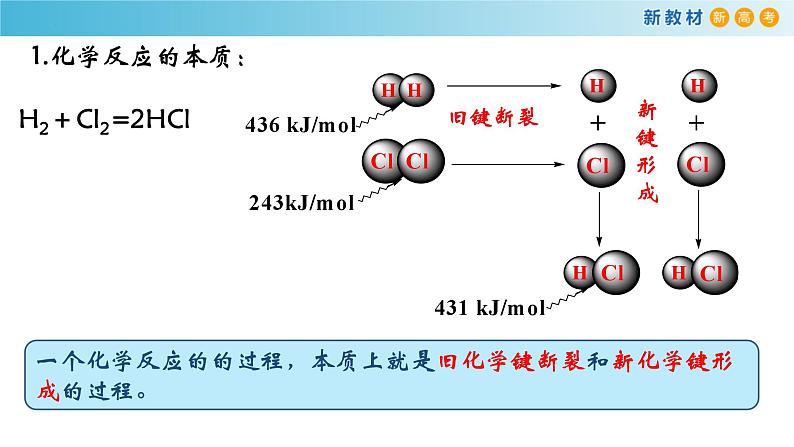
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
H2+Cl2=2HCl
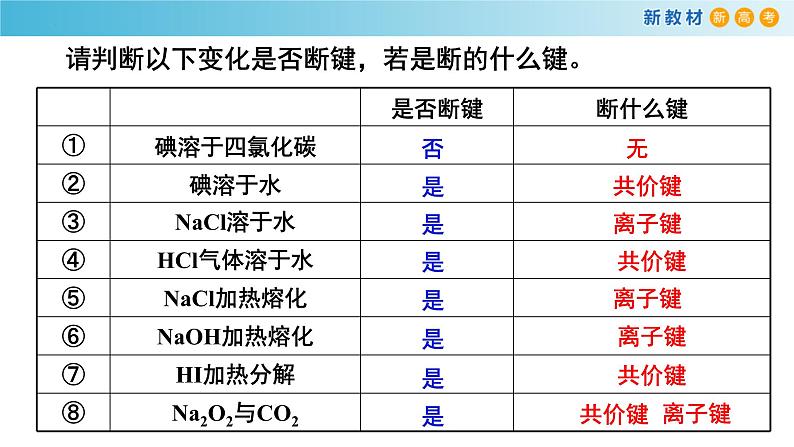
请判断以下变化是否断键,若是断的什么键。
只有旧化学键断裂没有新化学键形成的变化是化学变化吗?
化学反应中反应物中的化学键会全部被破坏吗?
例如: (NH4)2SO4 + BaCl2 = BaSO4↓ + 2NH4Cl
SO4 2-中的共价键没有断裂
2、化学反应的本质是旧化学键的断裂和新化学键的形成,只有化学键的断裂,不一定是化学变化,如熔融NaCl。3、物质中不一定都存在化学键,如He等稀有气体分子。4、非金属元素的两个原子之间能形成共价键,但多个非金属元素原子间也可能形成离子键,如NH4Cl。
1、化学反应中反应物的化学键不一定全部被破坏
2.物质熔化和溶解过程中化学键的变化(1)离子化合物的溶解或熔化过程离子化合物 电离 阴、阳离子。
(2)共价化合物的溶解或熔化过程中化学键的变化①溶解过程a.与水反应——共价键被破坏。如:CO2、SO2b.电解质溶于水——共价键被破坏。如:HCl、H2SO4、HNO3c.非电解质溶于水——共价键不被破坏,只破坏分子间作用力。如:乙醇、蔗糖等
②熔化过程a.由分子构成的共价化合物(分子晶体)——共价键不被破坏,只破坏分子间作用力。如:冰、干冰、蔗糖等多数共价化合物。b.由原子构成的共价化合物(原子晶体)——共价键被破坏。 如:SiO2晶体等少数共价化合物
练习在下列变化中,①碘的升华;②烧碱熔化;③MgCl2溶于水;④HClO溶于水;⑤Na2O2溶于水,未发生化学键破坏的是________(填写序号,下同),仅发生离子键破坏的是________,仅发生共价键破坏的是________,既发生离子键破坏,又发生共价键破坏的是________。
分子间作用力: (也叫范德华力)。把分子聚集在一起的作用力。对物质的熔点、沸点等有影响。
根据上述物质的变化过程,你能比较出分子间作用力和化学键的强弱吗?
物理变化(物质的聚集状态发生变化)
化学变化(原子重新组合)
阅读课本P110表了解分子间作用力
(3)变化规律: 对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的溶沸点越高。如:I2>Br2> Cl2> F2
分子间作用力比化学键弱得多,是一种微弱的相互作用,它主要影响物质的熔点、沸点、溶解性等物理性质,而化学键主要影响物质的化学性质。
(2)分子间作用力主要存在于由分子构成的物质中,如:多数非金属单质、稀有气体、非金属氧化物、酸、非金属氢化物、有机物等分子之间。
一般来说,相对分子质量越大,分子间作用力越大,物质的熔、沸点越高。如卤素单质:
应用:对于四氟化碳、四氯化碳、四溴化碳、四碘化碳,其熔沸点如何变化?
归纳:分子间作用力与化学键的比较
影响化学性质和物理性质
影响物理性质(熔沸点等)
为什么HF、H2O和NH3的沸点会反常呢?
分子之间存在着一种比范德华力稍强的相互作用,这种相互作用叫氢键。
2.氢键--一种特殊的分子间作用力
①氢键的存在使物质的熔沸点相对较高(如HF、H2O)。
③解释一些反常现象:如水结成冰时,为什么体积会膨胀。
②氢键的形成使某些物质在水中的溶解度增大(如NH3溶于水)
1)形成条件:原子半径小,非金属性强的原子(N、O、F)与H原子形成强极性共价键,与另一个分子中的半径较小,非金属性很强的原子Y (N、O、F),在分子间H与Y产生较强的静电吸引,形成氢键
2)表示方法:X—H…Y—H(X.Y可相同或不 同,一般为N、O、F)。
3)氢键能级:比化学键弱很多,但比分子间作用力稍强
氢键也是一种分子间作用力,它比化学键弱,但比范德华力强,氢键会使物质的熔点和沸点升高。
形成氢键的分子:HF、H20、NH3
结果1:氢键的形成会使含有氢键的物质的熔、沸点大大升高。如:水的沸点高、氨易液化等。这是因为固体熔化或液体汽化时,必须破坏分子间作用力和氢键
结果2:氢键的形成对物质的溶解性也有影响,如:NH3极易溶于水。
氢键作用:使物质有较高的熔沸点(H2O、HF 、NH3) ,使物质易溶于水
CH4 SiH4 GeH4 SnH4
H2O H2S H2Se H2Te
HF HCl HBr HI
NH3、H2O、HF的沸点偏高
右图为某些氢化物的沸点。你能找出其中的规律吗?
有氢键,反常高。无氢键,看分子间作用力。相对分子质量越大,分子间作用力越大,物质的熔点、沸点越高!
1.下列说法正确的是A.分子间作用力与化学键大小相当B.分子间作用力是一种很强的作用力C.分子间作用力主要影响物质的化学性质D.分子内部相邻原子之间的相互作用为化学键,而分子间也相互作用,为分子间作用力
2.下列关于氢键的说法不正确的是A.HF的沸点比HCl的沸点高是由于HF分子间存在氢键B.水结冰时体积膨胀是由于水分子之间存在氢键C.NH3的稳定性很强是因为其分子间能形成氢键D.在氨水中水分子和氨分子之间也存在着氢键
化学人教版 (2019)第三节 化学键教学课件ppt: 这是一份化学人教版 (2019)第三节 化学键教学课件ppt,共33页。PPT课件主要包含了素养要求,化学键,当堂练习等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二节 金属材料教学课件ppt: 这是一份人教版 (2019)必修 第一册第二节 金属材料教学课件ppt,共20页。PPT课件主要包含了学习目标,特别注意,课堂小练,新型合金,记忆合金等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第一节 铁及其化合物教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第一节 铁及其化合物教学课件ppt,共20页。PPT课件主要包含了学习目标,第3课时铁盐和亚铁盐等内容,欢迎下载使用。













