




人教版 (2019)第一节 原子结构与元素周期表教学ppt课件
展开位于元素周期表VIIA族(第17纵列)的元素氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At)都能与Na、K、Ca、Mg等金属化合成盐,所以统称为卤素(成盐元素之意)。 卤族元素(简称卤族)是典型的非金属元素,它们在自然界中都以化合态存在。
第4课时原子结构与元素性质——卤族元素
了解卤族元素在周期表中的位置及原子结构特征。
了解卤族元素性质的相似性和递变性。
领悟同主族结构和性质的相似性和递变性。
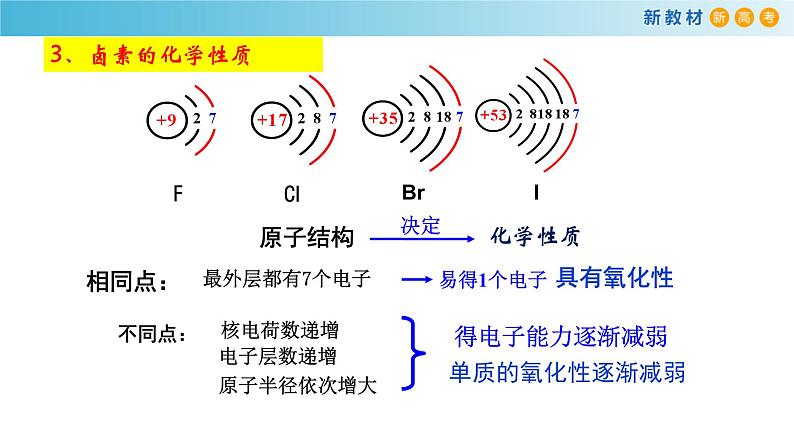
1.卤族元素的原子结构
【小结】卤素原子结构的相似性和递变性。
相同点:卤族元素原子结构的最外层电子数.相同都为7个。
递变性:从 F 到 I
①核电荷数依次增大;②电子层数依次增加;③原子半径依次增大。
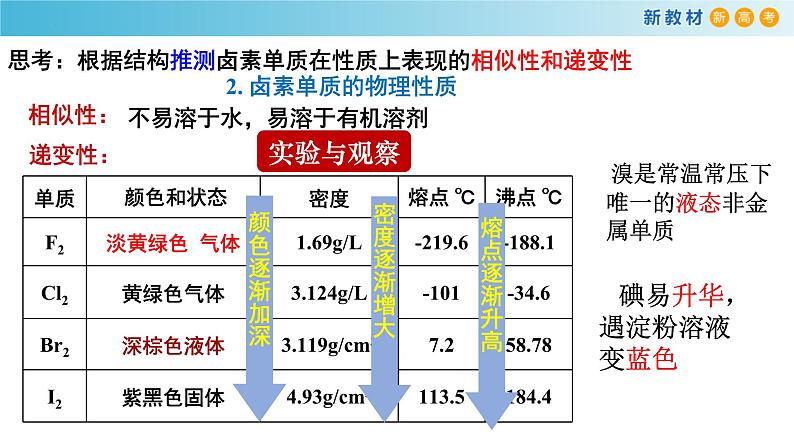
2. 卤素单质的物理性质
不易溶于水,易溶于有机溶剂
溴是常温常压下唯一的液态非金属单质
碘易升华,遇淀粉溶液变蓝色
思考:根据结构推测卤素单质在性质上表现的相似性和递变性
( X=F、Cl、Br、I )
卤素单质的化学性质(类比氯气的化学性质并对比出区别)
F2 Cl2 Br2 I2
与氢气反应的难易程度: 生成氢化物的稳定性: 卤素的非金属性强弱:
元素非金属性强弱判断方法:①最高价氧化物的水化物的酸性强弱②与氢气生成气态氢化物的难易程度及稳定性
2Fe+3X2=2FeX3
(X=F、Cl、Br)
H2O + X2 ⇌ HX + HXO
(X=Cl、Br、I难度逐渐加大)
2H2O + 2F2 = 4HF + O2 反应剧烈
2NaOH + X2 = NaX + NaXO + H2O
认真观察实验现象,分析卤素单质间的氧化性强弱
2KBr+Cl2= 2KCl +Br2
2I- + Cl2 = 2Cl- + I2
2Br-+Cl2= 2Cl- +Br2
2KI + Cl2 = 2KCl + I2
Br2 + 2KI = 2KBr + I2
Br2 + 2I- = 2Br- + I2
氧化性:F2>Cl2>Br2>I2还原性:F-
卤族元素原子结构和性质的递变性:
同主族元素的原子结构与性质的关系
2F2 + 2H2O = 4HF + O2 (剧烈反应)
通式:X2 + H2O = HX + HXO (X=Cl、Br、I 但≠F)
I2 + H2O = HI + HIO
Br2 + H2O = HBr + HBrO
Cl2 + H2O = HCl + HClO
最高价氧化物对应水化物的酸性
HClO4>HBrO4>HIO4
(1)氟元素无正价,无含氧酸。F-的还原性极弱。(2)X2+H2O===HX+HXO 而 2F2+2H2O===4HF+O2。(3)Br2在常温下是唯一的一种 液态 非金属单质。(4)碘为紫黑色固体,易升华,淀粉遇 I2 变蓝色。(5)氢氟酸为弱酸,而盐酸、氢溴酸、氢碘酸为强酸。(6)除氟化银外,其余卤化银均为沉淀。氟化银、氯化银为白色,溴化银为淡黄色,碘化银为黄色。
【例题1】判断下列有关卤族元素性质描述的正误(正确的打“√”,错误的打“×”)。(1)随核电荷数增加,单质熔、沸点降低 ( )(2)随核电荷数增加,单质氧化性增强 ( )(3)随核电荷数增加,气态氢化物稳定性逐渐增强 ( )(4)从上到下原子半径逐渐减小 ( )(5)从上到下非金属性逐渐减弱 ( )
【例题2】下列关于卤素(用X表示)的叙述中,正确的是( )A.卤素单质与水反应均可用X2+H2O===HXO+HX表示B.HX的热稳定性随卤素核电荷数增加而增强C.卤素单质的颜色F2→I2随相对分子质量增大而加深D.卤素单质越活泼,其熔点和沸点就越高
【例题6】卤素按F、Cl、Br、I的顺序其非金属性逐渐减弱的原因是( )A.原子核内质子数增多起主要作用B.相对原子质量逐渐增大起主要作用C.其单质的密度增大起主要作用D.随着核电荷数增加电子层数增大起主要作用
1. 卤族元素是最活泼的一族非金属元素,下列关于卤族元素的说法正确的是( )A.卤族元素单质的最外层电子数都是7B.从上到下,卤族元素原子的电子层数依次增多,半径依次减小C.从F到I,原子核对最外层电子的吸引能力依次减弱,原子的得电子能力依次减弱D.卤族元素单质与H2化合的难易程度为F2
3、依据下列说法来判断相应元素的金属性、非金属性强弱,不合理的是( )A.卤素单质Cl2、Br2、I2的氧化性强弱B.气态氢化物 NH3、H2O、HF的稳定性C.碱金属单质 Li、Na、K与水反应的剧烈程度D.1 ml Na、Mg、Al分别与足量盐酸反应时失去电子数的多少
人教版 (2019)必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表教课课件ppt: 这是一份人教版 (2019)必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表教课课件ppt,共1页。
高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表教学课件ppt,共20页。PPT课件主要包含了思考交流,学习目标,原子结构与元素性质等内容,欢迎下载使用。
人教版 (2019)必修 第一册第一节 原子结构与元素周期表教学ppt课件: 这是一份人教版 (2019)必修 第一册第一节 原子结构与元素周期表教学ppt课件,共20页。PPT课件主要包含了门捷列夫与元素周期律,学习目标,VIII族等内容,欢迎下载使用。













