


河北省邢台市2023-2024学年高三上学期10月质检联盟期中考试化学试题
展开
这是一份河北省邢台市2023-2024学年高三上学期10月质检联盟期中考试化学试题,共13页。试卷主要包含了可能用到的相对原子质量,化学给人带来了多彩的美,下列类比合理的是等内容,欢迎下载使用。
本试卷满分 100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.可能用到的相对原子质量:H1 C12 O16 Na23 S32 Fе56 Cu 64
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.文物具有丰富的内涵和不菲的价值。下列文物的主要材质属于金属材料的是
A.素纱单衣
B. 良渚玉琮
C.兽首玛瑙杯
D.错金四神几何纹长颈铜壶
2.下列各组变化中,前者属于吸热反应,后者属于放热反应的是
A.生石灰与水反应;酸碱中和反应
B.八水合氢氧化钡与氯化铵反应;铝单质与氧化铁反应
C.工业煅烧石灰石;C与 CO₂ 的反应
D.化石能源的燃烧;过氧化氢的分解
3.科技是第一生产力,我国科学家在诸多领域取得了重大成就。下列说法错误的是
A.科学家利用CO₂合成了脂肪酸,CO₂与CO组成元素相同,性质也相同
B.嫦娥五号带回的嫦娥石 Ca₈YFePO₄₇为难溶于水的无机盐
C.“奋斗者”号深潜器使用了钛合金新材料,钛合金的硬度比钛大
D.“祝融号”火星车采用了新型铝基碳化硅复合材料,碳化硅为共价晶体
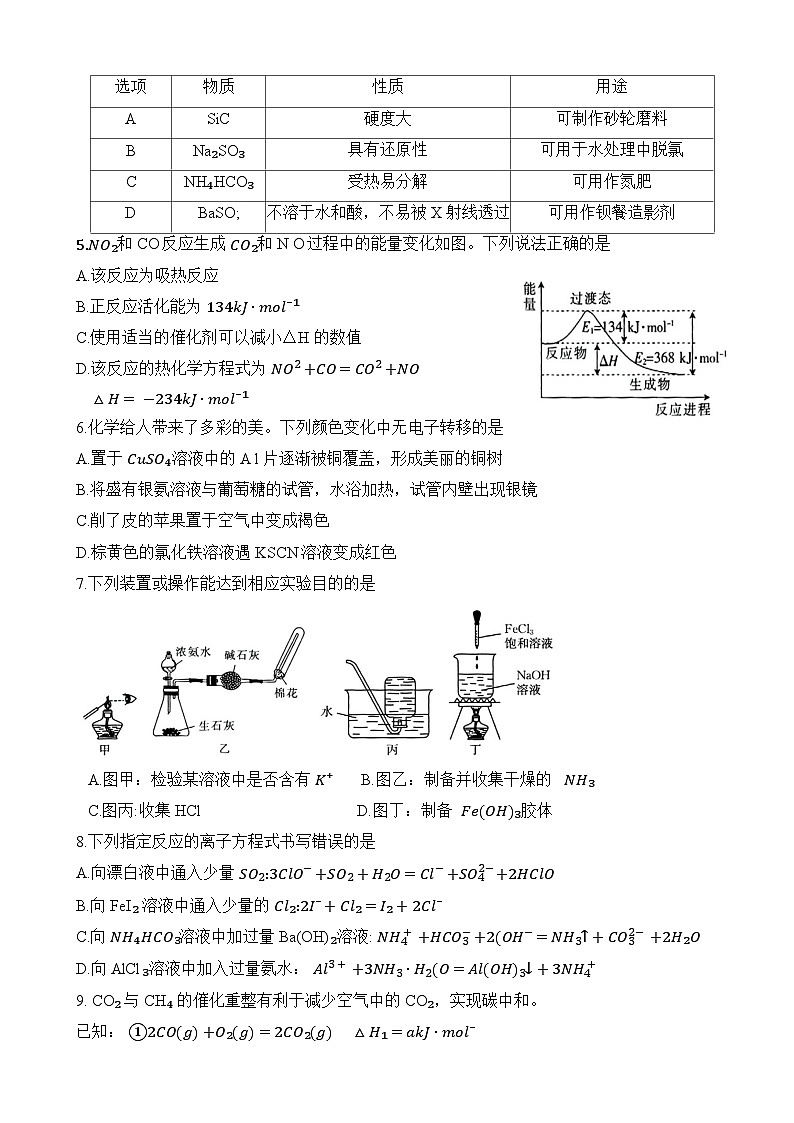
4.下列有关物质的性质与用途不具有对应关系的是
5.NO₂和CO反应生成 CO₂和N O过程中的能量变化如图。下列说法正确的是
A.该反应为吸热反应
B.正反应活化能为 134kJ⋅ml⁻¹
C.使用适当的催化剂可以减小△H 的数值
D.该反应的热化学方程式为 NO2+CO=CO2+NO
△H= −234kJ⋅ml⁻¹
6.化学给人带来了多彩的美。下列颜色变化中无电子转移的是
A.置于 CuSO₄溶液中的A l片逐渐被铜覆盖,形成美丽的铜树
B.将盛有银氨溶液与葡萄糖的试管,水浴加热,试管内壁出现银镜
C.削了皮的苹果置于空气中变成褐色
D.棕黄色的氯化铁溶液遇 KSCN溶液变成红色
7.下列装置或操作能达到相应实验目的的是
A.图甲:检验某溶液中是否含有 K⁺ B.图乙:制备并收集干燥的 NH₃
C.图丙:收集 HCl D.图丁:制备 FeOH₃胶体
8.下列指定反应的离子方程式书写错误的是
A.向漂白液中通入少量 SO2:3ClO−+SO2+H2O=Cl−+SO42−+2HClO
B.向 FeI₂ 溶液中通入少量的 Cl₂:2I⁻+Cl₂=I₂+2Cl⁻
C.向 NH₄HCO₃溶液中加过量Ba(OH)₂溶液: NH4++HCO3−+2(OH−=NH3↑+CO32− +2H₂O
D.向 AlCl₃溶液中加入过量氨水: Al3++3NH3⋅H2(O=AlOH3↓+3NH4+
9. CO₂ 与CH₄ 的催化重整有利于减少空气中的CO₂,实现碳中和。
已知: ①2COg+O₂g=2CO₂g △H₁=akJ⋅ml⁻
②2H2 g+O2g=2H2Og △H2=bkJ⋅ml−1
③CH₄g+2O₂g=CO₂g+2H₂Og △H₃=ckJ⋅ml⁻¹
则 CH₄g+CO₂g⇌2COg+2H₂g的 △H₄ 为
A.−a−b+ckJ⋅ml⁻¹ B.a+b−ckJ⋅ml⁻¹
C.−a+b−ckJ⋅ml⁻¹ D.a−b−ckJ⋅ml⁻¹
10.下列类比合理的是
A. Al 与 NaOH 溶液反应生成 H₂,,则 Fe与 NaOH溶液反应生成 H₂
B. NaClO溶液与少量( CO₂反应生成 NaHCO₃和H ClO,则( CaClO₂溶液与少量 CO₂反应生成 CaHCO₃₂和HClO
C. FeS与稀硫酸反应生成 H₂S,,则CuS与稀硫酸反应生成 H₂S
D. Na 与 H₂O反应生成NaOH和 H₂,则K与 H₂O反应生成KOH和 H₂
11.Na₂O₂属于钠的化合物,具有很强的氧化性。少量 Na₂O₂与 FeCl₂溶液能发生如下反应: Na₂O₂+FeCl₂+H₂O→FeOH₃+FeCl₃+X(方程式未配平),设 NA为阿伏加德罗常数的值,下列说法错误的是
⋅L⁻¹FeCl₂溶液含 Cl⁻的数目为 2NA
B.1mlFeCl₃可制得 FeOH₃的胶粒数为 NA
C.78gNa₂O₂含有共价键的数目为 NA
D. 每生成 1 ml X,转移的电子数为. NA
12.江南大学化工学院一团队研究发现的稀土铈基低温耐硫脱硝催化剂的反应历程如图所示(“□”代表空位)。下列叙述正确的是
A.上述循环中S的化合价始终不变
B.历程⑥中 Ce、Ti形成共价键的数目未发生变化
C. 历程③中每生成1ml氮气, Ti 转移1ml电子
D. 总反应的化学方程式为 2NH₃+NO+O₂=N₂+3H₂O
13.已知:由最稳定的单质合成 1 ml 某物质的反应焓变叫做该物质的摩尔生成焓,用
△HkJ⋅ml⁻¹表示,最稳定的单质的摩尔生成焓为0。有关物质的. △H如图所示,下列有关判断正确的是
A.H₂Ol的摩尔生成焓 △H=−241.8kJ⋅ml⁻¹
B. 根据图给数据,可求得 N₂H₄1的燃烧热
C.相同状况下,NO 的摩尔生成焓比 NH₃的摩尔生成焓数值大
₂g与 1.5mlH₂g充分反应,放出 45.9 kJ 的 热量
14.某稀硫酸和稀硝酸的混合溶液体积为100mL,向其中逐渐加入铁粉,产生气体体积(已折合成标准状况下)随加入铁粉的质量变化曲线如图所示。下列说法正确的是(已知:硝酸只被还原为 NO气体,忽略反应过程中溶液体积的变化)
A.当加入 3m₁g铁粉时,反应后溶液中的溶质为 FeSO₄和 FeNO₃₃
B. 混合溶液中 H₂SO₄的物质的量浓度为 0.2ml⋅L⁻¹
C.转移电子的物质的量之比: n0a:nbc=3:1
D.100 mL该混合溶液最多能溶解12.8g 铜粉
二、非选择题:本题共4小题,共58分。
15.(14分)已知几种含碳物质间的转化及能量变化关系如图所示。
(1)写出表示CO燃烧热的热化学方程式: 。
(2)反应 Cs+2H₂g=CH₄g△H= kJ⋅ml⁻¹,该反应中反应物的总键能 (填“大于”、“小于”或“等于”)生成物的总键能。 若18g C(s)与 H₂g反应,完全转化成 CH₄g,,需要 (填“吸收”或“放出”) kJ能量。
(3)在 25 ℃、101 kPa下, 30g由( CH₄和 CO组成的混合气体完全燃烧生成( CO₂和液态水,放出热量 1031.8 kJ。则混合气体中 CH₄和 CO的物质的量分别为 ml、 ml。
16.(14分)某些物质之间的转化关系如图所示(注:部分产物未写出,部分反应条件略去)。已知,常温下 A、D、E均为无色无味的气体,C是一种能使湿润的红色石蕊试纸变蓝的气体,B为常被人们誉为生命之源的液体,X分解得到的产物 A、B、C的物质的量之比为1∶1∶2。
(1)X、G 的化学式依次为 、 。
(2)写出C的一种常见用途: ;E、F的大量排放会造成雾霾、 (填一种)等环境问题。
(3)反应⑤中每生成0.1m l E时,参与反应的还原剂在标准状况下的体积为 L;已知,反应⑦为加热条件下G的浓溶液与 H的反应,写出反应⑦的化学方程式: 。
(4)写出反应⑧的离子方程式: 。为验证某集气瓶中充满的未知气体为E,请设计合理的操作步骤并预设现象: 。
17.(15分) SO₂是一种主要的大气污染物,对它的应用或处理不恰当均会造成环境污染。某化学兴趣研究小组设计的有关 SO₂的实验如下。
Ⅰ.制取 SO₂并验证其性质。
(1)图1中仪器a的名称为 。
(2)由于 SO₂易溶于水,所以最好在装置①之前加装 装置。
(3)有同学建议将铜片与浓硫酸反应制备 SO₂的装置用图2装置代替,请说出图2装置的
优点: (填一点)。
(4)设计实验证明试管①中验证的 SO₂具有的性质是可逆的: 。 试管②中盛装的是新制的 H₂S溶液,发生反应的化学方程式为 。试管③中溴水褪色,说明二氧化硫具有 性。
Ⅱ.制备硫代硫酸钠( Na₂S₂O₃。
(5)图3中 NaOH溶液的作用是 。
(6)三口烧瓶中制得 Na₂S₂O₃的总反应的离子方程式为 ;当反应结束(此时溶液的pH为7左右)后,若向三口烧瓶中继续通入; SO₂,,请猜测可能出现的现象: 。
(7)若起始时三口烧瓶中的混合溶液中含 3.9gNa₂S和足量的 Na₂CO₃,,若不考虑 SO₂在水中的溶解,则理论上将三口烧瓶中的 Na₂S完全转化为 Na₂S₂O₃需消耗标准状况下 L SO₂。
18.(15分)某湿法炼锌的萃余液中含有 Na⁺,Zn²⁺,Fe²⁺、Mn²⁺、C²⁺,Cd²⁺及 30∼60g⋅L⁻¹ H₂SO₄等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图:
已知:
回答下列问题:
(1)常温下,若实验测得某种萃余液中硫酸的浓度为 49g⋅L⁻¹,则此溶液中 cH₂SO₄= ml·L⁻¹;若实验室用98%的浓硫酸(密度为 1.84g⋅mL⁻¹)配制250 mL该浓度的硫酸,需量
取 (保留至小数点后一位)mL98%的浓硫酸。
(2)在酸性条件下,加入 Na₂S₂O₈氧化时, Mn²转化为 MnO₂除去,写出生成 MnO₂反应的离子方程式: 。
(3)常温下,中和时,先调节 pH约为 1,加入适量的 Na₂S₂O₈氧化,再调节pH为 4.0,“沉渣”的主要成分除 MnO₂外还有 (填化学式,下同)。若加入过量的 Na₂S₂O₈,钴元素将会进入“沉渣”中,则钴元素在“沉渣”中的存在形式为 。
(4)“沉锌”时,在近中性条件下加入 Na₂CO₃可得碱式碳酸锌 ZnCO₃⋅2ZnOH₂⋅H₂O固体,同时产生大量气体,该气体的化学式为 。
(5)写出 ZnCO₃⋅2ZnOH₂⋅H₂O在加热条件下制备氧化锌的化学方程式: 。
(6)不同质量分数的) Na₂SO₄溶液在不同温度下析出 Na₂SO₄晶体的物种如图所示。欲从含20% Na₂SO₄及微量杂质的“沉锌后液”中直接析出无水 Na₂SO₄,“操作a”为 。
选项
物质
性质
用途
A
SiC
硬度大
可制作砂轮磨料
B
Na₂SO₃
具有还原性
可用于水处理中脱氯
C
NH₄HCO₃
受热易分解
可用作氮肥
D
BaSO;
不溶于水和酸,不易被X射线透过
可用作钡餐造影剂
沉淀物
Fe(OH)₃
Fe(OH)₂
C(OH)₂
C(OH)₃
Cd(OH)₂
Ksp
2.6×10⁻39
4.9×10⁻¹⁷
5.9×10⁻¹⁵
1.6× 10 ⁴⁴
7.2× 10⁻¹⁵
相关试卷
这是一份河北省邢台市质检联盟2023-2024学年高一上学期12月第四次月考化学试题含答案,共10页。试卷主要包含了本试卷主要考试内容,可能用到的相对原子质量,下列说法正确的是,下列离子方程式书写错误的是等内容,欢迎下载使用。
这是一份河北省邢台市名校质检联盟2023-2024学年高二上学期12月月考化学试题,共9页。试卷主要包含了本试卷主要考试内容,可能用到的相对原子质量等内容,欢迎下载使用。
这是一份河北省邢台市质检联盟2023-2024学年高一上学期11月月考化学试题,共7页。试卷主要包含了本试卷主要考试内容,可能用到的相对原子质量,下列离子方程式书写正确的是,下列除杂方法正确的是,制备少量等内容,欢迎下载使用。









