
湖南省长沙市2022-2023学年高二上学期11月期中考试化学试卷(含解析)
展开学校:___________姓名:___________班级:________
一、单选题
1.2022年11月《联合国气候变化框架公约》第二十七次缔约方大会(COP27)在埃及举行,会议主题为“实施(Tgether Fr Implementatin)”。下列说法正确的是 ( )
A.燃煤中添加生石灰能有效吸收CO2,实现碳中和
B.采取“静电除尘”可提高空气质量
C.空气中O3的含量越高越有利于人体健康
D.SO2易产生“光化学烟雾”,可用碱性物质吸收
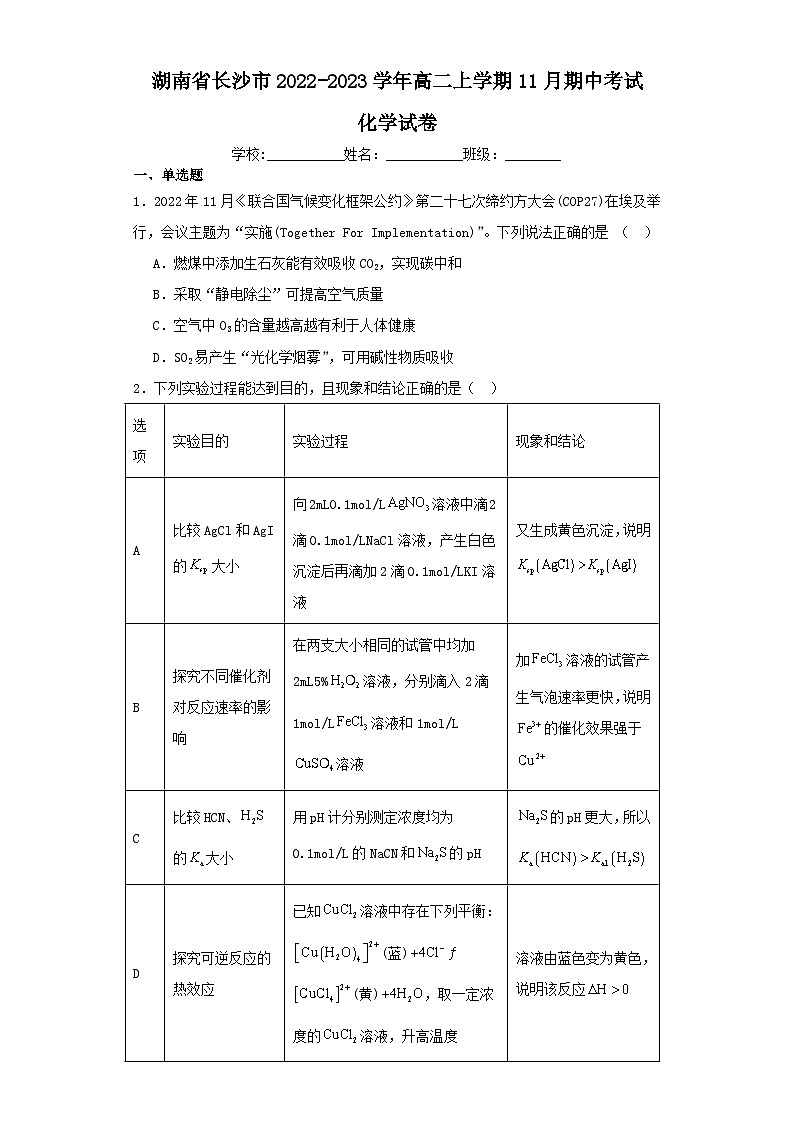
2.下列实验过程能达到目的,且现象和结论正确的是( )
A.AB.BC.CD.D
3.下列化学用语表述正确的是( )
A.N2H4的结构式:
B.过氧化氢的电子式:
C.HCO的电离方程式:HCO+H2OH3O++CO
D.邻羟基苯甲醛分子内氢键示意图:
4.下列各组离子一定能大量共存的是( )
A.无色溶液:Na+、Fe3+、Cl-、B.Ag+、、S2-、
C.遇酚酞变红的溶液:、K+、、D.K+、Al3+、、
5.下列溶液一定显酸性的是( )
A.含H+的溶液B.c(OH一)
6.下列类比或推理合理的是( )
A.AB.BC.CD.D
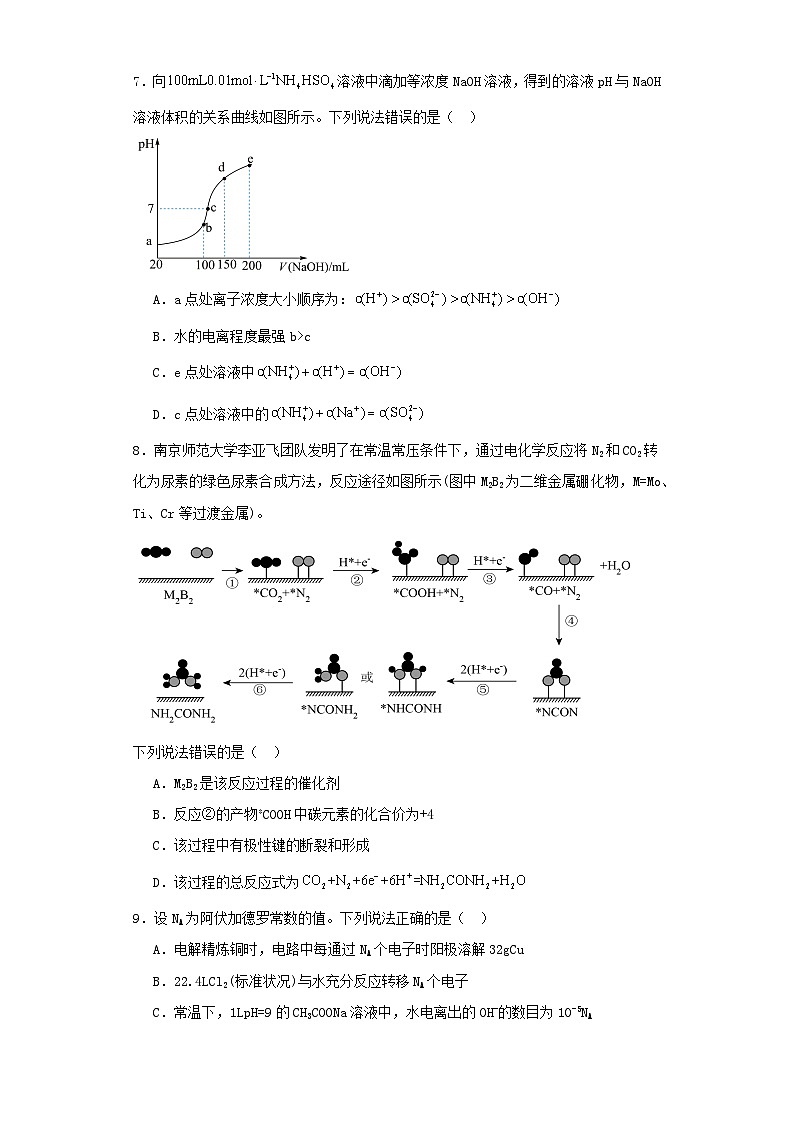
7.向溶液中滴加等浓度NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。下列说法错误的是( )
A.a点处离子浓度大小顺序为:
B.水的电离程度最强b>c
C.e点处溶液中
D.c点处溶液中的
8.南京师范大学李亚飞团队发明了在常温常压条件下,通过电化学反应将N2和CO2转化为尿素的绿色尿素合成方法,反应途径如图所示(图中M2B2为二维金属硼化物,M=M、Ti、Cr等过渡金属)。
下列说法错误的是( )
A.M2B2是该反应过程的催化剂
B.反应②的产物*COOH中碳元素的化合价为+4
C.该过程中有极性键的断裂和形成
D.该过程的总反应式为
9.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.电解精炼铜时,电路中每通过NA个电子时阳极溶解32gCu
B.22.4LCl2(标准状况)与水充分反应转移NA个电子
C.常温下,1LpH=9的CH3COONa溶液中,水电离出的OH-的数目为10-5NA
D.常温常压下,13.6g金刚烷()中所含C-C共价键的数目为1.36NA
10.把2.5mlA和2.5mlB混合盛入容积为2L的密闭容器里,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经5s反应达平衡状态,在此5s内C的平均反应速率为0.2ml·L-1·s-1,同时生成1mlD,下列叙述中错误的是( )
A.x=4
B.达到平衡状态时容器内气体的压强与起始时压强之比为6∶5
C.5s内B的反应速率v(B)=0.05ml·L-1·s-1
D.达到平衡状态时A的转化率为40%
11.是一种光催化半导体材料,其结构如图。有光照时,光催化材料会产生电子()和空穴(),能实现和转化,如图。下列说法错误的是( )
A.该半导体可以实现太阳能→电能→化学能
B.该半导体材料结构中,所有原子不可能共平面
C.有转化的过程可表示为
D.理论上每消耗,能产生标准状况下11.2L
二、多选题
12.下列实验装置能达到实验目的的是
A.AB.BC.CD.D
13.下列不能证明是弱电解质的是( )
A.用溶液做导电实验,灯泡很暗
B.等pH等体积的盐酸、溶液和足量锌反应,放出的氢气较少
C.0.1 ml/L的溶液的
D.的溶液稀释100倍,
14.在一恒容密闭容器里进行下列反应A(g)+B(g)2C+D(g),此反应符合下列两个图象,则下列说法正确的是(图中纵坐标表示物质的百分含量)( )
A.加入催化剂,反应正向移动
B.C是固态或液态
C.正反应为放热反应
D.300℃下该反应到达平衡状态后,迅速充入He,平衡正向移动
三、工业流程题
15.电子工业常用FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某电子厂用过的腐蚀液中含有Fe3+、Cu2+,可以通过下列流程回收铜,并重新获得FeCl3溶液。
(1)检验溶液中含有Fe3+常用的试剂是 ,证明Fe3+存在的现象是 ;
(2)操作①是 ,C的成分是 ;
(3)废液中的Fe3+与A反应的离子方程式是 ,向B的溶液中滴加NaOH溶液时观察到的现象是 ;
(4)已知E是Cl2,目的是将Fe2+全部转变为Fe3+,在工业生产中可以用 替代(从以下试剂中选择),反应的离子方程式是 (任写一个)。
A.Na2O2B.ClO2 C.H2O2D.KMnO4
四、实验题
16.甘氨酸亚铁晶体是一种新型的固体整合补铁剂。其实验室合成路线为:铁片甘氨酸亚铁晶体粗品甘氨酸亚铁晶体纯品。
已知:①相关物质的信息如下表所示
②含有多个配位原子的配体与同一中心离子通过螯合配位成环而形成的配合物称为螯合物。
(一)固体的制备
(1)实验开始时应先开和 ,关 (填“”或“”);一段时间后,改变开关状态,生成。
(2)三颈瓶中生成沉淀的离子方程式为 。
(二)甘氨酸亚铁的制备
(3)用如图装置制备甘氨酸亚铁。反应开始时,先通过滴液口滴入适量的NaOH溶液调节pH为5左右,pH过高或过低都会使产率下降,原因是 。
(4)当固体完全溶解后,再通过滴液口加入乙醇,其作用是 。
(5)反应结束后,过滤出产品粗品,依次用 、 (填序号)洗涤,再经过一系列操作得纯品。
a.热水 b.冰水 c.乙醇
(三)甘氨酸亚铁晶体结构的分析
步骤1:准确称取甘氨酸亚铁晶体纯品0.4800 g于锥形瓶中,加溶液15 mL将样品溶解完全后,加入指示剂,立即用标准液滴定至终点,用去标准液20.20 mL(反应为)。
步骤2:不加产品,重复步骤1操作,滴定至终点,用去标准液0.20 mL。
回答下列问题:
(6)甘氨酸亚铁晶体中Fe的质量分数为 %(保留小数点后一位)。
(7)进一步分析表明:甘氨酸亚铁晶体中,阴阳离子只有和;的配位数为6,且存在五元整合环;该配合物呈中心对称,甘氨酸亚铁晶体的结构简式为 。
五、填空题
17.依据所学知识回答问题:
(1)0.1 ml·L-1的KAl(SO4)2溶液中各离子的浓度由大到小的顺序为 。
(2)液态SO2是一种似水溶剂,可以微弱电离:SO2+SO2SO2++SO在液态SO2中,视SOCl2为酸,Cs2SO3为碱,试写出二者在液态SO2体系中发生反应的化学方程式: 。
(3)盐类水解的实质就是盐产生的阴阳离子与水电离出的H+或OH-结合的过程,下列物质与水反应和盐类水解类似,写出相应的化学方程式:
Mg3N2与水反应: ;
PCl5与热水反应: 。
(4)常温下,BaCO3(s)在水中的溶解平衡曲线如图所示,则该温度下,Ksp(BaCO3)= ;将0.2 ml·L-1的Ba(OH)2溶液与0.2 ml·L-1的NaHCO3溶液等体积混合后,混合溶液的pH= ,c(CO)= 。(忽略混合时溶液体积的变化)
六、原理综合题
18.硫酸亚铁在工农业生产中有许多用途,如可用作农药,防治小麦黑穗病,制造磁性氧化铁、铁催化剂等。回答下列问题:
(1)在气氛中,的脱水热分解过程如图所示:
根据上述实验结果,可知 。
(2)已知下列热化学方程式:
则的 。
(3)将置入抽空的刚性容器中,升高温度发生分解反应:。平衡时的关系如图所示。660K时,该反应的平衡总压 kPa、平衡常数 。随反应温度升高而 (填“增大”“减小”或“不变”)。
(4)提高温度,上述容器中进一步发生反应:,平衡时 (用、表示)。在929K时,、,则 kPa, kPa(列出计算式)。
选项
实验目的
实验过程
现象和结论
A
比较AgCl和AgI的大小
向2mL0.1ml/L溶液中滴2滴0.1ml/LNaCl溶液,产生白色沉淀后再滴加2滴0.1ml/LKI溶液
又生成黄色沉淀,说明
B
探究不同催化剂对反应速率的影响
在两支大小相同的试管中均加2mL5%溶液,分别滴入2滴1ml/L溶液和1ml/L溶液
加溶液的试管产生气泡速率更快,说明的催化效果强于
C
比较HCN、的大小
用pH计分别测定浓度均为0.1ml/L的NaCN和的pH
的pH更大,所以
D
探究可逆反应的热效应
已知溶液中存在下列平衡:(蓝)(黄),取一定浓度的溶液,升高温度
溶液由蓝色变为黄色,说明该反应
已知
方法
结论
A
沸点:
类比
沸点:Li
酸性:三氟乙酸>三氯乙酸
类比
酸性:氢氟酸>氢氯酸
C
金属性:Na>Mg>Al
推理
碱性:
D
:
推理
溶解度:
A.干燥硫化氢气体
B.验证与反应有生成
C.处理含的尾气
D.验证硝酸铵固体溶于水吸热
物质
化学式
摩尔质量
性质
甘氨酸
75 g/ml
两性物质,易溶于水,微溶于乙醇
甘氨酸亚铁晶体
易溶于水,溶解度随温度升高而增大;难溶于乙醇,在潮湿的空气中易被氧化
参考答案
1.B
【详解】A.燃煤中添加生石灰可以减少硫的氧化物的排放,可减少污染,但不能有效吸收CO2,实现碳中和,A错误;
B.采取“静电除尘”可除去空气中的粉尘,提高了空气质量,B正确;
C.由空气的成分可知,臭氧不是空气的主要成分,且O3本身具有强氧化性,有毒, 空气中臭氧含量越高,越不有利于人体健康,C错误;
D.SO2不会产生“光化学烟雾”, 其易形成酸雨,可用碱性物质吸收,而氮的氧化物易产生“光化学烟雾”,可用碱性物质吸收,D错误;
故答案为:B。
2.D
【详解】A.向2mL0.1ml/L溶液中滴2滴0.1ml/LNaCl溶液,产生白色沉淀,过量,然后再滴加2滴0.1ml/LKI溶液,过量的与反应,生成黄色,不能证明转化为,不能证明,A错误;
B.探究不同催化剂对反应速率的影响,得保证其他条件不变,温度相同,浓度相同,没有确定温度,无法探究催化剂对反应速率的影响,B错误;
C.发生两步水解,,,,要比较HCN、的大小,应该用pH计分别测定浓度均为0.1ml/L的NaCN和的,越大,水解程度越大,对应弱电解质酸性越弱,越小,C错误;
D.已知平衡:(蓝)(黄),取一定浓度的溶液,升高温度,溶液由蓝色变为黄色,平衡正向移动,则正反应的吸热反应,,D正确;
故选D。
3.C
【详解】A.的结构式为,A项错误;
B.过氧化氢中不存在离子键,电子式为,B项错误;
C.HCO的电离出的H+与H2O结合,总的电离方程式为HCO+H2OH3O++CO,故C正确;
D.邻羟基苯甲醛分子内氢键示意图,D项错误;
故选C。
4.D
【详解】A.含有Fe3+的溶液呈黄色,无色溶液中不存在铁离子,A错误;
B.银离子与碳酸根离子、硫离子反应生成碳酸银和硫化银沉淀,不能大量共存,B错误;
C.遇酚酞变红的溶液呈碱性,碱性溶液中铵根离子不能大量存在,C错误;
D.选项中的四种离子相互之间不反应,能大量共存,D正确;
故答案选D。
5.B
【详解】A.酸、碱、盐溶液中同时存在氢离子和氢氧根离子,则含有H+的溶液不一定显酸性,故A错误;
B.溶液的酸碱性与氢离子和氢氧根离子浓度的相对大小有关,如果溶液中c(OH-)
D.酸、碱抑制水电离,因此水电离出的氢离子物质的量浓度为10-10ml/L的溶液,可能显酸性,可能显碱性,故D错误;
故选B。
6.C
【详解】A.卤素单质形成分子晶体,随原子序数增大,相对分子质量增大,分子间作用力增大,熔沸点升高,碱金属元素的单质形成金属晶体,随原子序数的增大,单质内金属键能不断减小,熔沸点不断降低,A不正确;
B.F的吸电子能力强于Cl,使得三氟乙酸比三氯乙酸更易发生电离,而F的非金属性比Cl强,所以酸性:三氟乙酸>三氯乙酸,H-F键能比H-Cl键能大,更难发生电离,所以酸性:氢氟酸<氢氯酸,B不正确;
C.元素的金属性越强,失电子能力越强,对应碱的碱性越强,金属性:Na>Mg>Al,则碱性,C正确;
D.,,二者组成不相似,则由,不能推出溶解度,D不正确;
故选C。
7.D
【详解】A.a点处溶液中存在, , ,所以,A正确;
B.室温时,向NH4HSO4溶液中滴加NaOH溶液,b点加入氢氧化钠溶液的体积为100mL,则NH4HSO4和NaOH恰好反应生成硫酸铵,硫酸铵是强碱弱酸盐,铵根离子水解促进水电离,c点氢氧化钠过量,抑制水电离,所以水的电离程度强b>c,B正确;
C.e点处两者反应生成硫酸钠和一水合氨、水,能够产生氢氧根离子的过程为:、,所以,C正确;
D.c点处溶液中存在的离子有:,根据电荷守恒:,c点处溶液显中性,所以,D错误;
故选D。
8.B
【详解】A.由物质转化图可知,M2B2是该反应过程的催化剂,A正确;
B.由反应②得1个电子及CO2中碳元素的化合价为+4可知,*COOH中碳元素的化合价为+3,B错误;
C.反应②中有O-H极性键的形成,反应③中有C-O极性键的断裂,C正确;
D.由上述物质转化图可知,该过程的总反应式为,D正确;
答案选B。
9.C
【详解】A.电解精炼铜时,阳极除铜外,锌、镍等杂质金属单质也会放电生成金属阳离子,故电路中每通过NA个电子时阳极溶解Cu质量小于32g,A错误;
B.氯气和水反应为可逆反应,故22.4LCl2(标准状况1ml)与水充分反应转移小于NA个电子,B错误;
C.CH3COONa水解导致溶液显碱性,促进水的电离;常温下,1LpH=9的CH3COONa溶液中,pOH=5,水电离出的OH-为1L×10-5ml/L=10-5ml,数目为10-5NA,C正确;
D.1分子金刚烷含有12个碳碳键,常温常压下,13.6g金刚烷()为0.1ml,所含C-C共价键的数目为1.2NA,D错误;
故选C。
10.D
【详解】A.5s内C的平均反应速率为0.2ml·L-1·s-1,则5s内生成C的物质的量为2ml,同时生成1mlD,则D的反应速率为C的0.5倍,故x=4,A正确;
B.5s时达到平衡,平衡时生成1mlD和2mlC,则反应掉1.5mlA和0.5mlB,反应前气体总物质的量为5ml,平衡时总物质的量为6ml,则达到平衡时容器内气体的压强与起始时压强之比为6:5,B正确;
C.经前面计算可知,x=4,根据化学反应速率之比等于化学计量数之比,且5s内C的平均反应速率为0.2ml·L-1·s-1,则v(B)= 0.05ml·L-1·s-1,C正确;
D.达到平衡时,反应掉A的物质的量为1.5ml,A的转化率为1.5ml÷2.5ml=60%,D错误;
故答案选D。
11.D
【详解】A.光照时(太阳能),光催化半导体材料产生电子和空穴(电能),再实现和转化(化学能),A项正确;
B.有部分N原子和C原子是杂化,不可能所有原子共平面,B项正确;
C.有转化的过程为,表示的是4ml电子离开后留下的4ml空穴(一个空穴带一个单位正电荷),C项正确;
D.0.5ml变成,需要得到4ml电子,即产生4ml空穴,产生1ml,标准状况下体积为22.4L,D项错误;
故选:D。
12.BD
【详解】A.硫化氢与浓硫酸发生氧化还原反应,因此不能用浓硫酸干燥硫化氢,故A错误;
B.通入二氧化碳后,下方点燃的蚊香燃烧更旺,能说明Na2O2与CO2反应有氧气生成,故B正确;
C.二氧化氮与水反应生成硝酸和NO,NO气体不溶于水,会从烧杯中逸出,污染环境,故C错误;
D.可通过U形管中红墨水左高右低的现象,证明硝酸铵固体溶于水吸热,故D正确;
答案为BD。
13.AB
【详解】弱电解质的证明,是基于与强电解质对比进行的。弱电解质与强电解质最大的区别就是弱电解质存在电离平衡,而强电解质不存在电离平衡。因此只要证明有电离平衡存在,就能证明是弱电解质,据此分析解题:
A.用溶液做导电实验,灯泡很暗,不能证明是弱电解质,只能说明溶液中离子浓度较小,A错误;
B.等pH等体积的盐酸、溶液和足量锌反应,放出的氢气较多,说明醋酸还未完全电离,可证明是弱电解质,B错误;
C.溶液的,说明醋酸没有完全电离,可以证明是弱电解质,C正确;
D.的溶液稀释至100倍,,说明存在电离平衡,证明是弱电解质,D正确;
故答案为:AB。
14.BC
【详解】A.催化剂只改变化学反应速率,不能使平衡发生移动,A错误;
B.从左图可以看出,压强增大,B的百分含量减少,即平衡正向移动,则C不能是气体,B正确;
C.从右图可以看出,随着温度的升高,D的百分含量降低,即平衡逆移动,则正反应为放热反应,C正确;
D. 由于恒容,充入稀有气体不影响各气体的浓度,故平衡不发生移动,D错误;
故选BC。
15. KSCN溶液 溶液变红色 过滤 Cu、Fe 白色沉淀变灰绿色,最后变成红褐色 BC (或)
【分析】(1)三价铁遇KSCN溶液变红色;
(2)将废液中的液体与固体分开用过滤;废液中含有Fe3+、Cu2+,由工艺流程可知,B最终得到的是三价铁,固体C中含有金属铜,目的是制取氯化铁,废液应该与铁过量的Fe反应,故A是Fe;固体C中含有金属Cu、未反应的Fe;
(3)废液中的Fe3+与铁反应生成亚铁离子;氯化亚铁滴加NaOH溶液时观察到的现象是产生白色沉淀,迅速变成灰绿色最终变为红褐色;
(4)已知E是Cl2,目的是将Fe2+全部转变为Fe3+,使用替代的氧化剂,原则不能引入难除的杂质。
【详解】(1)三价铁遇KSCN溶液变红色,故常用其检验三价铁的存在,故答案为:KSCN溶液;溶液变红色;
(2)将废液中的液体与固体分开用过滤;废液中含有Fe3+、Cu2+,由工艺流程可知,B最终得到的是三价铁,固体C中含有金属铜,目的是制取氯化铁,废液应该与铁过量的Fe反应,故A是Fe;固体C中含有金属Cu、未反应的Fe,故答案为:过滤;Cu、Fe;
(3)废液中的Fe3+与铁反应的离子方程式:;由上面分析得B中主要是氯化亚铁,故滴加NaOH溶液时观察到的现象是产生白色沉淀,迅速变成灰绿色最终变为红褐色,故答案为:;白色沉淀变灰绿色,最后变成红褐色;
(4)已知E是Cl2,目的是将Fe2+全部转变为Fe3+,使用替代的氧化剂,原则不能引入难除的杂质,可用ClO2和H2O2代替,相关反应的离子方程式是(或),故答案为:BC;(或)。
【点睛】本题难点(4),E是Cl2,目的是将Fe2+全部转变为Fe3+,使用替代的氧化剂,不能引入难除的杂质,可用ClO2和H2O2代替。如果用Na2O2和KMnO4,分别会引入钠离子和锰离子。
16.(1) K3 K2
(2)Fe2++ +NH3•H2O=FeCO3↓++H2O
(3)pH过高,FeCO3会转化为Fe(OH)2,pH过低,H2NCH2COOH与H+反应
(4)降低甘氨酸亚铁溶解度,便于从溶液中析出
(5) b c
(6)23.3
(7)
【分析】由题给流程可知,铁与稀硫酸反应生成制得硫酸亚铁溶液,向硫酸亚铁溶液中加入碳酸氢铵和氨水的混合溶液将硫酸亚铁转化为碳酸亚铁沉淀,过滤得到碳酸亚铁;向碳酸亚铁中加入甘氨酸,将碳酸亚铁转化为甘氨酸亚铁,向甘氨酸亚铁溶液中加入乙醇、过滤得到甘氨酸亚铁粗品;粗品经冰水洗涤、乙醇洗涤、干燥得到甘氨酸亚铁纯品,据此分析解题。
【详解】(1)由实验装置图可知,装置甲中稀硫酸和铁反应生成硫酸亚铁和氢气,反应生成的氢气排尽装置中的空气后,关闭K3、打开K2,利用反应生成的氢气将甲中硫酸亚铁溶液加入到乙中,使硫酸亚铁与碳酸氢较和氨水的混合溶液反应制得碳酸亚铁,则制备碳酸亚铁的操作为打开K1、K3,关闭K2,故答案为:K3;K2;
(2)由分析可知,装置乙中发生的反应为硫酸亚铁与碳酸氢铵和氨水的混合溶液反应生成碳酸亚铁、硫酸铵、硫酸钠和水,反应的离子方程式为:Fe2++ +NH3•H2O=FeCO3↓++H2O;
(3)由反应物的性质可知,滴入氢氧化钠溶液调节溶液pH时,若溶液pH过高,碳酸亚铁会转化为溶解度更小的氢氧化亚铁,不利于甘氨酸亚铁的生成,若溶液pH过低,甘氨酸中的氨基会与氢离子反应,导致产品中混有杂质,所以滴入氢氧化钠溶液调节溶液pH时,溶液pH不能过高,也不能过低,故答案为:pH过高,FeCO3会转化为Fe(OH)2,pH过低,H2NCH2COOH与H+反应;
(4)由题给信息可知,甘氨酸亚铁难溶于乙醇,所以当碳酸亚铁固体完全溶解后,再通过滴液口加入乙醇可以降低甘氨酸亚铁溶解度,便于甘氨酸亚铁从溶液中析出,故答案为:降低甘氨酸亚铁溶解度,便于从溶液中析出;
(5)由题给信息可知,甘氨酸亚铁易溶于水,溶解度随温度升高而增大,难溶于乙醇,所以为防止甘氨酸亚铁溶解造成产率降低,粗品应先用冰水洗涤,后用乙醇洗涤,干燥得到甘氨酸亚铁纯品,故答案为:b;c;
(6)由题意可知,滴定消耗(NH4)2Ce(SO4)3溶液的体积为(20.20-0.20)mL=20.00mL,则由方程式可知,甘氨酸亚铁晶体中铁元素的质量分数为×100%≈23.3%,故答案为:23.3;
(7)由甘氨酸亚铁晶体中,阴阳离子只有H2NCH2COO-和Fe2+,Fe2+的配位数为6,且存在五元合环,该配合物整体量中心对称可知,甘氨酸亚铁晶体的结构简式为: ,故答案为: 。
17. c(SO)>c(K+)>c(Al3+)>c(H+)>c(OH-) SOCl2+Cs2SO3=2CsCl+2SO2 Mg3N2+6H2O=3Mg(OH)2+2NH3↑或Mg3N2+8H2O=3Mg(OH)2+2NH3·H2O PCl5+4H2OH3PO4+5HCl 4.9×10-9 13 7×10-5
【详解】(1) 0.1 ml·L-1的KAl(SO4)2溶液中铝离子水解溶液显酸性,溶液中的离子浓度大小为c(SO)>c(K+)>c(Al3+)>c(H+)>c(OH-),故答案为:c(SO)>c(K+)>c(Al3+)>c(H+)>c(OH-);
(2) 液态SO2是一种似水溶剂,可以微弱电离:SO2+SO2=SO2-+SO, 在液态SO2中,看作 SOC12为酸,Cs2SO3为碱,二者在液态SO2体系中发生反应即类似于酸碱中和反应,故该反应的化学方程式为:SOC12+Cs2SO3 =2CsC1+2SO2,故答案为:SOCl2+Cs2SO3=2CsCl+2SO2;
(3) 根据信息,盐类水解的实质就是盐产生的阴、阳离子与水电离出的H+或OH-结合的过程,可知下列物质与水反应和盐类水解类似,故Mg3N2与水反应的反应方程式为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑或Mg3N2+8H2O=3Mg(OH)2+2NH3·H2O
PC15与热水反应的反应方程式为:PCl5+4H2OH3PO4+5HCl,故答案为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑或Mg3N2+8H2O=3Mg(OH)2+2NH3·H2O,PCl5+4H2OH3PO4+5HCl;
(4)常温下,BaCO3(s)在水中的溶解平衡曲线如图所示,则该温度下,Ksp(BaCO3)=c(Ba2+) c(CO),由图中数据可知,Ksp(BaCO3)=c(Ba2+) c(CO)=7×10-5××10-5=4.9×10-9,将0.2 ml·L-1的Ba(OH)2溶液与0.2 ml·L-1的NaHCO3溶液等体积混合后,体积扩大一倍,溶液c(OH-)=0.1 ml·L-1,所以pH=13,此时即达到BaCO3的溶解平衡,故c(CO)= c(Ba2+)=7×10-5 ml·L-1,故答案为:4.9×10-9,13,7×10-5。
18.(1)4
(2)
(3) 3 2.25 增大
(4) 46.26
【详解】(1)由图中信息可知,当失重比为19.4%时,转化为,则,解得;故答案为:4。
(2)① ;② ;③ ;根据盖斯定律可知,①+③−②×2可得,则;故答案为:。
(3)将置入抽空的刚性容器中,升高温度发生分解反应:。由平衡时的关系图可知,660K时,,则,因此,该反应的平衡总压、平衡常数。由图中信息可知,随着温度升高而增大,因此,随反应温度升高而增大;故答案为:3;2.25;增大。
(4)提高温度,上述容器中进一步发生反应:,在同温同容下,不同气体的物质的量之比等于其分压之比,,,,解得平衡时。在929K时,、,则、,联立求出,则,;故答案为:;46.26;。
湖南省长沙市宁乡2022-2023学年高二上学期期末联考化学试题(含解析): 这是一份湖南省长沙市宁乡2022-2023学年高二上学期期末联考化学试题(含解析),共20页。试卷主要包含了单选题,实验题,工业流程题,原理综合题,有机推断题等内容,欢迎下载使用。
2022-2023学年湖南省长沙市宁乡市高二(下)期末化学试卷(含解析): 这是一份2022-2023学年湖南省长沙市宁乡市高二(下)期末化学试卷(含解析),共23页。试卷主要包含了单选题,流程题,实验题,简答题等内容,欢迎下载使用。
2022-2023学年湖南省长沙市芙蓉高级中学高二上学期期中考试化学试题含解析: 这是一份2022-2023学年湖南省长沙市芙蓉高级中学高二上学期期中考试化学试题含解析,共30页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。












