

海南省海口市2022-2023学年高二上学期11月期中考试化学试卷(含解析)
展开
这是一份海南省海口市2022-2023学年高二上学期11月期中考试化学试卷(含解析),共25页。试卷主要包含了单选题,多选题,填空题,原理综合题等内容,欢迎下载使用。
一、单选题
1.1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为 ( )
A.C + H2O=CO + H2 ΔH=+131.3KJ·ml-1
B.C(s)+ H2O(g)=CO(g) + H2(g) ΔH=+10.94KJ·ml-1
C.C(s)+ H2O(l)=CO(g) + H2(g) ΔH= +131.3KJ·ml-1
D.C(s)+ H2O(g)=CO(g) + H2(g) ΔH=+131.3KJ·ml-1
2.下列关于化学反应与能量的说法中,不正确的是( )
A.Al与Fe2O3的铝热反应属于放热反应
B.NaOH+HCl=NaCl+H2O不能实现化学能转化为电能的理由是反应太快,形成电流时间短暂
C.Ba (OH) 2·8H2O与NH4Cl的反应属于吸热反应
D.反应物的总能量低于生成物的总能量,反应时从环境吸收能量
3.如图所示,某小组设计了探究影响反应速率因素的对照实验,探究的因素是( )
A.浓度B.压强C.温度D.催化剂
4.对于反应4NH3+5O2⇌4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)(单位皆为ml∙L-1∙min-1)表示,则下列式子中,正确的是
A.4v(O2)=5v(NO)B.5v(O2)=6v(H2O)C.2v(NH3)=3v(H2O)D.v(NH3)=5v(O2)
5.下列说法正确的是
A.标有“OTC”的药品要持医生的处方才能购买
B.向食品中加入大量的苯甲酸钠可以防止食物变质
C.因硝酸铵易分解,所以使用硝酸铵施肥时应大量使用
D.向婴儿奶粉中加入碳酸钙可以补钙
6.下列物质的水溶液由于水解而呈碱性的是
A.NaOHB.NH4ClC.Na2CO3D.NH3
7.对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法不正确的是( )
A.Zn是负极
B.电流由Cu极经导线流向Zn极
C.溶液中的阴离子定向移向Zn极
D.正极上发生氧化反应
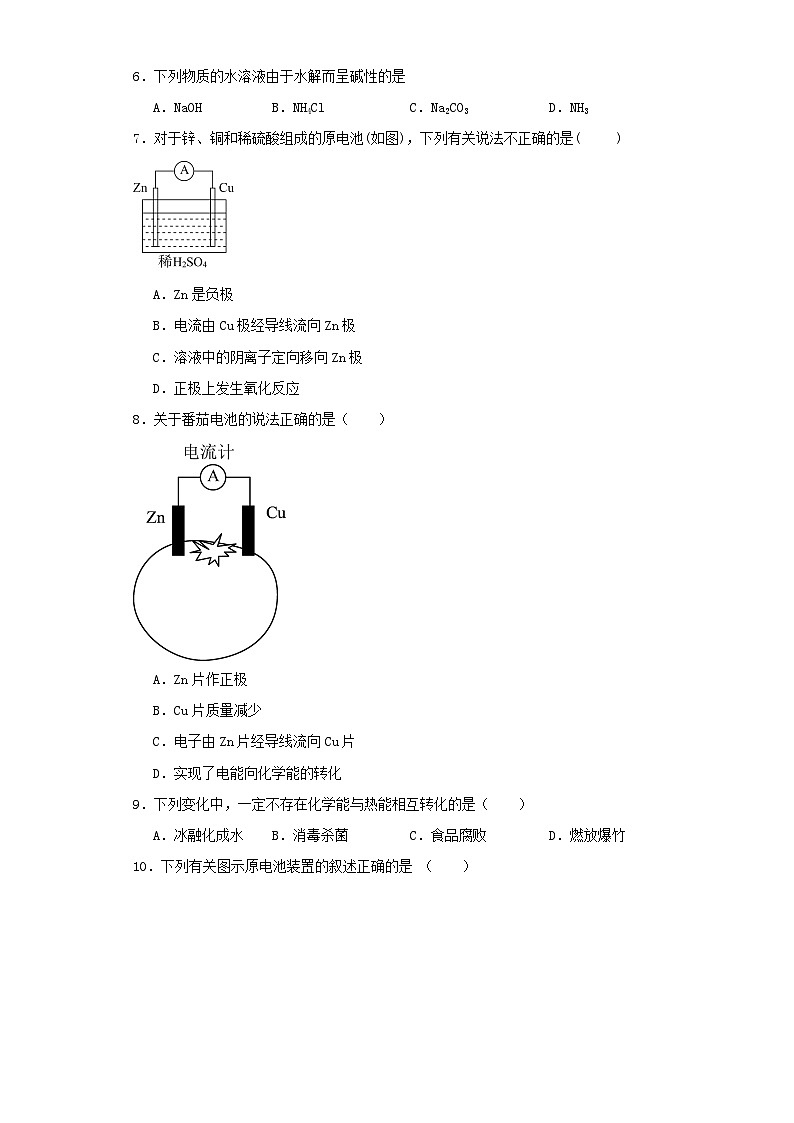
8.关于番茄电池的说法正确的是( )
A.Zn片作正极
B.Cu片质量减少
C.电子由Zn片经导线流向Cu片
D.实现了电能向化学能的转化
9.下列变化中,一定不存在化学能与热能相互转化的是( )
A.冰融化成水B.消毒杀菌C.食品腐败D.燃放爆竹
10.下列有关图示原电池装置的叙述正确的是 ( )
A.图1盐桥中的阳离子移向ZnSO4溶液
B.图2中Zn发生还原反应,MnO2发生氧化反应
C.图3中电池放电时,负极质量减少,正极质量增加
D.图4电解质溶液采用稀硫酸时,正极反应为O2+4H++4e-=2H2O
二、多选题
11.用石灰石和稀盐酸制取CO2的反应中,能影响该反应速率的条件是( )
A.盐酸的体积B.盐酸的浓度
C.石灰石颗粒的大小D.压强
12.在N2(g)+3H2(g) 2NH3(g)的平衡体系中,其他条件不变,增大c(N2),则正确的是( )
A.氮气的转化率增大
B.氢气的转化率不变
C.氨气在平衡混合气体中的含量一定增大
D.氨气在平衡混合气体中的物质的量增多
13.常温下,某溶液中由水电离出来的c(H+)=1.0×10-13ml•L-1,该溶液可能是( )
A.稀硫酸B.氯化钠水溶液
C.硝酸钠水溶液D.氢氧化钠水溶液
14.下列说法正确的是( )
A.已知石墨转化为金刚石是吸热反应,所以石墨比金刚石稳定
B.白居易《赋得古原草送别》:“野火烧不尽,春风吹又生。”主要涉及吸热反应
C.灼热的炭与的反应既是氧化还原反应又是放热反应
D.苏轼:“投泥泼水愈光明,烁玉流金见精悍”主要涉及吸热反应
三、填空题
15.写出下列盐溶液水解反应的离子方程式:
(1)NaF: 。
(2)NH4NO3: 。
(3)CuSO4: 。
(4)NaHCO3: 。
(5)CH3COONa: 。
四、原理综合题
16.根据要求回答问题(1)写出下列反应的热化学方程式:
①1mlC2H2(g)在O2中完全燃烧生成CO2和液态水,放出1299.6KJ的热量:
②23g C2H5OH(l)在O2中完全燃烧生成CO2和液态水,放出683.4KJ的热量:
(2)焦炭与水蒸气反应、甲烷与水蒸气反应均是工业上制取氢气的重要方法。这两个反应的热化学方程式分别是:
①C(s)+H2O(g)=CO(g)+H2(g)∆H1=+131.5KJ/ml
②CH4(g)+H2O(g)=CO(g)+3H2(g)∆H2=+205.9KJ/ml
则CH4(g)=C(s)+ 2H2(g)的∆H是: KJ/ml
17.填空。
(1)下列反应中,属于吸热反应的是___________(填字母)。
A.Na2O与水反应B.甲烷的燃烧反应C.CaCO3受热分解D.锌与盐酸反应
(2)化学反应过程中,不仅有物质的变化,还伴随有能量的变化。根据下图写出反应的热化学方程式 。
(3)化学反应速率和化学平衡是化学反应原理的重要组成成分。将4.0mlPCl3和2.0mlCl2充入10L恒容密闭容器中,在一定条件下发生反应PCl3(g)+Cl2(g)⇌PCl5(g),经2min达到平衡时,PCl5为0.4ml。
①在0~2min内,用Cl2表示的反应速率为v(Cl2)= ml/(L·min)
②达到平衡时,PCl3的转化率为 。
18.在室温下,下列五种溶液:
①0.1 ml·L-1NH4Cl ②0.1 ml·L-1CH3COONH4 ③0.1 ml·L-1NH4HSO4
④0.1 ml·L-1NH3·H2O和 0.1 ml·L-1NH4Cl混合液 ⑤pH=a的CH3COOH
请根据要求填写下列空白:
(1)溶液①呈酸性的原因是 (用离子方程式表示)。
(2)比较溶液②、③中c(NH)的大小关系是② ③(填“>”“<”或“=”)。
(3)在溶液④中,NH3·H2O和 物质的量浓度之和为0.2 ml·L-1(填微粒符号)。
(4)室温,溶液②的pH=7,CH3COO-与NH浓度的大小关系是c(CH3COO-) c(NH)(填“>”“<”或“=”)。
(5)溶液⑤稀释100倍后所得溶液pH a+2(填“>”或“<”或“=”)。
19.原电池是将化学能转化为电能的装置。
I.a为铜片,b为铁片,烧杯中是稀硫酸溶液,当开关K断开时产生的现象为 ;当开关K闭合时,产生的现象为 。
A.a不断溶解 B.b不断溶解 C.a上产生气泡 D.b上产生气泡 E.溶液逐渐变蓝
(2)闭合开关K,反应一段时间后断开开关K,经过一段时间后,下列叙述不正确的是 。
A.溶液中浓度减小 B.正极附近浓度逐渐增大
C.溶液中含有 D.溶液中浓度基本不变
Ⅱ.某同学为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折算为标准状况下的体积),实验记录如下(累计值):
(3)反应速率最大的时间段是 (填“0~1min”“1~2min”“2~3min”“3~4min”或“4~5min”);反应速率最小的时间段是 (填“0~1min”“1~2min”“2~3min”“ 3~4min”或“4~5min”),
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,该同学在盐酸中分别加入等体积的下列液体,你认为可行的是 (填序号)。
A.蒸馏水 B.NaCl溶液 C.溶液 D.溶液
时间/min
1
2
3
4
5
氢气体积/mL
50
120
232
290
310
参考答案
1.D
【详解】1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,可知1mlC完全反应吸热为12×10.94KJ=131.3KJ,则此反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g)△H=+131kJ/ml或C(s)+H2O(g)=CO(g)+H2(g)-131.3KJ,
故选:D。
2.B
【详解】A.常见的放热反应有可燃物的燃烧、酸碱中和反应、化合反应、铝热反应、缓慢氧化反应等,A项正确;
B.氧化还原反应能用于设计电池,因为该类反应中有还原剂到氧化剂的电子转移问题,而HCl与NaOH不属于氧化还原反应没有电子的转移问题,B项错误;
C.常见的吸热反应有大多数分解反应、盐的水解和弱电解质的电离、Ba(OH)2·8H2O与NH4Cl反应、碳和水蒸气、C和CO2的反应等,C项正确;
D.反应物的总能量低于生成物的总能量时为吸热反应,需要从外界吸收能量,D项正确;
故答案选B。
3.C
【详解】两组实验除温度外其它都相同,故此实验探究的是温度对反应的影响,综上所述C正确;
故答案为:C。
4.A
【分析】反应4NH3+5O2⇌4NO+6H2O中,化学反应速率与化学计量数成正比,则v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6,据此分析。
【详解】A. v(O2):v(NO)=5:4,则4v(O2)=5v(NO),故A正确;
B. v(O2):v(H2O)=5:6,则6v(O2)=5v(H2O),故B错误;
C. v(NH3):v(H2O)=4:6=2:3,则3v(NH3)=2v(H2O),故C错误;
D. v(NH3):v(O2)=4:5,则5v(NH3)=4v(O2),故D错误;
故选:A。
5.D
【详解】A.OTC药品一 般指非处方药,可自行根据需要选购,A错误;
B.过量的食品防腐剂会危害人体健康,B错误;
C.过量使用会造成浪费,且会污染水源和大气,故使用硝酸铵施肥时应适量使用,C错误;
D.碳酸钙可以作为营养强化剂使用,向婴儿奶粉中加入碳酸钙可以补钙,D正确;
故本题选D。
6.C
【详解】A.氢氧化钠属于强碱,水溶液中完全电离出氢氧根离子,溶液显碱性,故A不选;
B.氯化铵属于强酸弱碱盐,铵根离子发生水解溶液显酸性,故B不选;
C.碳酸钠属于弱酸强碱盐,碳酸根离子水解溶液显碱性,故C选;
D.氨气水溶液中一水合氨为碱,电离出氢氧根离子,溶液显碱性,故D不选;
故选C。
7.D
【详解】A.Zn、Cu、硫酸构成的原电池中,活泼金属锌做负极,金属铜做正极,故不选A;
B.原电池中电流从正极流向负极,即从铜片经导线流向锌片,故不选B;
C.溶液中的阴离子定向移向负极(Zn),故不选C;
D.原电池的正极反应是:2H++2e-=H2↑,发生还原反应,故选D;
答案:D。
【点睛】原电池:负极升失氧,正极降得还,阳离子移向正极,阴离子移向负极。
8.C
【分析】番茄电池为原电池,活泼电极做负极,Zn比Cu活泼,Zn片作负极,Cu作正极,负极上Zn失去电子变为锌离子,Zn片质量减小。
【详解】A. 番茄电池为原电池,活泼电极做负极,Zn比Cu活泼,Zn片作负极,故A错误;
B. Zn片作负极,失去电子变为锌离子,Zn片质量减少,故B错误;
C. 电子由负极经导线流向正极,则电子由Zn片经导线流向Cu片,故C正确;
D. 原电池是将化学能转化为电能的装置,故D错误;
答案选C。
9.A
【详解】A.冰融化成水只是物质状态发生了变化,只有热量变化,不存在化学能与热能相互转化,A符合题意;
B.消毒杀菌是利用消毒剂或其他方法杀死细菌、病毒,这个过程中发生化学变化,有化学能与热能相互转化,B不符题意;
C.食品腐败是食品由于发生缓慢氧化而变质,氧化反应放热,存在化学能与热能相互转化,C不符题意;
D.燃放爆竹是火药燃烧,化学能转化为热能,存在化学能与热能相互转化,D不符题意。
答案选A。
10.D
【详解】A.图1为原电池,阳离子移向正极,Zn为负极,Cu为正极,则盐桥中的阳离子移向CuSO4溶液,A错误;
B.负极上锌失电子,Zn发生氧化反应,正极得电子,发生还原反应,则MnO2发生还原反应,B错误;
C.铅蓄电池放电时,负极反应为:Pb-2e-+=PbSO4,正极的反应为:PbO2+2e-+4H++=PbSO4+2H2O,所以正负极质量都增大,C错误;
D.电解质溶液采用稀硫酸时,氧气得电子生成水,正极反应为O2+4H++4e-=2H2O,D正确;
故选:D。
11.BC
【分析】影响化学反应速率的外界条件一般是温度、浓度和压强等,据此解答。
【详解】A.盐酸的浓度越大反应速率越快,与盐酸的体积无关系,A错误;
B.盐酸的浓度越大反应速率越快,B正确;
C.固体表面积越大,反应速率越快,石灰石颗粒的大小能影响反应速率,C正确;
D.该反应是液体和固体的反应,压强不影响反应速率,D错误;
故选BC。
12.BD
【详解】只增大氮气的浓度时,平衡正向移动,因此氢气的转化率增大,氨气的物质的量增多,但氮气的转化率减小,氨在平衡混合气体中的含量不一定增大,所以答案选BD。
13.AD
【分析】常温下,某溶液中由水电离出的c(H+)水=1.0×10-13 ml/L<10-7ml/L,说明该溶液中的溶质抑制了水的电离;酸碱对水的电离有抑制作用,水解的盐促进水的电离,据此分析判断。
【详解】A. 稀硫酸是强酸,硫酸电离出的氢离子抑制水的电离,A项正确;
B. 氯化钠溶液电离的氯离子和钠离子不影响水的电离,氯化钠溶液显中性,对水的电离无影响,B项错误;
C. 硝酸钠溶液为强酸强碱盐,溶液显中性,对水的电离无影响;C项错误;
D. 氢氧化钠是强碱,氢氧化钠电离出的氢氧根离子抑制水的电离,D项正确;
答案选AD。
14.AD
【详解】A.石墨转化为金刚石为吸热反应,说明石墨的能量低,石墨稳定,A项正确;
B.燃烧为放热反应,B项错误;
C.碳和二氧化碳的反应为吸热反应,C项错误;
D.投泥泼水愈光明是指高温下碳和水蒸气反应,该反应为吸热反应,D项正确。
故选AD。
15.(1)F-+H2O⇌HF+OH-
(2)NH+H2O⇌NH3·H2O+H+
(3)
(4)HCO+H2O⇌H2CO3+OH-
(5)
【分析】水解的实质是盐电离的弱离子结合水电离的氢离子或氢氧根离子生成弱电解质,以此解题。
【详解】(1)F-结合水电离的氢离子生成氟化氢,水解反应的离子方程式为:F-+H2O⇌HF+OH-;
(2)铵根离子水解生成一水合氨,水解反应的离子方程式为:NH+H2O⇌NH3·H2O+H+;
(3)铜离子水解生成氢氧化铜,水解反应的离子方程式为:;
(4)碳酸氢根离子水解生成碳酸,水解反应的离子方程式为:HCO+H2O⇌H2CO3+OH-;
(5)醋酸根离子水解生成醋酸分子,水解反应的离子方程式为:。
16. C2H2(g)+O2(g)=CO2(g)+H2O(l) ∆H=-1299.6KJ/m C2H5OH(l)+O2(g) =CO2(g)+H2O (l) ∆H=-683.4KJ/ml 74.4KJ/ml
【分析】(2)根据盖斯定律,目标反应=反应②-①得到。
【详解】(1)①1mlC2H2(g)在O2中完全燃烧生成CO2和液态水,放出1299.6KJ的热量,热化学方程式:C2H2(g)+O2(g)=CO2(g)+H2O(l) ∆H=-1299.6kJ/ml;
②23g C2H5OH的物质的量为,热化学方程式:C2H5OH(l)+O2(g) =CO2(g)+H2O (l) ∆H=-683.4kJ/ml;
(2)根据盖斯定律,用反应②-①得到目标反应CH4(g)=C(s)+ 2H2(g),∆H=∆H2-∆H1=(205.9-131.5) kJ/ml =+74.4kJ/ml
17.(1)C
(2)CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41kJ·ml-1
(3) 0.02 10%
【详解】(1)A.氧化钠与水化合的反应为放热反应,A不符合题意;
B.燃烧反应都是放热反应,B不符合题意;
C.碳酸钙受热分解为吸热反应,C符合题意;
D.活泼金属与酸的置换反应为放热反应,D不符合题意;
综上所述答案为C。
(2)据图可知该反应的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41kJ·ml-1;
(3)①0~2min内,v(PCl5)==0.02 ml/(L·min),同一反应中不同物质的反应速率之比等于计量数之比,所以v(Cl2)= 0.02 ml/(L·min);
②平衡时Δn(PCl5)=0.4ml,根据方程式可知此时Δn(PCl3)=0.4ml,所以转化率为×100%=10%。
18.(1)
(2)<
(3)
(4)=
(5)<
【详解】(1)NH4Cl为强酸弱碱盐,水解呈酸性,其水解的离子方程式为;
(2)CH3COONH4中铵根离子和醋酸根离子发生相互促进的水解,水解程度较大;NH4HSO4中电离的氢离子抑制铵根离子水解,铵根离子水解程度较小,水解程度越大,则离子浓度越小, CH3COONH4中铵根离子浓度小于NH4HSO4中铵根离子浓度,即②、③中的大小关系是②
相关试卷
这是一份海南省三亚市2022-2023学年高二上学期期中考试化学试卷(含解析),共25页。试卷主要包含了单选题,多选题,实验题,填空题,工业流程题,结构与性质等内容,欢迎下载使用。
这是一份2022-2023学年海南省海口市海南中学高二下学期期中考试化学试题含解析,共22页。试卷主要包含了选择题等内容,欢迎下载使用。
这是一份海南省海口市2023届高三第二次模拟考试化学试卷(含解析),共17页。试卷主要包含了单选题,多选题,工业流程题,实验题,原理综合题,有机推断题,结构与性质等内容,欢迎下载使用。










