
高中人教版 (2019)第二节 氮及其化合物测试题
展开这是一份高中人教版 (2019)第二节 氮及其化合物测试题,共4页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
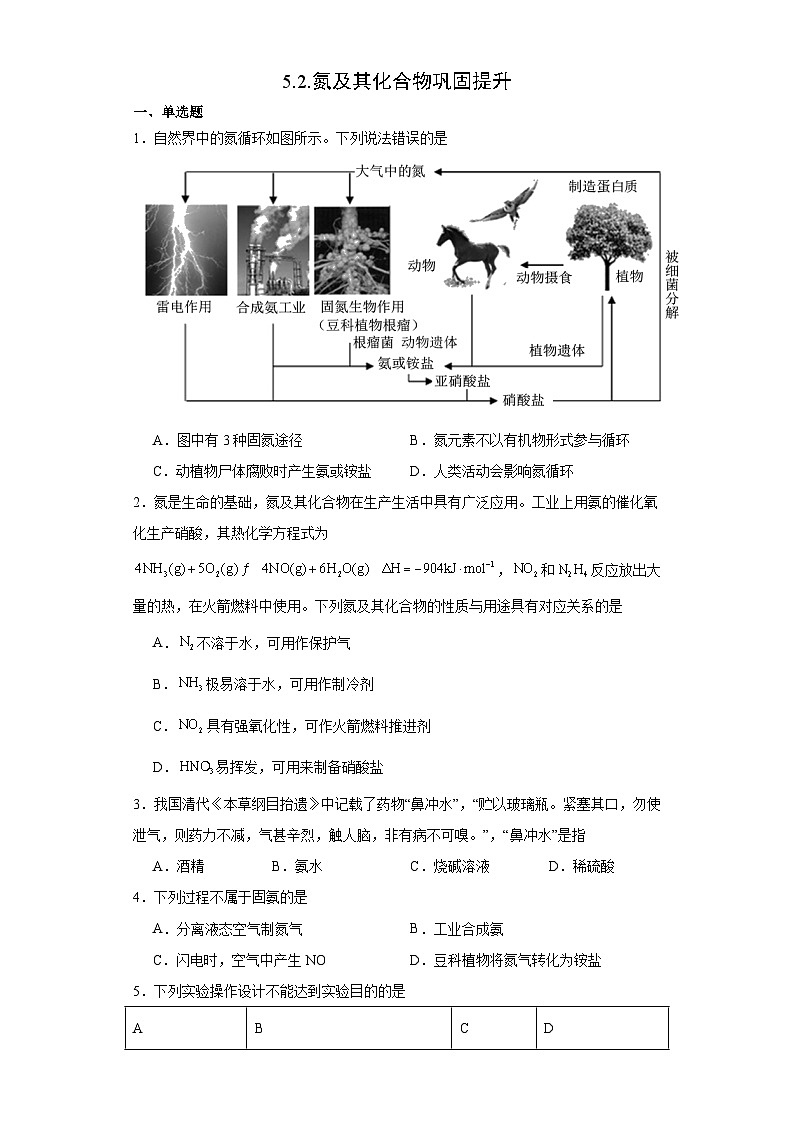
1.自然界中的氮循环如图所示。下列说法错误的是
A.图中有3种固氮途径B.氮元素不以有机物形式参与循环
C.动植物尸体腐败时产生氨或铵盐D.人类活动会影响氮循环
2.氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为,和反应放出大量的热,在火箭燃料中使用。下列氮及其化合物的性质与用途具有对应关系的是
A.不溶于水,可用作保护气
B.极易溶于水,可用作制冷剂
C.具有强氧化性,可作火箭燃料推进剂
D.易挥发,可用来制备硝酸盐
3.我国清代《本草纲目抬遗》中记载了药物“鼻冲水”,“贮以玻璃瓶。紧塞其口,勿使泄气,则药力不减,气甚辛烈,触人脑,非有病不可嗅。”,“鼻冲水”是指
A.酒精B.氨水C.烧碱溶液D.稀硫酸
4.下列过程不属于固氨的是
A.分离液态空气制氮气B.工业合成氨
C.闪电时,空气中产生NOD.豆科植物将氮气转化为铵盐
5.下列实验操作设计不能达到实验目的的是
A.AB.BC.CD.D
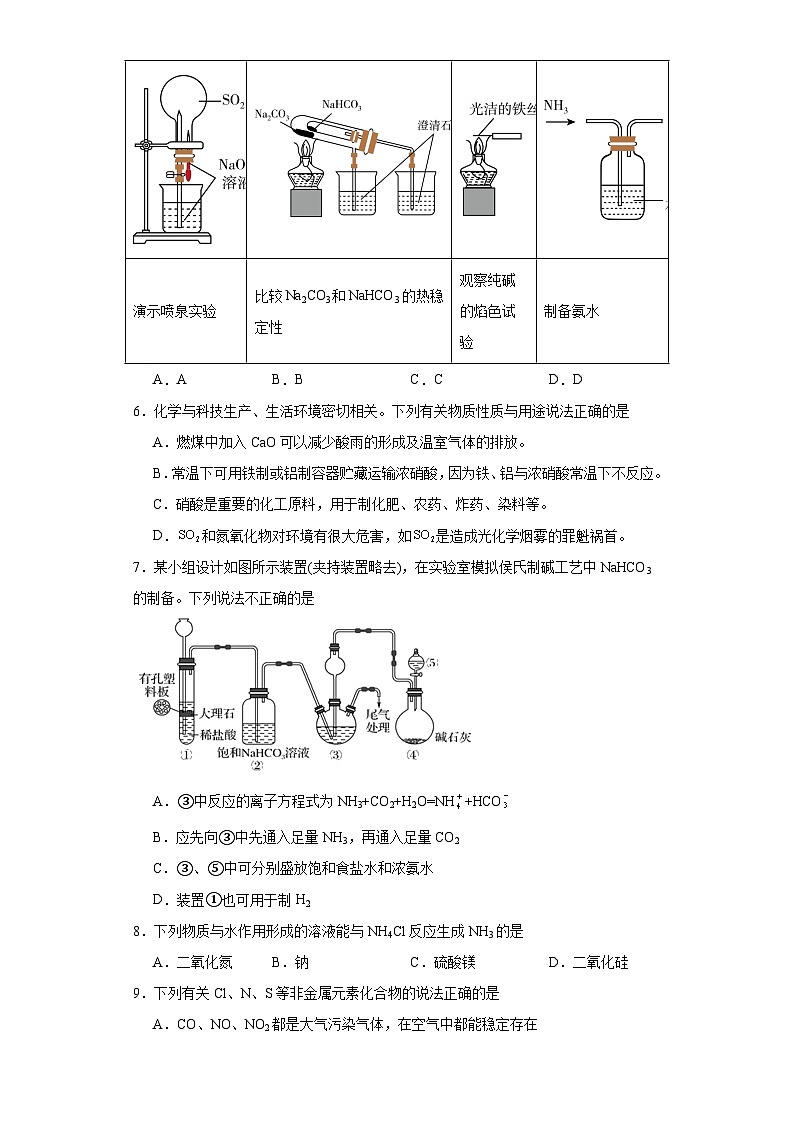
6.化学与科技生产、生活环境密切相关。下列有关物质性质与用途说法正确的是
A.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放。
B.常温下可用铁制或铝制容器贮藏运输浓硝酸,因为铁、铝与浓硝酸常温下不反应。
C.硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。
D.和氮氧化物对环境有很大危害,如是造成光化学烟雾的罪魁祸首。
7.某小组设计如图所示装置(夹持装置略去),在实验室模拟侯氏制碱工艺中NaHCO3的制备。下列说法不正确的是
A.③中反应的离子方程式为NH3+CO2+H2O=NH+HCO
B.应先向③中先通入足量NH3,再通入足量CO2
C.③、⑤中可分别盛放饱和食盐水和浓氨水
D.装置①也可用于制H2
8.下列物质与水作用形成的溶液能与NH4Cl反应生成NH3的是
A.二氧化氮B.钠C.硫酸镁D.二氧化硅
9.下列有关Cl、N、S等非金属元素化合物的说法正确的是
A.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
B.N2是大气中的主要成分之一,雷雨时,可直接转化为NO2
C.实验室不能用无水氯化钙干燥氨气
D.硫是一种淡黄色的能溶于水的晶体,既有氧化性又有还原性
10.下列叙述中,正确的是
A.氨气喷泉实验说明氨气极易溶解于水
B.NaHCO3的热稳定性比Na2CO3强
C.过量铁粉加入CuCl2溶液中,充分反应后溶液中的阳离子主要是Fe3+
D.氯气中含有的少量氯化氢,可用氢氧化钠溶液除去
11.下列各种情况下,溶液中一定能大量存在的离子组是
A.能使pH试纸变红的溶液:Na+、、、Fe2+
B.含有大量的溶液:H+、Fe2+、、Cl-
C.含有大量C1-的溶液:Al3+、Mg2+、、OH-
D.加入锌粒后产生大量氢气的溶液:、Na+、、Cl-
12.下列有关实验的操作叙述不正确的是
A.Na2S 水溶液中通入Cl2,有淡黄色沉淀生成,说明非金属性 Cl>S
B.某位同学配制一定物质的量浓度的 NaOH 溶液定容时,俯视凹液面最低点,将造成所配溶液浓度偏高
C.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2 固体,铜粉仍不溶解
D.用蒸发皿进行加热蒸发时,不需垫石棉网可直接进行
13.为阿伏加德罗常数的值,下列说法正确的是
A.2mlNO与在密闭容器中充分反应后,容器中的分子总数为
B.11.2L乙烷和丙烯的混合气体中所含碳氢键数为
C.中含有的中子数为
D.标准状况下,22.4LHCl气体中数目为
14.下列说法正确的是( )
A.漂白粉的有效成分是次氯酸钙,漂白粉属于混合物
B.苯甲酸钠和碘化钾都是食品添加剂,分别用于食品防腐和食盐加碘
C.工业生产中排放的SO2、NO2、CO2等气体是导致温室效应的主要物质
D.化学反应能够制造出新的物质,也能制造出新的元素
15.在①大气固氮;②硝酸银分解;③实验室制取氨气等变化中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
A.①②③B.②①③C.③②①D.③①②
16.下列有关化学反应的叙述正确的是( )
A.室温下与纯净反应制取
B.实验室用和在高温高压催化剂条件下制取
C.与反应生成和
D.与过量氨水反应生成
17.将铁屑溶于过量盐酸后,再加入下列物质,含有三价铁生成的是
A.硝酸锌B.硫酸C.硫酸镁D.氯化铜
18.关于氮氧化物的说法正确的是
A.NO和NO2都是常见的酸性氧化物,可以在一定条件下相互转化
B.在NO2被水吸收的反应中,NO2只作氧化剂。
C.氨催化还原法指的是用氨作还原剂,将NO、NO2转化为无毒的气体
D.NO、NO2都是大气污染气体,在空气中都能稳定存在
19.实验室制取NH3时,下列装置能达到相应实验目的的是
A.AB.BC.CD.D
20.实验室制备某常见气体的装置如下图所示,其中①、②、③、④分别为制备、除杂(除非水杂质,如无必要可省略)、干燥和收集装置,下列所制备的气体和所选干燥剂的组合中可行的是
A.AB.BC.CD.D
21.25℃时,能在溶液中大量共存的一组离子是
A.、、、B.、、、
C.、、、D.、、、
22.下列指定反应的离子方程式正确的是
A.将铜丝插入稀硝酸中: Cu+4H++2NO= Cu2+ +2NO2↑+H2O
B.碳酸氢钠溶液和过量的澄清石灰水混合: 2HCO+ Ca2+ + 2OH-=CaCO3↓+ CO+ 2H2O
C.四氯化钛的浓溶液制备水合二氧化钛:Ti4++(x+2)H2O=TiO2·xH2O↓+4H+
D.硫化亚铁与浓硫酸混合加热: 2H++FeS H2S↑+ Fe2+
23.如图所示,向一定量的铁粉中加入一定体积12ml/L的浓硝酸并加热,待反应结束时,下列微粒在体系中一定大量存在的是
① NO3-② Fe3+ ③ Fe2+ ④ NO ⑤NO2 ⑥H+
A.①②B.①⑤C.②⑤⑥D.①③⑤
24.下列有关说法正确的是
A.二氧化硫可用于抑制酒类中细菌生长,可在葡萄酒中微量添加
B.浓HNO3能溶解金属铜,说明其具有强酸性
C.二氧化硫使酸性高锰酸钾褪色,体现了二氧化硫的漂白性
D.浓HNO3能与碳反应,说明其具有强还原性
25.将12.6g镁铝合金加入到400mL稀硝酸中,恰好完全反应后,收集到还原产物NO气体8.96L标准状况,假设反应中还原产物只有NO),向所得溶液中加入溶液325mL,沉淀部分溶解,下列有关叙述错误的是
A.合金中Al的质量分数约为
B.原稀硝酸的浓度为
C.反应最终产生沉淀25.2g
D.向产生沉淀后的混合液中滴加225mL稀硝酸,产生的沉淀完全溶解
二、填空题
26.的催化氧化 。
27.如图所示的氮循环是生态系统物质循环的重要组成部分。
(1)下列说法不正确的是 。
A.图中①和②的转化过程属于氮的固定
B.氮循环过程中含氮有机物和含氮无机物可以相互转化
C.③和④的转化一定属于氧化还原反应
D.⑥是在反硝化细菌作用下的反硝化过程,该过程有助于弥补人工固氮对氮循环造成的影响
(2)⑤是在硝化细菌作用下的硝化过程,NH在有氧时发生硝化生成NO的离子方程式为 。
28.在浓硝酸中加入铜片,回答问题。
(1)开始反应的化学方程式为 ,实验现象为 。
(2)待反应停止后,再加入少量质量分数为25%的稀硫酸,这时铜片上又有气泡产生,其原因是(用离子方程式表示) 。
(3)若将12.8 g铜跟一定量的浓硝酸反应,铜耗完时,共产生气体(NO和NO2的混合气体)5.6 L(标准状况),则所消耗的硝酸的物质的量是 ,所得气体的平均相对分子质量为 。
A
B
C
D
演示喷泉实验
比较Na2CO3和NaHCO3的热稳定性
观察纯碱的焰色试验
制备氨水
A.生成
B.干燥
C.收集
D.吸收尾气
选项
A
B
C
D
气体
氧气
氯气
氢气
氨气
干燥剂
碱石灰
浓硫酸
五氧化二磷
无水氯化钙
参考答案:
1.B
【详解】A.固氮指将N2转化为含氮化合物,图中涉及自然固氮:在雷电作用下,N2与O2反应生成NO;人工固氮:合成氨工业;植物固氮:根瘤菌利用体内固氮酶将N2转化为含氮化合物,A正确;
B.图中涉及蛋白质,蛋白质属于有机物,B错误;
C.根据图示,动植物遗体腐败后产生氨或铵盐,C正确;
D.人类活动会向环境中排放氮氧化物,农业使用含氮化肥,生活中排放的含氮废水等都会影响氮循环,D正确;
故答案选B。
2.C
【详解】A.常做保护气,与其无毒无害,且性质稳定有关,与溶解性无关,因此故A错误;
B.常做制冷剂,是因为其易液化,余溶解性无关,故B错误;
C.具有强氧化性,能与发生氧化还原反应,反应放出大量热,因此可作火箭推进剂,故C正确;
D.可用硝酸制备硝酸盐,是因为硝酸是典型的强酸,可与碱或盐等物质反应生成硝酸盐,与其挥发性无关,故D错误;
故选:C。
3.B
【详解】“鼻冲水”说明易挥发,有刺激性气味,且有毒,则其为氨气,综上所述,故选B。
4.A
【分析】氮的固定是指游离态氮元素到化合态的过程。
【详解】A.分离液态空气制氮气,氮气在状态上发生改变,不属于氮的固定,A项选;
B.工业合成氨是N2与H2在一定条件下反应生成NH3,属于人工固氮,B项不选;
C.闪电时N2转化为NO,属于大气固氮,C项不选;
D.豆科作物根瘤菌将氮气转化为铵盐属于生物固氮,D项不选;
答案选A。
5.D
【详解】A.二氧化硫和氢氧化钠反应,装置中压强减小,能形成喷泉,A正确;
B.碳酸氢钠受热分解生成二氧化碳、碳酸钠,碳酸钠受热不分解,实验可以比较Na2CO3和NaHCO3的热稳定性,B正确;
C.焰色反应,也称作焰色测试及焰色试验,是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特殊颜色的反应;钠离子的颜色反应为黄色,C正确;
D.氨气极易溶于水,图中装置会导致水倒吸实验设计错误,D错误;
故选D。
6.C
【详解】A.燃煤中加入CaO可吸收二氧化硫,减少酸雨的发生,但不能减少温室气体的排放,A错误;
B.浓硝酸与铁铝可发生钝化反应,常温下可用铁制或铝制容器贮藏运输浓硝酸,不是铁、铝与浓硝酸常温下不反应,反应了生成了致密的氧化物薄膜,不再继续反应,B错误;
C.硝酸具有酸性,能和碱和碱性氧化物反应生成钾肥、铵肥,还能生成农药和炸药等,C正确
D.SO2和氮氧化物对环境有很大的危害,氮氧化物是形成光化学烟雾的罪魁祸首,D错误;
故选C。
7.A
【分析】装置①生成CO2,装置②除去CO2中的HCl杂质,装置③是主反应容器,生成NaHCO3,装置⑤中的浓氨水滴入碱石灰后生成氨气进入装置③。
【详解】A.③中两种气体通入饱和食盐水中,得到碳酸氢钠沉淀: ,A错误;
B.因CO2在饱和食盐水中的溶解度较小,不利于生成产品,应先通入足量NH3,使溶液呈碱性,易于较大程度溶解CO2,B正确;
C.据分析,③、⑤中可分别盛放饱和食盐水和浓氨水,C正确;
D.装置①是“固+液”无需加热型气体发生装置,符合氢气的实验室制取原理,D正确;
故选A。
8.B
【详解】A.二氧化氮溶于水生成硝酸和NO,硝酸与氯化铵不反应,A错误;
B.钠溶于水生成氢氧化钠和氢气,氢氧化钠是强碱,与氯化铵反应生成氨气,B正确;
C.硫酸镁溶液与氯化铵不反应,C错误;
D.二氧化硅不溶于水,与氯化铵不反应,D错误;
答案选B。
9.C
【详解】A.在空气中,NO不能稳定存在,会被空气中的氧气氧化生成NO2,故A错误;
B.放电时,氮气和氧气反应生成NO,NO不稳定,继续被氧气氧化生成NO2,故B错误;
C.由于无水氯化钙能吸收氨气,用氯化钙来干燥潮湿氨气时,得到的是八氨合氯化钙这个络合物,即CaCl2+8NH3=CaCl2•8NH3;因此不可以用无水氯化钙干燥氨气,故C正确;
D.S单质的化合价为0价,反应中化合价既可以升高也可以降低,则既有氧化性又有还原性,硫是淡黄色固体,不溶于水,微溶于酒精,易溶于二硫化碳,故D错误;
答案选C。
10.A
【详解】A.氨气极易溶于水,导致烧瓶内压强急剧减小,外界大气压不变,大气压迫使水通过导管进入烧瓶而产生喷泉实验,此实验说明氨气极易溶于水,故A正确;
B.碳酸氢钠不稳定,在加热条件下易分解生成碳酸钠、水和二氧化碳,该实验说明碳酸钠的稳定性大于碳酸氢钠,故B错误;
C.铜离子的氧化性较弱,能把铁氧化为亚铁离子而不能氧化为铁离子,故C错误;
D.氯化氢和氯气都能与氢氧化钠溶液反应,所以不能用氢氧化钠除去氯气中的氯化氢,可以用饱和的食盐水除去氯气中的氯化氢,故D错误;
故选A;
11.A
【详解】A.能使pH试纸变红的溶液显酸性,其中含有大量H+,H+与选项离子之间不能发生任何反应,可以大量共存,A符合题意;
B.含有大量的溶液:H+、Fe2+、会发生氧化还原反应,不能大量共存,B不符合题意;
C.Al3+、均会与OH-会反应产生,不能大量共存,C不符合题意;
D.加入锌后产生大量氢气的溶液显酸性,含有大量H+,H+与起HNO3的作用,表现强氧化性,与锌不能反应产生H2,D不符合题意;
故选A。
12.C
【详解】A.Na2S 水溶液中通入Cl2,有淡黄色沉淀生成,说明有S单质生成,所以氧化性Cl2>S,所以说明非金属性 Cl>S,故A正确;
B.定容时,俯视凹液面最低点,会使溶液的体积偏小,造成浓度偏高,故B正确;
C.加入硝酸铜后,溶液中有大量硝酸根和氢离子,在酸性环境下硝酸根会表现强氧化性将铜单质氧化成铜离子,铜粉溶解,故C错误;
D.蒸发皿为常见的直接加热仪器,用蒸发皿进行加热蒸发时,不需垫石棉网可直接进行加热,故D正确;
故答案为C。
13.C
【详解】A.存在以下反应2NO+O2 = 2NO2,2NO2N2O4,2mlNO与生成2ml NO2,NO2有一部分转化为N2O4,所以容器中的分子总数小于,该选项错误。
B.已知气体体积,但未说明标准状况下,不可计算,该选项错误。
C.已知,中子数=质量数-质子数。为0.1ml,一个氧原子含有的中子数是18-8=10,所以中含有的中子数为,该选项正确。
D.HCl气体是分子构成,不存在,该选项错误。
故选择C。
14.A
【详解】A. 漂白粉中含CaCl2、Ca(ClO)2,有效成分是次氯酸钙,所以漂白粉属于混合物,A正确;
B. 苯甲酸钠是食品添加剂,用于食品防腐,食盐加碘加入的是碘酸钾,不是碘化钾,B错误;
C. 导致温室效应的气体是CO2,不是SO2、NO2,C错误;
D. 化学反应能够制造新的物质,但不能制造出新的元素,D错误;
故合理选项是A。
15.A
【详解】①大气固氮中氮元素的化合价升高,被氧化;②硝酸银分解生成银、NO2和水,氮元素化合价降低,被还原;③实验室制取氨气的反应不是氧化还原反应;
答案选A。
16.D
【详解】A.室温下,不管是空气中还是纯净的,与反应得到的都是,加热(或灼烧)条件下才会得到,A错误;
B.实验室用氢氧化钙和氯化铵制取,工业上用和在高温高压催化剂条件下制取,B错误;
C.与反应生成和C,C错误;
D.氨水过量,生成正盐,所以与过量氨水反应生成,D正确;
故选D。
【点睛】二元或二元以上的酸(如H2CO3)或其相应的酸性氧化物(如CO2)和碱(如氢氧化钙)或盐(如NaAlO2)反应时,通常是酸或酸性氧化物过量时生成酸式盐,若碱或盐过量,则生成正盐。如二氧化碳通入石灰水中,开始时石灰水过量,生成碳酸钙,继续通入二氧化碳,则生成碳酸氢钙。
17.A
【详解】盐酸不能把铁氧化到最高价态,将铁屑溶于过量的盐酸中,发生反应:Fe+2HCl=FeCl2+H2↑;
A.将铁加入过量的盐酸中,铁反应完全后氢离子还有剩余,加入硝酸锌后,硝酸锌溶解,电离出硝酸根离子,而硝酸根离子和氢离子在同一溶液相当于硝酸,而硝酸具有强氧化性,可以将二价铁氧化为三价铁离子,选项A正确;
B.因为盐酸硫酸不具备强氧化性,不能氧化二价铁离子,所以,没有三价铁离子生成,选项B错误;
C.硫酸镁溶解,电离出硫酸根离子,与过量的氢离子在同一溶液,相当于稀硫酸,而稀盐酸硫酸不具备强氧化性,不能氧化二价铁离子,选项C错误;
D.氯化铜溶于水,电离出氯离子,与过量的氢离子在同一溶液,相当于稀盐酸,盐酸不能把二价铁离子氧化,选项D错误;
答案选A。
18.C
【详解】A.NO和碱不反应,NO2和碱反应发生的是氧化还原反应,都不是酸性氧化物,可以在一定条件下相互转化,选项A错误;
B.二氧化氮和水反应生成硝酸和一氧化氮,二氧化氮中氮元素化合价+4价升高到+5价,降低到+2价,NO2既做氧化剂也做还原剂,选项B错误;
C.催化还原法指的是用氨作还原剂,将NO、NO2转化为无毒的气体氮气,氨气做还原剂,氮氧化物做氧化剂,反应生成氮气和水,选项C正确;
D.NO、NO2都是大气污染气体,在空气中都不能稳定存在,选项D错误;
答案选C。
19.B
【详解】A.实验室用加热NH4Cl和Ca(OH)2固体混合物的方法制取少量NH3,制取装置中试管口应该略向下倾斜,防止水倒流引起试管炸裂,故A错误;
B.氨气是碱性气体,可以用碱石灰干燥,故B正确;
C.NH3的密度比空气小,应该用向下排空气法收集,即短口进长口出,故C错误;
D.NH3极易溶于水,装置图中导管不能直接插入水中,否则会引起倒吸,故D错误。
答案选B。
20.C
【详解】A.氧气密度比空气大,应该使用向上排空气方法收集,A错误;
B.氯气密度比空气大,应该使用向上排空气方法收集,B错误;
C.氢气与五氧化二磷不能反应,可以使用五氧化二磷进行干燥,其密度比空气小,可以使用装置④的用向下排空气法收集气体,C正确;
D.氨气会被无水氯化钙吸收,因此不能用无水氯化钙干燥,D错误;
故选C。
21.D
【详解】A.与反应生成二氧化碳和水,与不能共存,故不选A;
B.与反应生成硫酸钡沉淀,与不能共存,故不选B;
C.、和(或亚硫酸根离子)发生氧化还原反应,不能大量共存,故不选C;
D.、、、相互之间不反应,能大量共存,故选D;
选D。
22.C
【详解】A.将铜丝插入稀硝酸中反应生成一氧化氮气体:3Cu+8H++2NO=3Cu2++2NO↑+4H2O,A错误;
B.碳酸氢钠溶液和过量的澄清石灰水混合,碳酸氢根离子完全反应,氢氧根离子过量,反应生成碳酸钙沉淀和氢氧化钠:HCO+Ca2++OH-=CaCO3↓+H2O,B错误;
C.四氯化钛的浓溶液制备水合二氧化钛:Ti4++(x+2)H2O=TiO2·xH2O↓+4H+,C正确;
D.浓硫酸具有强氧化性,硫化亚铁与浓硫酸混合加热生成的硫化氢会和浓硫酸生成硫单质和二氧化硫气体:4H++FeS+ SO2H2O+S+SO2↑+Fe2+,D错误;
故选C。
23.B
【详解】试题分析:开始反应生成NO2,随反应的进行,硝酸浓度会变低,铁与稀硝酸反应生成NO,硝酸过量时生成三价铁,铁过量时,生成亚铁离子,若铁粉过量,体系中大量存在NO3-、Fe2+、NO2、NO;若HNO3过量,体系中大量存在NO3-、Fe3+、H+、NO2,一定大量存在为:NO3-、NO2,故选B。
考点:考查了硝酸的化学性质的相关知识。
24.A
【详解】A.二氧化硫具有一定的毒性,能够使蛋白质发生变性,因而可抑制酒类中细菌生长,防止葡萄酒霉化变质;同时其有还原性,能够防止葡萄酒氧化变质,可在葡萄酒中微量添加, A正确;
B.Cu在金属活动性顺序表中位于H元素后边,浓HNO3能溶解金属铜,说明其具有强氧化性,而不能说明其具有强酸性,B错误;
C.二氧化硫使酸性高锰酸钾褪色,体现了二氧化硫的还原性,C错误;
D.浓HNO3能与碳反应,说明其具有强氧化性,D错误;
故合理选项是A。
25.D
【详解】A.将镁、铝合金加入到稀中,两者恰好完全反应,反应中还原产物只有NO,发生反应:稀、稀,设Mg的物质的量为xml,Al的物质的量为yml,,根据得失电子相等:,解得,合金中Al的质量分数为,故不选A;
B. 根据反应方程式可知,硝酸的物质的量,则原稀硝酸的浓度为,故不选B;
C.,向反应后的溶液中加入过量NaOH溶液至沉淀完全发生反应:、,全部沉淀需NaOH为,过剩的氢氧化钠为,与0.1ml反应生成偏铝酸钠,则生成沉淀为和的,其质量为,故不选C;
D.沉淀溶解需稀硝酸:氢氧化镁溶解需稀硝酸,氢氧化铝溶解需稀硝酸,溶液中的需稀硝酸,所需稀硝酸共,体积,故选D;
答案:D。
26.
【详解】中氮元素显-3价,是氮的最低价态,可以升高而被氧化,故有还原性,在催化剂作用下能与氧气发生氧化还原反应,生成和,反应的化学方程式为:。
27.(1)C
(2)NH+2O2= NO+2H++H2O
【详解】(1)A.图中①和②的转化过程表示大气中的N2,转化为化合态,属于氮的固定,故A正确;
B.含氮无机物可以转化为动植物蛋白中的含氮有机物,动植物蛋白中的含氮有机物,也可以转化为含氮无机物,故B正确;
C.动植物蛋白中的含氮化合物中N元素的化合价有-3价,③中的N为-3价,④中N为+3价和+5价,③和④的转化不一定属于氧化还原反应,故C错误;
D.固氮的过程中,氮气可转化为氨气和硝酸根离子,反硝化过程中又将硝酸根离子转化为氮气,有助于弥补人工固氮对氮循环造成的影响,故D正确;
故选C;
(2)⑤是在硝化细菌作用下的硝化过程,NH在有氧时发生硝化生成NO,N元素化合价由-3价上升到+5价,O元素由0价下降到-2价,根据得失电子守恒和电荷守恒配平方程式为:NH+2O2= NO+2H++H2O。
28.(1) Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+ 2H2O 铜片逐渐溶解,溶液变蓝,有红棕色气体逸出
(2)3Cu+8H++2NO=3Cu2++2NO↑+4H2O
(3) 0.65 ml 41.2
【详解】(1)因反应开始硝酸的浓度大,反应剧烈,反应生成硝酸铜溶液、二氧化氮和水,反应的化学方程式为Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+ 2H2O;则观察到铜片逐渐溶解,溶液变蓝,有红棕色气体逸出;
(2)待反应停止后,溶液中还有NO,再加入少量质量分数为25%的稀硫酸,H+跟NO构成硝酸,使铜继续溶解,铜片上又有气泡产生,其原因用离子方程式表示为3Cu+8H++2NO=3Cu2++2NO↑+4H2O;
(3)从定量的角度来看,硝酸跟铜的反应表现了硝酸的酸性和强氧化性,且表现酸性的硝酸的物质的量等于铜的物质的量的2倍〔因生成了Cu(NO3)2〕,表现氧化性的硝酸的物质的量等于生成气体(NO或NO2)的物质的量,根据电子守恒,还可求出混合气体中NO和NO2的体积比及混合气体的平均相对分子质量。12.8 g铜物质的量为0.2ml,则消耗的硝酸的物质的量为0.2ml=0.65ml;0.2mlCu反应转移电子数为0.4ml,设NO和NO2的物质的量分别为x、y,则有x+y=和3x+y=0.4ml,解这两个方程组成的方程组可得:x=0.075ml,y=0.175ml,则所得气体的摩尔质量为:,故平均相对分子质量为41.2。
相关试卷
这是一份高中人教版 (2019)第五章 化工生产中的重要非金属元素第二节 氮及其化合物课时练习,共24页。试卷主要包含了单选题,填空题,判断题,解答题等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第二册第二节 氮及其化合物课时作业,共29页。试卷主要包含了单选题,填空题,判断题,解答题等内容,欢迎下载使用。
这是一份化学第二节 氮及其化合物课时练习,共20页。试卷主要包含了2 氮及其化合物 同步训练,0%等内容,欢迎下载使用。