

高考化学 考点33 原电池的工作原理及应用学案(含解析)
展开
这是一份高考化学 考点33 原电池的工作原理及应用学案(含解析),共6页。学案主要包含了原电池,原电池原理的应用等内容,欢迎下载使用。
一、原电池
1.原电池的基本概念
(1)原电池:把化学能转化为电能的装置。
(2)原电池的电极
负极:电子流出——活动性较强——发生氧化反应;
正极:电子流入——活动性较弱——发生还原反应。
(3)原电池的构成条件
①能自发发生氧化还原反应。
②具有活动性不同的两个电极(金属和金属或金属和非金属)。
③形成闭合回路或在溶液中相互接触。
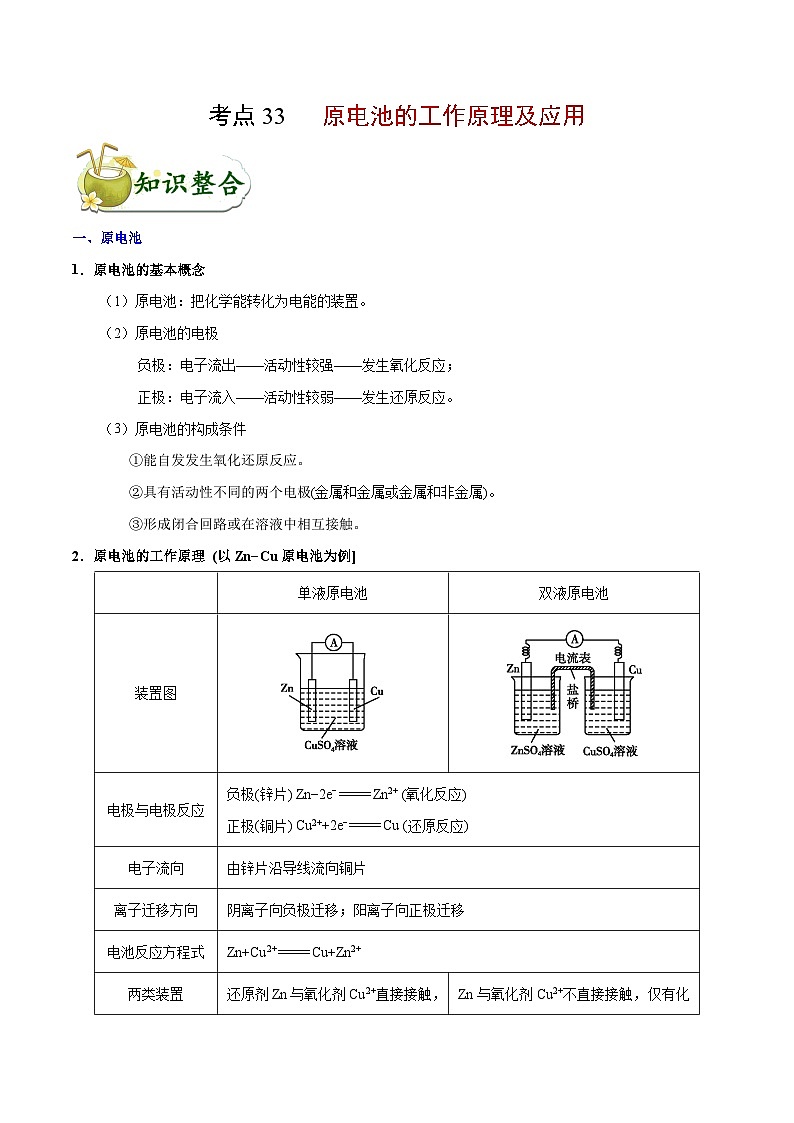
2.原电池的工作原理 (以Zn−Cu原电池为例]
(1)一般条件下,较活泼的金属材料作负极,失去电子,电子经外电路流向正极,再通过溶液中的离子形成的内电路构成环路。
①在原电池中,电极可能与电解质反应,也可能与电解质不反应;不发生反应的可看作金属发生吸氧腐蚀,如图所示。
②闭合回路的形成也有多种方式,可以是导线连接两个电极,也可以是两电极接触,如图所示。
(2)在原电池中,电流流动方向与电子流动方向相反。
(3)原电池的判定:一看有无外接电源,若有外接电源则为电解池,若无外接电源则可能为原电池;二看电极是否用导线相连并与电解质溶液形成闭合电路;三看电极与电解质溶液是否能发生自发的氧化还原反应。
3.原电池电极反应式的书写
(1)准确判断原电池的正负极是书写电极反应的关键。
如果原电池的正负极判断失误,电极反应式的书写一定错误。判断正负极的方法不是绝对的,例如铜片和铝片同时插入浓硝酸溶液中,由于铝片表明的钝化,这时铜失去电子,是负极,其电极反应为:
负极:Cu−2e− SKIPIF 1 < 0 Cu2+
正极:2 SKIPIF 1 < 0 + 4H+ + 2e− SKIPIF 1 < 0 2H2O + 2NO2↑
再如镁片和铝片同时插入氢氧化钠溶液中,虽然镁比铝活泼,但由于镁不与氢氧化钠反应,而铝却反应,失去电子,是负极,其电极反应为:
负极:2Al + 8OH−−6e− SKIPIF 1 < 0 2 SKIPIF 1 < 0 + 2H2O
正极:6H2O+6e− SKIPIF 1 < 0 6OH−+3H2↑
(2)要注意电解质溶液的酸碱性。
在正负极上发生的电极反应不是孤立的,它往往与电解质溶液紧密联系,如氢氧燃料电池有酸式和碱式,在酸溶液中,电极反应式中不能出现OH−,在碱溶液中,电极反应式中不能出现H+,像CH4、CH3OH等燃料电池,在碱溶液中碳(C)元素以 SKIPIF 1 < 0 离子形式存在,而不是放出CO2气体。
(3)要考虑电子的转移数目。
在同一个原电池中,负极失去电子数必然等于正极得到的电子数,所以在书写电极反应时,一定要考虑电荷守恒。防止由总反应方程式改写成电极反应式时所带来的失误,同时也可避免在有关计算中产生误差。
(4)要利用总的反应方程式。
从理论上讲,任何一个自发的氧化还原反应均可设计成原电池,而两个电极反应相加即得总反应方程式。所以只要知道总反应方程式和其中一个电极反应,便可以写出另一个电极反应方程式。
注意:介质对电极反应式书写的影响
①中性溶液反应物若是H+得电子或OH−失电子,则H+或OH−均来自于水的电离。
②酸性溶液反应物或生成物中均没有OH−。
③碱性溶液反应物或生成物中均没有H+。
④水溶液中不能出现O2−。
二、原电池原理的应用
原电池原理在工农业生产、日常生活、科学研究中具有广泛的应用。
化学电源:人们利用原电池原理,将化学能直接转化为电能,制作了多种电池。如干电池、蓄电池、充电电池以及高能燃料电池,以满足不同的需要。在现代生活、生产和科学研究以及科学技术的发展中,电池发挥的作用不可代替,大到宇宙火箭、人造卫星、飞机、轮船,小到电脑、电话、手机以及心脏起搏器等,都离不开各种的电池。
加快反应速率:如实验室用锌和稀硫酸反应制取氢气,用纯锌生成氢气的速率较慢,而用粗锌可大大加快化学反应速率,这是因为在粗锌中含有杂质,杂质和锌形成了无数个微小的原电池,加快了反应速率。
比较金属的活动性强弱:一般来说,负极比正极活泼。
防止金属的腐蚀:金属的腐蚀指的是金属或合金与周围接触到的气体或液体发生化学反应,使金属失去电子变为阳离子而消耗的过程。在金属腐蚀中,我们把不纯的金属与电解质溶液接触时形成的原电池反应而引起的腐蚀称为电化学腐蚀,电化学腐蚀又分为吸氧腐蚀和析氢腐蚀:在潮湿的空气中,钢铁表面吸附一层薄薄的水膜,里面溶解了少量的氧气、二氧化碳,含有少量的H+和OH−形成电解质溶液,它跟钢铁里的铁和少量的碳形成了无数个微小的原电池,铁作负极,碳作正极,发生吸氧腐蚀:
负极:2Fe−4e− SKIPIF 1 < 0 2Fe2+ 正极:O2+4e−+2H2O SKIPIF 1 < 0 4OH−
电化学腐蚀是造成钢铁腐蚀的主要原因。因此可以用更活泼的金属与被保护的金属相连接,或者让金属与电源的负极相连接均可防止金属的腐蚀。
考向一 原电池工作原理
典例1 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:在卡片上,描述合理的是
实验后的记录:
①Zn为正极,Cu为负极。
②H+向负极移动。
③电子流动方向:从Zn经外电路流向Cu。
④Cu极上有H2产生。
⑤若有1ml电子流过导线,则产生H2为0.5ml。
⑥正极的电极反应式为Zn-2e-===Zn2+。
A.①②③B.③④⑤C.④⑤⑥D.②③④
【答案】B
【详解】
①Zn可与硫酸发生氧化还原反应,而Cu不行,则Zn为负极,Cu为正极,①描述错误。
②H+向正极移动,②描述错误。
③电子流动方向为由负极流向正极:从Zn经外电路流向Cu,③描述正确。
④Cu极上氢离子得电子生成氢气,则有H2产生,④描述正确。
⑤若有1ml电子流过导线,则2ml氢离子得电子产生0.5ml H2,⑤描述正确。
⑥负极的电极反应式为Zn-2e-===Zn2+,⑥描述错误。
综上所述,答案为B。
1.分析下图所示的四个原电池装置,其中结论正确的是
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为6H2O+6e−6OH−+3H2↑
C.③中Fe作负极,电极反应式为Fe−3e−Fe3+
D.④中Cu作正极,电极反应式为2H++2e−H2↑
【答案】B
【解析】②中Mg不与NaOH溶液反应,而Al能和NaOH溶液反应失去电子,故Al是负极;③中Fe在浓硝酸中钝化,Cu和浓硝酸反应失去电子作负极,A、C错;②中电池总反应为2Al+2NaOH+2H2O2NaAlO2+3H2↑,负极反应式为2Al+8OH−−6e−2+4H2O,两者相减得到正极反应式为6H2O+6e−6OH−+3H2↑,B正确;④中Cu是正极,电极反应式为O2+2H2O+4e−4OH−,D错。
判断原电池正、负极的五种方法
注意:原电池的正极和负极与电极材料的性质有关,也与电解质溶液有关,不要形成活泼电极一定作负极的思维定式。
考向二 盐桥原电池
典例2 下列关于原电池的叙述正确的是( )
A.在外电路中,电流由铜电极流向银电极
B.正极反应为Cu2++2e-=Cu
C.实验过程中取出盐桥,原电池仍继续工作
D.将铜片直接浸入硝酸银溶液中发生的化学反应与该原电池反应相同
【答案】D
【分析】由示意图可知,Cu为原电池的负极,电极反应式为Cu-2e-=Cu2+,Ag为正极,电极反应式为2Ag++2e-=2Ag。
【详解】
A.电子是由负极流向正极,电流的移动方向和电子的移动方向相反,电流由正极流向负极,则电流由银电极流向铜电极,故A错误;
B.Ag为正极,电极反应式为2Ag++2e-=2Ag,故B错误;
C.盐桥起到了传导离子、形成闭合回路的作用,若实验过程中取出盐桥,原电池不能形成闭合回路,不能继续工作故C错误;
D.将铜片直接浸入硝酸银溶液和原电池反应均为铜与银离子发生置换反应生成银,发生的化学反应相同,故D正确;故选D。
2.控制适合的条件,将反应Fe3++AgFe2++Ag+设计成如图所示的原电池(盐桥装有琼脂—硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后观察到电流计指针向右偏转。下列判断正确的是
A.盐桥中的K+移向乙烧杯
B.一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转
C.在外电路中,电子从石墨电极流向银电极
D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转
【答案】D
【解析】该原电池中,Ag失电子作负极,石墨作正极,盐桥中K+移向正极(甲烧杯);一段时间后,原电池反应结束,电流计指针指向0;原电池外电路电子由负极流向正极,所以电子从银电极流向石墨电极;电流计指针居中后,往甲烧杯中加入一定量的铁粉,形成新的原电池,铁做负极,银做正极,故电流计指针向左偏转。
考向三 判断金属的活泼性及反应速率
典例3 有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
由此可判断这四种金属的活动性顺序是( )
A.B.C.D.
【答案】D
【分析】
装置一:发生电化学腐蚀,活泼金属作负极,不活泼金属作正极,负极发生氧化反应,负极质量减少;
装置二:发生化学腐蚀,活泼金属与酸反应放出氢气,不活泼金属与酸不反应;
装置三:发生电化学腐蚀,正极有气泡;
装置四:发生电化学腐蚀,氢离子的正极上得电子发生还原反应生成氢气。
【详解】
装置一:a极质量减小,则a为负极,失电子被氧化;b极质量增大,则得电子析出,故金属活动性:。
装置二:金属b、c未用导线连接,不能形成闭合回路,不是原电池,b极有气体产生,c极无变化,故金属活动性:。
装置三:d极溶解,则d为负极;c极有氢气产生,则c为正极,故金属活动性:。
装置四:电流从a极流向d极,则d为负极、a为正极,故金属活动性:。综上,金属活动性:,故选D。
3.等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中放入少量的CuSO4溶液,如图表示产生H2的体积(V)与时间(t)的关系,其中正确的是
【答案】D
【解析】等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中放入少量的CuSO4溶液,发生:Zn+Cu2+Zn2++Cu,形成原电池,反应速率增大,反应用时少于b,但生成的氢气也少于b,图像应为D。
考向四 设计原电池
典例4 事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是________(填序号,下同)。
a.C(s)+H2O(g)===CO(g)+H2(g) ΔH>0
b.2H2(g)+O2(g)===2H2O(l) ΔH
相关学案
这是一份人教版 (2019)选择性必修1第一节 原电池导学案及答案,共2页。学案主要包含了学习目标,学习重难点,课前复习,新课教学,思考与讨论1,课堂检测,思考与讨论2,课堂总结等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第一节 原电池导学案,共5页。学案主要包含了学科核心素养与教学目标,重点难点,教法与学法,教学过程,教学反思等内容,欢迎下载使用。
这是一份高考化学 考点35 电解原理及其应用学案(含解析),共6页。学案主要包含了电解池,电解原理的应用等内容,欢迎下载使用。









