

重庆市南开中学校2023-2024学年高三上学期11月期中化学试题
展开命审单位:重庆南开中学
考生注意:
1.本试卷满分100分,考试时间75 分钟。
2.考生作答时,请将答案答在答题卡上。必须在题号所指示的答题区域作答,超出答题区域书写的答案无效,在试题卷、草稿纸上答题无效。
可能用到的相对原子质量:H—1 0—16 Ni—59 Cu—64 Tl—204
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.科技发展离不开化学。下列说法不正确的是
A.“一带一路”,丝绸制品主要成分为纤维素
B.“乘风破浪”,航母上的钛合金铆钉属于金属材料
C.“筑梦天宫”,火箭助推剂液氧与臭氧互为同素异形体
D.“直上云霄”,客机所用燃油属于烃类物质
2.下列说法正确的是
A. SiO₂和 Al₂O₃都属于两性氧化物
B.乙酸与乙醛均能使溴水褪色
C. Fe 和 Cu 均能溶于稀硝酸
D. CO₂和 SO₃分别与 BaCl₂溶液反应,均生成白色沉淀
3.下列操作中,不会影响溶液中 K+、Na+、SO42−、CO32−、NO3−大量共存的是
A.加入少量 NH₄Cl溶液 B.加入少量 FeCl₃溶液
C.加入少量 Ba(OH)₂溶液 D.通入足量 SO₂气体
4.用下列实验方案不能达到实验目的的是
A.图①装置——验证 SO₂还原性 B.图②装置——在铁上镀铜
C.图③装置——证明铁发生吸氧腐蚀 D.图④装置——测定醋酸的浓度
5.臭氧能将污水中的氰化物转化为无毒物质,原理为: 503+2CN−+H2O=2HCO3−+N2+ 5O2,下列有关说法正确的是
A. N₂中σ键与π键数目之比为2:1
B.第一电离能:C
D. HCO₃中碳原子杂化方式为sp³
6.氨氮是水体的污染物之一,工业上可用次氯酸钠作处理剂,反应方程式为:
2NH₃+3NaClO=N₂+3NaCl+3H₂O。设阿伏加德罗常数的值为NA,下列说法正确的是
A.1 L 0.1m l/L NaClO 溶液中含有0.1NA 个 ClO⁻
B.18 g H₂O 中含有的孤电子对数目为2NA
C.生成11.2 L N₂,转移的电子数为 3NA
D.0.5 L0.1 ml/L 氨水中含有0.05NANH3⋅H2O
7.镍的某种氧化物是一种半导体,具有NaCl型结构(如图),已知晶胞边长为xpm,设阿伏加德罗常数的值为 NA,下列说法不正确的是
A. Ni 属于副族元素
B.与 Ni²⁺距离最近且相等的O²⁻有4个
C.晶体的密度为 3×1032x3NAg⋅cm−3
D.若该晶胞中氧原子有25%被氮原子替代,则该晶体的化学式为 Ni₄O₃N
8.短周期主族元素W、X、Y、Z、Q原子序数依次增大,Y的最外层电子数是内层电子数的3倍,Y与X、Q相邻,W与X、Q均不在同一周期且与Z同主族。下列说法正确的是
A. W、X、Y三种元素形成的化合物一定只含共价键
B.简单氢化物的沸点:Z>X>Y
C. X元素氧化物的水化物均为强酸
D. Y、Z的简单离子具有相同的电子层结构
9.室温下,将两种浓度均为 0.10ml⋅L⁻¹的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是
A.NaHCO₃−Na₂CO₃混合溶液: 3cNa+=2cHCO3−+2cCO32−+2cH2CO3
B.氨水—NH₄Cl混合溶液 KbNH3⋅H2O=1.8×10−5:
cNH4+>cCl−>cNH3⋅H2O>cOH−>c(H+)
C.CH₃COOH−CH₃COONa混合溶液: cH⁺+cNa⁺=cOH⁻+cCH₃COOH
D.H₂C₂O₄−NaHC₂O₄混合溶液: 2cH++cH2C2O4=cC2O42−+2cOH−
10.根据下列实验操作以及现象能得到正确实验结论的是
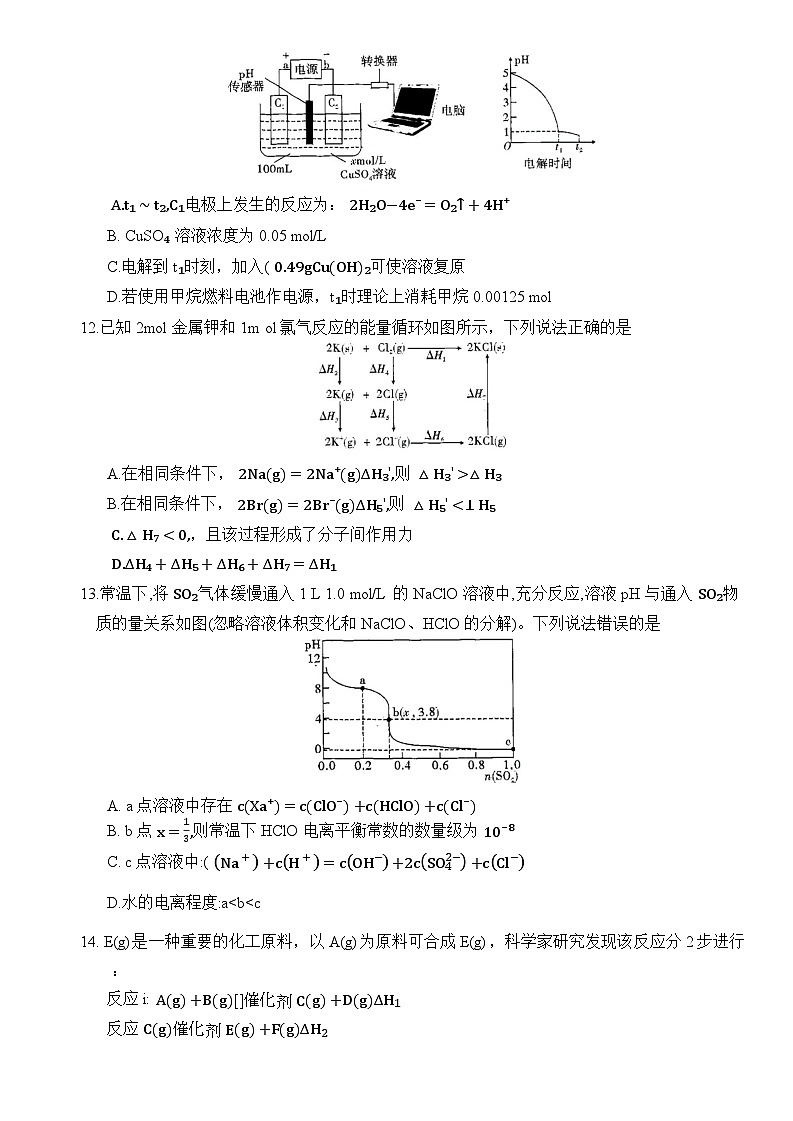
11.某化学兴趣小组设计如下实验,探究电解过程中溶液 pH 变化。装置、所得数据结果如图所示。电解过程中,充分搅拌使溶液均匀。下列说法错误的是
A.t₁∼t₂,C₁电极上发生的反应为: 2H₂O−4e⁻=O₂↑+4H⁺
B. CuSO₄ 溶液浓度为0.05 ml/L
C.电解到t₁时刻,加入( 0.49gCuOH₂可使溶液复原
D.若使用甲烷燃料电池作电源,t₁时理论上消耗甲烷0.00125 ml
12.已知2ml金属钾和1m l氯气反应的能量循环如图所示,下列说法正确的是
A.在相同条件下, 2Nag=2Na⁺gΔH₃',则 △H₃'>△H₃
B.在相同条件下, 2Brg=2Br⁻gΔH₅',则 △H₅'<⊥H₅
C.△H₇<0,,且该过程形成了分子间作用力
D.ΔH₄+ΔH₅+ΔH₆+ΔH₇=ΔH₁
13.常温下,将 SO₂气体缓慢通入1 L 1.0 ml/L 的 NaClO 溶液中,充分反应,溶液 pH 与通入 SO₂物质的量关系如图(忽略溶液体积变化和 NaClO、HClO的分解)。下列说法错误的是
A. a点溶液中存在 cXa⁺=cClO⁻+cHClO+cCl⁻
B. b点 x=13,则常温下 HClO 电离平衡常数的数量级为 10⁻⁸
C. c点溶液中:( Na++cH+=cOH−+2cSO42−+cCl−
D.水的电离程度:a
反应i: Ag+Bg催化剂Cg+DgΔH1
反应 Cg催化剂Eg+FgΔH2
恒温恒容条件下,向密闭容器中加入一定量A(g)和B(g),图甲为该体系中A、C、E浓度随时间变化的曲线,图乙为反应i和 的 lnk∼1T曲线 (lnk=−E∗RT+c,云为速率常数, E₄为反应活化能,R.、c为常数)。
下列说法正确的是
A.根据上述信息可知 △H₁>△H₂
B.在 t₁时刻之后,反应速率v(A)、v(C)、v(E)的定量关系为 vA+vC=vF
C.反应i、 的活化能大小关系为 E₃i}>Eᵤ
D.在实际生产中,充入一定量惰性气体一定可以提高E的平衡产率
二、非选择题:共58分。
15.(14分)铊(Tl)在工业中的用途非常广泛。从某铅锌厂的富铊灰(主要成分为 PbO、FeO、 Fe₂O₃、ZnO、Tl₂O)中回收铊的工艺流程如图所示:
已知:
①在氯化物—硫酸水溶液中,Tl以 TICl4−形式存在
②已知萃取过程的反应原理为 H++R+TlCl4−=HRTlCl4
③常温下 KspFeOH3=2.7×10−40KnrZnOH2=4×10−17 lg3≈0.5 lg2≈0.3请回答下列问题:
(1) Tl与Al同主族,写出基态Tl原子的价电子排布式 。
(2)写出“浸取Ⅰ”中‘ Tl₂O发生反应的离子方程式 。
(3)“萃取分液”过程若在实验室进行,必须使用的玻璃仪器有烧杯、 (填名称)。
(4)常温下,向“萃取”过程后的水相中加入 NaOH 溶液,调pH 回收铁。已知水相中 cZn²⁻=0.1 ml/L,控制 pH 范围为 (已知当溶液中离子浓度小于 1×10⁻⁵ml/L时,通常认为该离子沉淀完全)。
(5)请从化学平衡的角度解释“反萃取”过程中加入( CH₃COONH₄;溶液的原因
。
(6)写出“还原氯化沉淀”中反应的离子方程式 。
(7)已知a kg富铊灰中 Tl₂O的质量分数为 b%,经过上述流程后最终得到纯铊为c kg,则产率为 (用含字母a、b、c的表达式表示)。
16.(15分)乳酸亚铁是一种很好的补铁剂,制备乳酸亚铁晶体的方法之一是用新制的碳酸亚铁与乳酸溶液反应,下图为制备的具体流程。
某化学社小组成员模拟上述流程制备乳酸亚铁晶体,反应Ⅰ的装置如图所示:
完成下列填空:
(1)小组成员按上图连接好装置,检查装置气密性后加入药品,打开 K₁和 K₃,关闭 K₂。
①仪器B中产生的实验现象为 。
②反应一段时间后,关闭 (填“ K₁"A₂"’或“K₃”,下同),打开 ,观察到B中的溶液会流入C中,同时C中析出 FeCO₃沉淀。
③B中产生的气体除了把B中溶液压进C外,还有什么作用? 。
④仪器C中生成 FeCO₃的离子方程式为 。
(2)反应Ⅰ结束后,小组成员将仪器C中的浊液过滤得到 FeCO₃;沉淀,若在空气中过滤时间过长会发现沉淀表面部分呈红褐色,请用化学方程式说明原因 。
(3)反应Ⅱ结束后,小组成员继续加入乳酸调节溶液pH至5.8左右,目的是 。结晶时加入乙醇可以提高乳酸亚铁的析出率,其原因是 。
(4)实验结束后,小组成员用0.1000 ml/L 酸性 KMnO₄标准溶液进行滴定,通过测定产品中 Fe²⁺的量来计算产品的纯度,测定原理为: MnO4−+5Fe2++8H+=Mn2++5Ee3++4H2O 实验若干次后,发现每次的计算结果总是大于100%,其主要原因是 (不考虑操作不当引起的误差)。
17.(14分)碳和氮的化合物在诸多领域有着重要应用。回答下列问题:
Ⅰ.以 CO₂和 NH₃为原料合成尿素的能量变化如图甲所示。
(1)2NH3(g)﹢CO2(g)⇌CO(NH2)2(s)﹢H2O(g) ∆H= 。
(2)若向某恒容绝热的密闭容器中加入等物质的量的 NH₃和CO₂,发生上述反应。下列叙述不能说明反应已经达到平衡状态的是 (填字母)。
a. CO₂的体积分数保持不变
b.混合气体的密度不再变化
c.化学平衡常数不再变化
d.混合气体平均相对分子质量不再变化
Ⅱ. NO是主要大气污染物,可用H₂消除 NO污染,其反应如下:
主反应:2NOg+2H₂g⇌N₂g+2H₂Og△H₁<0
副反应:2 NOg+H₂g⇌N₂Og+HI₂Og△H₂<0
(3)某温度下,将2m l NO、3m l H₂充入某恒容密闭容器中反应,设起始压强为 1MPac若平衡后N₂与N₂O物质的量之比为2:1,NO的转化率为75%,则NO的有效消除率(转化为 N₂的NO的量与起始最的比值)为 %,主反应Kp,为 (计算结果保留两位有效数字)。
(4)还可以利用 NH₃消除NO 污染: 4NH₃g⋅+6NOg⇌5N₂g+6H₂Og△H<0。在2 L刚性容器内,分别通入 NH₃ 和NO,其它条件不变时,若相同时间内测得 NH₃的转化率随温度的变化曲线如图乙。200 ℃~700℃之间 NH₃的转化率先升高又降低的原因是 。
Ⅲ.电解法转化 CO₂可实现 CO₂资源化利用。
(5)如图为电解( CO₂制 CH₃OH的原理示意图。
①Sn片为 极(填“阴”或“阳”)。
②若维持 KHCO₃溶液浓度几乎不变,电解一段时间后,理论上Pt片产生的混合气体中组分气体体积比为 (忽略溶液体积变化且不考虑气体的溶解)。
18.(15分)工业上可利用一种良好的有机溶剂A制备有广泛用途的内酯F和高分子化合物 PC。
已知:
①有机物 A核磁共振氢谱图中只有一个吸收峰
②R1COOR2+R3OH 催化剂 ∆ R1COOR5+R2OH(R1,R2,R3代表烃基)
请回答下列问题:
(1)A的化学名称为 。
(2)B分子的VSEPR模型为 ,分子中的键角是否都相等? (填“是”或“否”)。
(3)已知D为乙酸乙酯,则C+D→E的反应类型为 。
(4)F分子内含有六元环,其结构简式是 。
(5)写出在一定条件下H和I合成PC的化学方程式 。
(6)有机物J是C的同分异构体,符合下列条件的J有 种(不考虑立体异构)。
a.能与新制 CuOH₂反应 b.不含醚键
其中可发生水解反应,核磁共振氢谱显示4组峰,且峰面积之比为3:2:2:1的结构简式为: 。
(7)以物质A、苯甲醇为原料选用必要的无机试剂合成
实验操作及现象
实验结论
A
将白色固体溶解,滴加足量稀盐酸,将样品产生的气体通入品红溶液,品红褪色
该白色固体为亚硫酸盐
B
将甲醇与足量KMnO₄溶液混合,紫红色变浅
甲醇被氧化为甲酸
C
向 Mg(OH)₂悬浊液中加入几滴 CuSO₄溶液,生成蓝色沉淀
证明 Kₛₚ[Mg(OH)₂]>Kₛₚ[Cu(OH)₂]
D
将盐酸与 NaHCO₃混合产生的气体直接通入苯酚钠溶液,溶液变浑浊
酸性:碳酸>苯酚
重庆市南开中学校2023-2024学年高三上学期1月第五次质量检测+化学试题: 这是一份重庆市南开中学校2023-2024学年高三上学期1月第五次质量检测+化学试题,共9页。
重庆市南开中学校2023-2024学年高二上学期期中考试化学试题(解析版): 这是一份重庆市南开中学校2023-2024学年高二上学期期中考试化学试题(解析版),共1页。
重庆市巴蜀中学校2023-2024学年高三上学期11月期中化学试题: 这是一份重庆市巴蜀中学校2023-2024学年高三上学期11月期中化学试题,共14页。试卷主要包含了下列说法错误的是等内容,欢迎下载使用。












