



人教版 (2019)必修 第一册第四章 物质结构 元素周期律第三节 化学键集体备课ppt课件
展开
这是一份人教版 (2019)必修 第一册第四章 物质结构 元素周期律第三节 化学键集体备课ppt课件,共10页。PPT课件主要包含了情景引入,一百多种元素,思考1,Na+,Cl-,不稳定,思考2,静电作用,平衡时成键,离子键等内容,欢迎下载使用。
[学习目标]1.通过氯化钠的形成过程,认识离子键的概念与形成,了解离子化合物的概念,会判断离子化合物。2.会用电子式表示常见离子化合物的形成过程,促进“宏观辨识与微观探析”化学核心素养的发展。[重点难点]1.离子键的概念与形成。2.离子化合物的判断。
【思考】元素的原子之间是通过什么作用形成了如此多的物质呢?
目标一 离子键与离子化合物
【知识回顾】氯化钠的形成过程
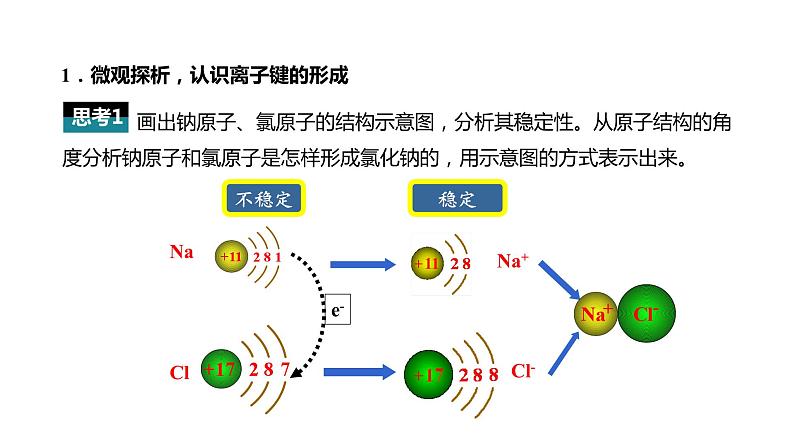
思考:如何从微观的角度来解析为什么金属钠和氯气能发生反应呢?(提示:从电子得失的角度分析)
1.微观探析,认识离子键的形成
画出钠原子、氯原子的结构示意图,分析其稳定性。从原子结构的角度分析钠原子和氯原子是怎样形成氯化钠的,用示意图的方式表示出来。
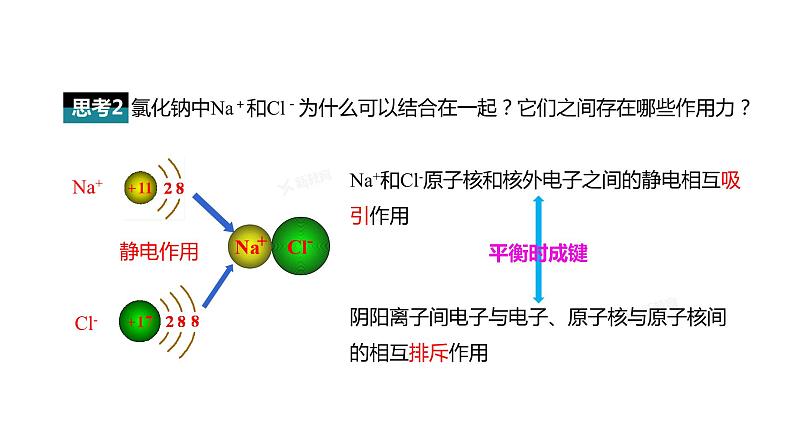
氯化钠中Na+和Cl-为什么可以结合在一起?它们之间存在哪些作用力?
Na+和Cl-原子核和核外电子之间的静电相互吸引作用
阴阳离子间电子与电子、原子核与原子核间的相互排斥作用
静电作用(吸引与排斥)
带相反电荷离子之间的相互作用叫做离子键。
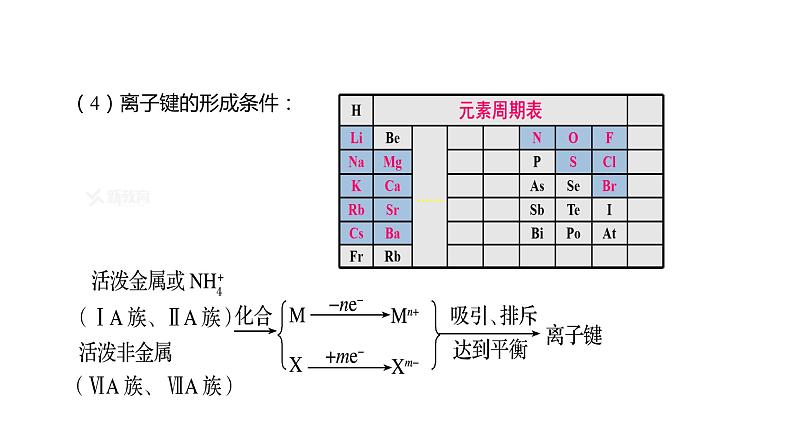
哪些元素间容易形成离子键?这些元素在元素周期表哪些位置?
(4)离子键的形成条件:
(1)定义:像氯化钠 这样,由离子键构成的化合物叫做离子化合物。
判断下列哪些物质是离子化合物?①KBr ②HCl③NH4Cl ④NaOH⑤KNO3 ⑥Na2O
判断正误(1)离子化合物中一定含有金属元素( )(2)由金属元素和非金属元素形成的化合物一定是离子化合物( )(3)第ⅠA、ⅡA族元素与第ⅥA、ⅦA族元素之间都能形成离子键( )(4)含有离子键的化合物一定是离子化合物( )(5)离子化合物中一定含有阴离子和阳离子,所以离子化合物一定能导电( )
A.a和c B.a和f C.d和g D.c和g
下列哪一组元素的原子间容易形成离子键( )
Y元素最高正价与最低负价的绝对值之差是4;Y元素与M元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物是( )A.KCl D.K2S
Y元素位于第ⅥA族且不是氧元素
离子键的三个“一定” 和两个“不一定”(1)三个“一定”①离子化合物中一定含有离子键;②含有离子键的物质一定是离子化合物;③离子化合物中一定含有阴离子和阳离子。(2)两个“不一定”①离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等;②含有金属元素的化合物不一定是离子化合物,如AlCl3。
化学反应中一般是原子的最外层电子发生变化,所以化学反应中需要表示出最外层电子的变化,那么用什么来表示呢?
1.定义在元素符号周围用“·”或“×”来表示原子的最外层电子(价电子)的式子叫做电子式。
例如:镁原子: ;碳原子: ;氧原子: ;氖原子: 。
2.书写(1)原子的电子式:元素符号周围标明元素原子的最外层电子,每个方向不能超过2个电子。当最外层电子数小于或等于4时以单电子分布,多于4时多出部分以电子对分布。
( 2 ) 离子的电子式:
① 简单阳离子的电子式
② 简单阴离子的电子式
一般用 表示
Na+、Li+、Mg2+、Al3+
氯离子: 硫离子:
简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子的符号表示
不但要画出最外层电子,而且还应用“[ ]”括起来,并在右上角标出“n-”以表示其所带的电荷。
水合氢离子 铵根离子
氢氧根离子 过氧根离子
③ 复杂阴、阳离子的电子式
复杂阴、阳离子要标明电子,用“[ ]”括上,并在“[ ]”右上角标明电性和电量。
(3)离子化合物的电子式:
②相同离子不能合并, 同性电荷不直接相邻
①由阴、阳离子的电子式组成
3.用电子式表示离子化合物的形成过程
用电子式表示氯化钠的形成过程
用电子式表示溴化镁(MgBr2)的形成过程
书写要点:①左侧写原子的电子式;②用弧形箭头表示电子转移的方向; ③中间用“―→”连接;④右侧写离子化合物的电子式。
书写电子式的注意事项(1)一个“·”或“×”代表一个电子,原子的电子式中“·”或“×”的个数即表示原子的最外层电子数。(2)同一原子的电子式不能既用“×”又用“·”表示。(3)“[ ]”在所有的阴离子、复杂的阳离子中出现。
书写电子式的注意事项
(4)在化合物中,如果有多个阴、阳离子,阴、阳离子必须是间隔的,即不能将两个阴离子或两个阳离子写在一起,如CaF2要写成 ,不能写成 ,也不能写成 。
(5)用电子式表示化合物形成过程时,由于不是化学方程式,不能出现“===”。“—→”前是原子的电子式,“—→”后是化合物的电子式。
下列电子式的书写正确的是( )A.氮原子: B.O2-:C.Na2O: D.CaCl2:
用电子式表示下列离子化合物的形成过程:(1)BaCl2:_____________________________________;(2)NaF:________________________;(3)MgS:__________________________;(4)K2O:_____________________________。
相关课件
这是一份人教版 (2019)第三节 化学键评课课件ppt,共19页。PPT课件主要包含了成键粒子,阴阳离子,成键本质,静电作用,离子键的形成,1原子,离子键,离子化合物,由离子键构成的化合物,离子键的应用等内容,欢迎下载使用。
这是一份高中人教版 (2019)第三节 金属的腐蚀与防护精品ppt课件,文件包含人教版高中化学选择性必修一431金属的腐蚀课件pptx、人教版高中化学选择性必修一431金属的腐蚀学案docx等2份课件配套教学资源,其中PPT共32页, 欢迎下载使用。
这是一份高中化学必修一 专题4.3.1 离子键,共17页。










