






人教版九年级下册课题 2 金属的化学性质教课ppt课件
展开上一节课我们学习金属的哪些化学性质?
2、金属与盐酸或稀硫酸反应
将铁钉投入到硫酸铜溶液中有何现象?
Fe + CuSO4==== Cu + FeSO4
活动性强的金属可以把活动性弱的金属从它的化合物溶液中置换出来。
铁钉表面有一层红色固体物质生成,溶液由蓝色变为浅绿色。
合作探究1 金属与金属化合物溶液的反应
说明铁的金属活动性比铜的强。
把一根用砂纸打磨过的的铝丝(Al)浸入硫酸铜( CuSO4 )溶液中,过一会儿取出,观察,有什么现象发生?把一根洁净的铜丝( Cu )浸入硝酸银( AgNO3 )溶液中,过一会儿取出,观察,有什么现象发生?把另一根洁净的铜丝( Cu )浸入硫酸铜( Al2(SO4)3 )溶液中,过一会儿取出,观察,有什么现象发生?
砂纸打磨目的:去除铝表面的氧化膜。
铝丝表面有红色固体出现
1.铝丝浸入硫酸铜溶液中
2.铜丝浸入硝酸银溶液中
铜丝表面有银白色固体出现
3.铜丝浸入硫酸铝溶液中无明显现象出现。
浸入溶液中的铝丝表面覆盖一层紫红色物质,溶液由蓝色逐渐变为无色。
浸入溶液中的铜丝表面覆盖一层银白色物质,溶液由无色逐渐变为蓝色。
2Al + 3CuSO4= Al2(SO4)3 + 3Cu
Cu +2AgNO3 =Cu(NO3)2 + 2Ag
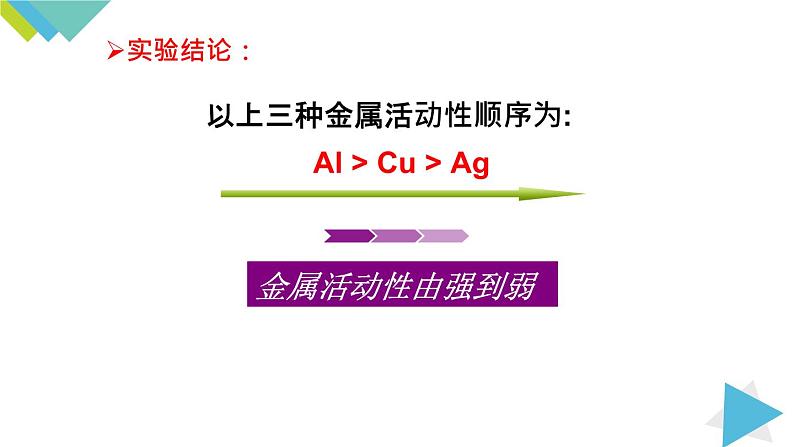
以上三种金属活动性顺序为:
Al > Cu > Ag
1.金属能与金属化合物溶液发生置换反应;2.活动性强的金属单质能与活动性弱的金属化合物溶液反应,反之不反应。
工人师傅在钢板上划线,钢板上会出现一条红色的线。使用的是下列哪种物质溶液?( ) A.ZnSO4 B.AgNO3 C.FeSO4 D.CuSO4
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
金属活动性顺序表的一些规律及运用:
1、用于判断金属活动性的强弱: 在金属活动性顺序表里,金属的位置越靠前,它的活动性越强,在溶液中越容易失去电子变成阳离子,化学性质越不稳定,越难被制取出来,被人类利用的时间越晚。
合作探究2 金属活动性顺序
2、用于判断金属与酸反应 在金属活动性顺序表里,位于氢前面的金属能置换出盐酸,稀硫酸中的氢。
(1) 酸应该是盐酸,稀硫酸;不能是浓硫酸、硝酸,这两种酸具强氧化性,导致发生的不是置换反应,生成物不是氢气。
(2) 在金属活动性顺序表里,尽量不要用钾、钙、钠与酸反应置换酸中的氢,因这三金属活动性太强,能与水直接反应。
3、用于判断金属与盐溶液反应 在金属活动性顺序表里,位于前面的金属能把位于后面的金属从它们的化合物的溶液里置换出来
铁与酸、铁与化合物溶液发生置换反应,生成亚铁化合物,溶液显浅绿色。
判断下列各组物质能否发生反应?(1)铜和硫酸锌溶液(2)锌和硫酸铜溶液(3)金和硫酸铜溶液(4)铁和氯化银
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
可否用铁桶盛放硫酸铜溶液?或者说:能否用铁桶配制农药波尔多液?(配制波尔多液时用到硫酸铜溶液)
Fe +CuSO4====Cu+FeSO4
2.金属在溶液中的活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb〔H〕Cu Hg Ag Pt Au
1.金属能与金属化合物溶液发生置换反应
1、判断下列置换反应能否发生,写出能发生反应的化学方程式。(1)银与盐酸( )__________________________。(2)铜与硝酸银溶液( )___________________________。(3)铁与稀硫酸( )___________________________。(4)铜与硫酸锌溶液( )_____________________。(5)铝与硝酸银溶液( )________________________。
Cu+2AgNO3===2Ag+Cu(NO3)2
Fe+H2SO4===FeSO4+H2↑
Al+3AgNO3===3Ag+Al(NO3) 3
2、“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理的是( ) ①比较硬度,硬度小的是“愚人金”②灼烧,表面变色的是“愚人金”③浸没在稀硫酸中,表面有气泡产生的是“愚人金”④浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”A.①③B.②④C.①④D.②③
3、分别把X、Y、Z三种金属加入稀盐酸中,只有Z表面无现象。Y加入X的硝酸盐溶液中,有X析出。则三种金属的活动性顺序是( )A.Y>X>Z B.X>Y>Z C.X>Z>Y D.Z>Y>X
07.微专题7 金属活动性顺序的验证与探究课件PPT: 这是一份07.微专题7 金属活动性顺序的验证与探究课件PPT,共18页。PPT课件主要包含了Fe>H>Cu,面无明显现象,氯化亚铁溶液,Fe>Cu,Zn>Cu>Ag,硝酸铜溶液,无明显现象,Fe>Cr>Cu,铬片表面有固体析出,溶液由浅绿色变为蓝色等内容,欢迎下载使用。
初中人教版课题 2 金属的化学性质公开课ppt课件: 这是一份初中人教版课题 2 金属的化学性质公开课ppt课件,共17页。PPT课件主要包含了学习目标,新课导入,蓝色溶液,浅绿色溶液,新知探究,无明显现象,铝与硫酸铜溶液反应,铜与硝酸银溶液反应,交流与讨论,金属活动性顺序等内容,欢迎下载使用。
中考化学复习考点六 金属的化学性质 金属活动性顺序课件: 这是一份中考化学复习考点六 金属的化学性质 金属活动性顺序课件,共60页。PPT课件主要包含了目录导航,课标与中考导航,考点过关,金属的化学性质,耀眼白光,火星四射,氢前面,导电性,H2氢气,AgNO3等内容,欢迎下载使用。













