
所属成套资源:2024枣庄滕州五中高二上学期10月月考试题及答案(九科)
2024滕州五中高二上学期10月月考化学试题无答案
展开
这是一份2024滕州五中高二上学期10月月考化学试题无答案,共43页。试卷主要包含了10等内容,欢迎下载使用。
命卷:甘宜磊 审核:吕广友 2023.10
第Ⅰ卷(共48分)
一、选择题:本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意。
1. 2020年11月10日,中国“奋斗者”号载人潜水器在马里亚纳海沟深度10909米处成功坐底并进行了一系列的深海探测科考活动。下列说法正确的是( )
A. “奋斗者”号使用的锂离子电池工作时向负极移动
B. 从海水中提取镁的过程属于物理变化
C. 电解从海水获得的饱和食盐水可制金属钠
D. 未来对海底“可燃冰”(主要成分为甲烷)的开采将有助于缓解能源危机
2. 下列关于电解槽的叙述中不正确的是( )
A. 与电源正极相连的是电解槽的阴极B. 与电源负极相连的是电解槽的阴极
C. 在电解槽的阳极发生氧化反应D. 电子从电源的负极沿导线流入阴极
3. “嫦娥五号”采用“比能量”达到的锂离子蓄电池储存由高效太阳能电池产生的电能。太阳能电池对锂离子蓄电池充电的整个过程中的能量转化形式是( )
A. 太阳能→电能B. 太阳能→电能→化学能
C. 化学能→太阳能→电能D. 太阳能→化学能→电能
4. 某单液电池如图所示,其反应原理为。下列说法正确的是( )
A. 右侧Pt电极为负极B. 左侧电极上发生还原反应
C. 溶液中向右侧电极移动D. 右侧电极的电极反应式为
5. 下列反应体系中,不属于可逆反应的是( )
A. 乙醇与乙酸的酯化反应B. 与反应
C. 工业合成氨D. 电池的充电与放电
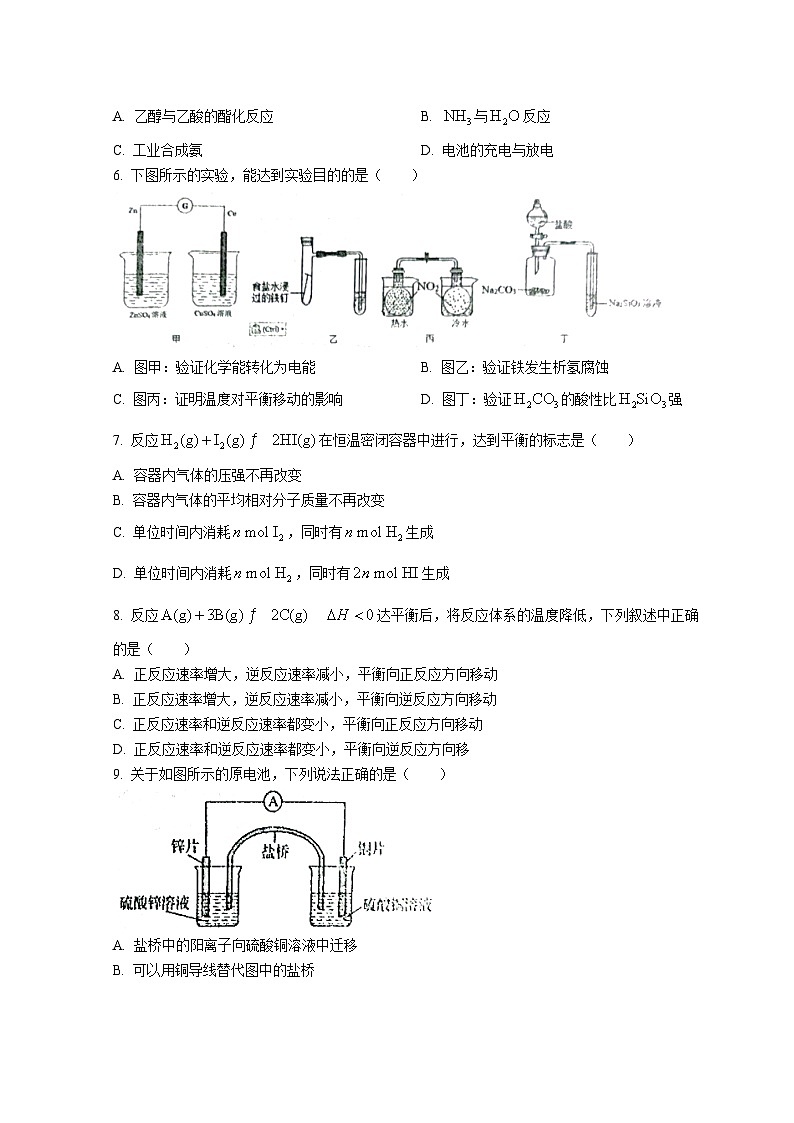
6. 下图所示的实验,能达到实验目的的是( )
A. 图甲:验证化学能转化为电能B. 图乙:验证铁发生析氢腐蚀
C. 图丙:证明温度对平衡移动的影响D. 图丁:验证的酸性比强
7. 反应在恒温密闭容器中进行,达到平衡的标志是( )
A. 容器内气体的压强不再改变
B. 容器内气体的平均相对分子质量不再改变
C. 单位时间内消耗,同时有生成
D. 单位时间内消耗,同时有生成
8. 反应 达平衡后,将反应体系的温度降低,下列叙述中正确的是( )
A. 正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B. 正反应速率增大,逆反应速率减小,平衡向逆反应方向移动
C. 正反应速率和逆反应速率都变小,平衡向正反应方向移动
D. 正反应速率和逆反应速率都变小,平衡向逆反应方向移
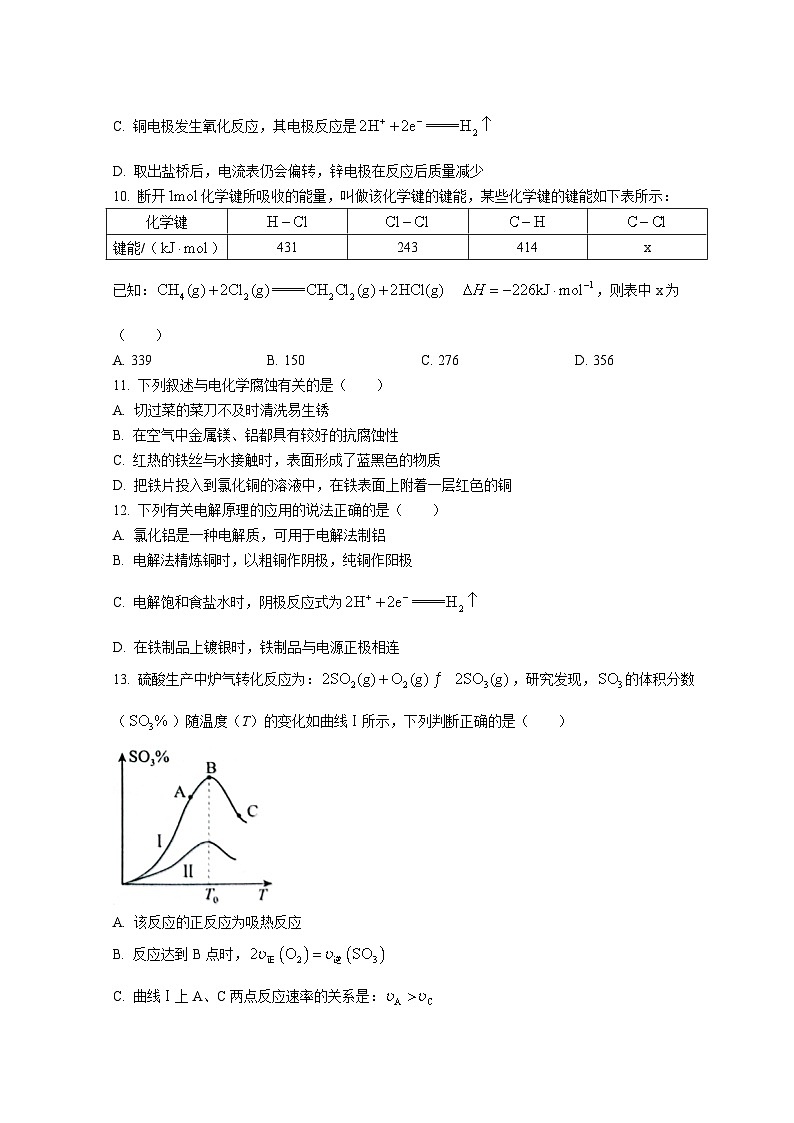
9. 关于如图所示的原电池,下列说法正确的是( )
A. 盐桥中的阳离子向硫酸铜溶液中迁移
B. 可以用铜导线替代图中的盐桥
C. 铜电极发生氧化反应,其电极反应是
D. 取出盐桥后,电流表仍会偏转,锌电极在反应后质量减少
10. 断开化学键所吸收的能量,叫做该化学键的键能,某些化学键的键能如下表所示:
已知: ,则表中x为( )
A. 339B. 150C. 276D. 356
11. 下列叙述与电化学腐蚀有关的是( )
A. 切过菜的菜刀不及时清洗易生锈
B. 在空气中金属镁、铝都具有较好的抗腐蚀性
C. 红热的铁丝与水接触时,表面形成了蓝黑色的物质
D. 把铁片投入到氯化铜的溶液中,在铁表面上附着一层红色的铜
12. 下列有关电解原理的应用的说法正确的是( )
A. 氯化铝是一种电解质,可用于电解法制铝
B. 电解法精炼铜时,以粗铜作阴极,纯铜作阳极
C. 电解饱和食盐水时,阴极反应式为
D. 在铁制品上镀银时,铁制品与电源正极相连
13. 硫酸生产中炉气转化反应为:,研究发现,的体积分数()随温度(T)的变化如曲线Ⅰ所示,下列判断正确的是( )
A. 该反应的正反应为吸热反应
B. 反应达到B点时,
C. 曲线Ⅰ上A、C两点反应速率的关系是:
D. 已知的催化效果比好,若Ⅰ表示用催化剂,则Ⅱ是作催化剂
14. 某温度下,在密闭容器中发生反应,反应达到平衡后将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡时的2.5倍,下列说法正确的是( )
A. 化学平衡逆向移动B. A的平衡转化率增大C. 平衡常数变大D.
15. 关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节诱发关节疼痛,其化学机理为:①;②,下列对反应②的叙述中正确的是( )
A. 反应的B. 降低温度,平衡向逆反应方向移动
C. 反应的D. 升高温度,平衡向正反应方向移动
16. 一定温度下体积10L的密闭容器中,和进行反应:,经2min达到平衡,生成,下列说法正确的是( )
A. 以X浓度变化表示的反应速率为
B. 将容器体积变为20L,Z的平衡浓度为原来的
C. 若增大压强,则物质Y的转化率减小
D. 若升高温度,X的体积分数增大,则该反应是放热反应
第Ⅱ卷(共52分)
二、填空题
17.(1)单质碘可与氢气反应生成碘化氢。将物质的量比为的氢气和碘蒸气放入密闭容器中进行反应:,反应经过5分钟测得碘化氢的浓度为,碘蒸气的浓度为。
前5分钟平均反应速率______,的初始浓度是______。
(2)某小组同学在室温下进行“碘钟实验”:将浓度均为的、、KI、溶液及淀粉混合,一定时间后溶液变为蓝色。
已知:“碘钟实验”的总反应的离子方程式为
反应分两步进行:
反应A:……反应B:
①反应A的离子方程式是____________。
对于总反应,的作用是____________。
②探究溶液变蓝快慢的影响因素,实验Ⅰ、Ⅱ。(溶液浓度均为)
溶液从混合时的无色变为蓝色的时间:实验Ⅰ是30min、实验Ⅱ是40min。实验Ⅱ中,x、y、z所对成的数值分别是______、______、______;
对比实验Ⅰ、Ⅱ,可得出的实验结论是____________。
18. 研究、、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)已知:
①请写出与反应生成和NO的热化学方程式____________。
②一定条件下,将与以体积比置于2L密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。(填字母序号)
a. 体系压强保持不变b. 混合气体颜色保持不变
c. 和NO的体积比保持不变d. 每消耗的同时生成
(2)工业上一般以CO和为原料合成甲醇。
该反应的热化学方程式为: ,则反应物的总能量______(填高于、低于或者等于)生成物的总能量。
在恒温条件下体积为2L的密闭容器中,将与的混合气体在催化剂作用下发生反应生成甲醇。2min时制得生成,则0~2min的平均反应速率______,CO的转化率为______,反应前后的压强比为______。
19. 按下图装置进行实验,并回答下列问题:
(1)判断装置的名称:A池为______,B池为______。
(2)铜极为______极,电极反应式为____________,
石墨棒为______极,电极反应式为____________,
石墨棒附近发生的实验现象为____________。
(3)当极析出224mL气体(标准状态时),锌的质量______(增加或减少)了______g,溶液的质量______(增加或减少)了______g。
20. Ⅰ. 汽车尾气中NO生成过程的能量变化如图甲所示。和完全反应生成NO会______(填“吸收”或“放出”)______kJ能量。
Ⅱ. 用和组合形成的质子交换膜燃料电池的结构示意图如下图所示:
电池总反应为,则c电极是______(填“正极”或“负极”),d电极的电极反应式:____________。
若线路中转移2ml电子,则上述燃料电池消耗的在标准状况下的体积为______L。
Ⅲ. 甲醇是重要的化学工业基础原料和清洁液体燃料。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如表所示。
(1)据反应①与②可推导出、与之间的关系,则______(用、表示)。
(2)时测得反应③在某时刻、、、的浓度相等,且均为,则此时______(填“>”“=”或“<”)。
(3)某温度下在2L恒容容器中加入发生反应,测得有关数据如表。
①反应在2min内以表示的化学反应速率为____________。
②该温度下的反应的平衡常数为____________。
化学键
键能/()
431
243
414
x
用量试剂
溶液
溶液
溶液
KI溶液(含淀粉)
实验Ⅰ
5
4
8
3
0
实验Ⅱ
5
2
x
y
z
化学反应
平衡常数
温度/
500
800
①
2.5
0.15
②
1.0
2.5
③
反应时间/min
0
1
2
3
4
1.02
0.42
0.22
0.22
0.22
相关试卷
这是一份2024枣庄滕州高二上学期期末考试化学试题,共31页。试卷主要包含了考试结束,监考人员将答题卡收回等内容,欢迎下载使用。
这是一份2024南京九中高二上学期10月月考化学试题无答案,共9页。试卷主要包含了本试卷包括单项选择题两部分,实验室制取少量并探究其性质,下列化学反应表示正确的是,下列有关说法正确的是等内容,欢迎下载使用。
这是一份2024固原五中高三上学期第一次月考化学试题扫描版无答案,文件包含固原五中2023-2024学年上高三化学第一次月考化学试卷1pdf、固原五中2023-2024学年上高三第一次月考化学答题卡1pdf等2份试卷配套教学资源,其中试卷共4页, 欢迎下载使用。









