《课题2 酸和碱的中和反应》教学设计1-九年级下册化学人教版
展开校公开课 第十单元课题2 酸和碱的中和反应(第1课时)教学设计
课题 | 酸和碱的中和反应 | 单元 | 第十单元 | 课型 | 新授课 | ||||
教学 目标
| 显性教学目标:
隐性教学目标(与显性教学目标相对应):
| ||||||||
教材 分析 | 本单元教材从生活和实验室中常见的酸和碱出发,介绍了几种常见酸和碱的性质及用途,并说明酸和碱各有其相似性质的原因,在此基础上,进一步介绍了酸和碱的中和反应及其在实际中的应用、溶液的酸碱度等。 本课题教材内容呈现的顺序是:验证酸碱发生反应(实验)——酸碱反应微观本质——酸碱反应化学方程式——中和反应(含“盐”的概念)——中和反应的实际应用。本课题的教学内容,教材没有穿插安排在酸的化学性质或碱的化学性质中,单独列为一个课题,其目的是:通过核心概念“中和反应”的形成,完善学生运用所学知识验证没有明显现象反应的实验设计能力,完善学生完成这类实验设计的思维模型建构,优化实验方案,培养学生基于实证、运用知识从定性到定量分析问题解决问题的能力,进一步发展学生科学探究的能力和水平层级;从酸碱反应的宏观现象到原子水平上的反应过程模型建构,再到中和反应化学方程式的书写,旨在帮助学生建立起“宏观-微观-符号”三维表征的化学思维;从盐酸和氢氧化钠类推到其他酸碱反应,帮助学生学会从个别到一般,从具体到类属的研究物质性质的学习方法;中和反应在生产生活中的实际应用,旨在帮助学生理论联系实际,从化学走进生活,学以致用,了解化学的学习价值,帮助学生形成正确的结构观(结构-性质-用途)。 教材显性的教学内容是:验证盐酸和氢氧化钠反应的实验操作及技能;盐酸和氢氧化钠反应过程的微观模型理解;中和反应的概念、化学方程式的书写及中和反应的实际应用。教材隐性的教学内容是:培养学生的科学探究能力;发展学生结构决定性质,性质决定用途的结构观;建立“宏-微-符”三重表征认识化学反应的思维视角;完善学生研究化学反应定性到定量的意识。其中,对于没有明显现象的反应如何设计实验进行验证,优化实验方案,进行实验,建立起结论、观点和现象之间的逻辑推理关系,是教材隐性内容的难点,是学生面临的难题,也是本课的重点。 酸和碱的中和反应在中学化学学习过程中起着承前启后的重要作用。为十二单元盐类的性质、用途及高中选修4中和滴定作铺垫。
| ||||||||
学情 分析 | 本课之前,溶液酸碱度的测试方法——pH试纸的使用,已经整合到本单元酸碱指示剂变色的教学部分,盐的概念在第八单元学习金属化学性质时已经提及。即学生已经具有了常见酸碱的性质、构成、用途、酸碱指示剂的变色规律、pH试纸的使用、盐的概念等知识储备;学会了一些化学实验基本操作,会用对比的方法设计实验,并对获得的信息用归纳、概括的方法进行加工。 此外,学习本课之前,学生也曾遇到无明显现象的反应,如:二氧化碳和氢氧化钠溶液的反应,学生初步具有借助转换思想验证发生反应的意识,但尚未形成思路和模型,如何设计实验、建构原子水平上的化学变化过程模型以及符号表征(化学方程式)可能是学生本课学习的障碍,也是本课学习的重难点。
| ||||||||
教学重点 | 设计实验优化方案,完成实验:探究酸碱能否发生反应。 | ||||||||
教学难点 | 设计实验验证酸碱发生反应的逻辑推理;建构原子水平上认识中和反应的微观模型。 | ||||||||
实验仪器 用品 | NaOH、HCl、酚酞、温度计、烧杯、玻璃棒、镊子、酒精灯、火柴、滴管、Zn、碳酸钠溶液、pH试纸、标准比色卡 | ||||||||
教学环境 | 多媒体支持 PPT 动画播放 实物展台 | ||||||||
教学方法 | 问题导学 模型建构 实验探究 | ||||||||
学习方法 | 自主学习、合作学习、探究学习 | ||||||||
学习流程 | 学习过程 学习方法 设计意图
| ||||||||
教学程序设计 | |||||||||
| |||||||||
教学环节 | 教师活动 | 信息技术使用 | 学生活动 | 设计意图 | |||||
环节1 导入新课 展示目标 | 展示图片:药品“斯达舒”说明书 引导学生结合说明书中“用于缓解胃酸过多”和“每片含氢氧化钠140mg”的信息,提出研究问题或猜想假设。
展示本课的研究问题和学习目标
|
| 观看图片;一学生念说明书
猜想:氢氧化铝可能会与胃中的盐酸反应 问题:酸与碱会发生反应吗?
观看、思考本节课要学什么
| 创造真实情境,从生活走向化学,从“斯达舒”药品说明书中提炼出本课的研究问题,探究始于有研究价值的问题。
让学生明确本课学习目标,教学从此出发。 | |||||
环节2 酸与碱能否发生反应 |
每小组两名成员分享,一名讲方案,一名讲该方案优缺点。
4.引导学生对实验过程及结果进行反思评价
|
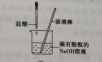
①往混合液中 加氯化铁溶液 ;另一个不滴盐酸,加氯化铁溶液,比较两者生成沉淀质量的多少。
②利用反应 放热
③(HCl+石蕊)+NaOH
④(NaOH+石蕊)+HCl
⑤(HCl+酚酞)+NaOH
PPT呈现实验步骤及内容 |
汇报实验现象
6个小组汇报实验方案及优缺点①优点:现象明显;缺点:操作复杂
②缺点:氢氧化钠固体溶于水放热会对实验结果造成干扰 ③优点:石蕊遇酸碱变色效果明显 ④优点:操作简单;缺点:石蕊本身有颜色,现象可能会不明显 ⑤优点:色差明显; ⑥优点:变色单一;缺点:溶液由红色褪成无色,无法确定是否恰好中和 自评、组评、师评方案优缺点,优化实验方案
分组实验,书写报告。汇报交流, 分组实验:取样,在褪色后的溶液中,反滴氢氧化钠溶液。 对实验操作及结果进行反思评价
| 造成认知冲突,激发学生探究欲,设计实验验证没有明显现象的酸碱反应。 课前布置小组讨论设计盐酸与氢氧化钠能否发生反应的实验方案及自评方案优缺点,节约上课时间,小组分享、 自评、组评、师评,实现师生、生生之间的平等对话,构建润泽的教室,打造学习共同体,在思维碰撞中优化实验方案。
学生分组,在体验中切身感受,在反思交流中主动建构验证酸碱能发生反应的路径(反应物减少或消失或验证生成物),反思实验过程及结果(玻璃棒上的白色固体),形成基于实证的推理,培养控制实验条件(盐酸滴过量)就能控制化学反应的意识,培养从定性到定量的研究方法和思想。 | |||||
环节3 酸与碱发生了什么反应(为什么会发生反应)
| 提出问题:1.HCl+NaOH是如何发生反应的?原子水平上的化学变化过程模型是怎样的? 引导学生观察反应前后变化的粒子是什么?不变的粒子是什么?
引出中和反应的概念
|
展示图片: 播放盐酸与氢氧化钠反应的微观模拟动画
实物投影:学生书写的化学方程式 |
分析汇报盐酸与氢氧化钠反应的微观本质
书写化学方程式:HCl+NaOH H2SO4+NaOH HCl+Ca(OH)2 反馈矫正,总结规律 齐读课本:P61中和反应的定义两遍
| 从宏观事实和现象到微观辨析再到符号表征,引导学生从宏-微-符三重表征认识中和反应。 从盐酸和氢氧化钠反应的微观本质,类推到其他酸碱也能发生类似反应,从个别到一般,从具体到类属,引导学生掌握类属迁移、归纳规律研究物质性质的学习方法。 | |||||
环节4 中和反应 有何实际应用 | 提出问题: “斯达舒”药品中的氢氧化铝起什么作用?能用化学方程式表示吗?中和反应在生产生活中还有何实际应用呢? 板书: | 实物投影:学生书写的化学方程式: HCl+Al(OH)3=
PPT播放:小组预习成果—中和反应的应用 | 书写化学方程式 反馈订正
小组汇报预习成果
观看,思考 | 前后呼应,学以致用,运用所学知识会分析解决实际问题。 遵循学生自己学会的知识,课堂上不再赘述,把学习的主动权交给学生。 把本课的核心知识留给学生,加深印象和内化。 | |||||
环节5 分享收获 达标检测
|
小结本课内容,提升学科思想:结构性质用途三者之间的对应关系 布置当堂检测任务 | PPT呈现
| 学生分享交流
达标检测,自主学习(写学案)
| 总结提升, 素养内化
反馈结果 优化教学 | |||||
作业布置 |
布置作业2题 |
| 作业见学生学案。 实验(看时间情况)当堂验证或家庭作业
| 作业只有2题,课堂生成资源使用(实验后的混合液呈酸性还是中性),教学留白,促进学生主动思考和学习,最后1题设计是考查学生对恰好中和的判断,从化学方程式角度定量认识化学反应的升华。 | |||||
板书设计 | |||||||||
课题2 酸和碱的中和反应 | |||||||||
1.定义 酸+碱 =盐+水 2.热效应:放热 3.实质 H++OH- = H2O 4.应用 | |||||||||
教后反思: 以前我也曾经选择本课题上过公开课,不同的是,这次是在国家倡导“立德树人”和培养学生学科核心素养的大背景下,我站在培养学生化学核心素养的维度重新审视教材文本,通过重新梳理教材文本的显性知识(知识技能和方法),挖掘其背后的隐性知识(学科思维、观点和思想),站在整个单元乃至中学化学的层面重新审视教材编写本课题的主旨和意图,对本课的教学重点和难点重新进行定位和分配,对学生学习可能出现的障碍和盲点进行预设,确定教学策略和方法。教学中成功的地方在于:从化学走进生活,基于真实情境,提出研究问题,把问题转化成学习目标,三个问题的顺序呈现反映学生认识的层级由低到高(是什么-为什么-怎么用)的螺旋上升;打造学习共同体(小组),小组分享、反思评价,实现师生、生生之间的平等对话,力图通过合作学习实现共同进步,让每一个生命发挥意义,营造润泽的教室;发展学生科学探究能力,建构“宏-微-符”化学思维视角和结构观,体验定性到定量研究方法的过程,发展了学生的学科核心素养。 教学即研究,教学即创造。本课虽然执教过20年,反思此课,教学中仍然留下了许多遗憾,感到有点痛心。突出的问题是发挥学生主体与教学时间的矛盾,6个小组分享实验方案、反思优缺点、优化实验方案、完成分组实验、汇报实验结果使用21分钟,在后续反思实验过程和结果环节包括学生书写学案环节,教师唯恐完不成本课教学任务,思维受教学时间所限的牵绊,没有更多地安排小组讨论的部分,教师的教学思想(打造学习共同体,组内、组间互相学习)未能充分地在课堂予以贯彻,受此影响,教师原来设计的本课最后结构观的建立,教师没有点出,留下了教学遗憾!
追求教学的艺术永远在路上,“虽不能至,然心向往之。” | |||||||||