

人教版 (2019)必修 第一册第二节 氯及其化合物导学案
展开素养要求
1.能从原子结构的角度认识氯元素是一种很活泼的非金属元素,其单质具有强氧化性。
2.通过实验探究氯气的化学性质,掌握氯气与金属单质、非金属单质及水的反应,促进“科学探究”化学核心素养的发展。
3.熟知氯气与碱的反应,漂白粉的主要成分、漂白原理及保存方法。
分点突破一 氯气的物理性质
1.氯元素的原子结构及存在
2.氯气的物理性质
在低温和加压条件下可以转化为液态,称为液氯。
闻气味的方法:在瓶口用手轻轻扇动,仅使少量气体飘进鼻孔
[即学即练]
1.判断正误,正确的打“√”,错误的打“×”
(1)虽然氯气有毒,但仍可闻氯气的气味。( )
(2)收集氯气时,可根据集气瓶内是否充满黄绿色气体来判断是否收集满。( )
(3)充满氯气的塑料矿泉水瓶中加入20 mL水,盖好瓶盖,用力振荡,矿泉水瓶会变瘪。( )
(4)氯气的密度比空气大,常用向上排空气法收集氯气,也可用排水法收集。( )
2.下列说法正确的是( )
A.用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味
B.用向下排空气法可以收集到纯净的氯气
C.贮氯罐意外泄漏,应沿逆风方向疏散群众
D.氯气车间液氯泄漏时,应弯腰逃离氯气泄漏区域
3.氯气可用于消灭田鼠,为此,可将氯气用软管通入田鼠洞中,这是利用了氯气下列性质中的________(填序号)。
①黄绿色 ②密度比空气大 ③有毒 ④易液化
⑤可溶于水
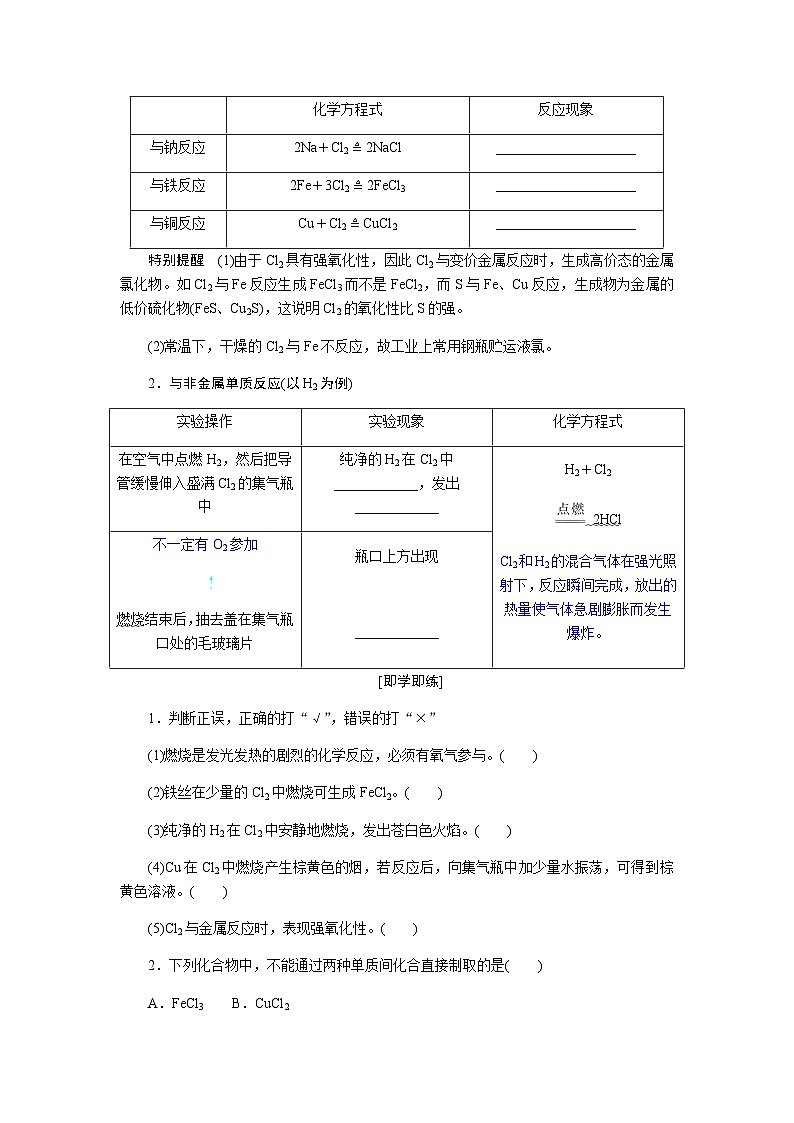
分点突破二 氯气的化学性质——与金属、非金属单质的反应
1.与金属单质反应
特别提醒 (1)由于Cl2具有强氧化性,因此Cl2与变价金属反应时,生成高价态的金属氯化物。如Cl2与Fe反应生成FeCl3而不是FeCl2,而S与Fe、Cu反应,生成物为金属的低价硫化物(FeS、Cu2S),这说明Cl2的氧化性比S的强。
(2)常温下,干燥的Cl2与Fe不反应,故工业上常用钢瓶贮运液氯。
2.与非金属单质反应(以H2为例)
[即学即练]
1.判断正误,正确的打“√”,错误的打“×”
(1)燃烧是发光发热的剧烈的化学反应,必须有氧气参与。( )
(2)铁丝在少量的Cl2中燃烧可生成FeCl2。( )
(3)纯净的H2在Cl2中安静地燃烧,发出苍白色火焰。( )
(4)Cu在Cl2中燃烧产生棕黄色的烟,若反应后,向集气瓶中加少量水振荡,可得到棕黄色溶液。( )
(5)Cl2与金属反应时,表现强氧化性。( )
2.下列化合物中,不能通过两种单质间化合直接制取的是( )
A.FeCl3 B.CuCl2
C.HCl D.FeCl2
3.下列关于氯气的叙述正确的是( )
A.钠在氯气中燃烧产生白烟
B.红热的铜丝在氯气中燃烧生成CuCl
C.纯净的氢气可以在氯气中安静地燃烧,发出淡蓝色火焰
D.氯气的水溶液可以导电,说明氯气是电解质
分点突破三 氯气的化学性质——与水、碱的反应
1.氯气与水的反应
(1)新制的氯水能杀菌、消毒,是因为溶于水的部分氯气与水发生反应,生成了具有强氧化性的次氯酸,化学方程式为________________________________________________________________________
________________________________________________________________________。
(2)新型自来水消毒剂:二氧化氯(ClO2)、臭氧等。
2.实验探究氯水的漂白性
3.次氯酸的性质
特别提醒
1.氯水的成分
氯水中存在反应:Cl2+H2O⇌HCl+HClO,HClO和HCl发生电离。氯水中含有以下微粒(OH-来自水的电离,量极少):
2.氯水的性质
4.与氢氧化钠溶液反应——制取漂白液
(1)反应的化学方程式:___________________________________________________
________________________________________________________________________。
(2)漂白液的有效成分是________。
5.与石灰乳反应——制取漂白粉
(1)反应的化学方程式:_____________________________________________________
________________________________________________________________________。
(2)漂白粉的主要成分是________________,有效成分是________,漂粉精的主要成分是________。
(3)漂白粉的漂白原理:利用复分解反应原理,漂白粉中的________与酸(如盐酸或碳酸等)反应生成具有漂白性的________。
化学方程式为Ca(ClO)2+CO2+H2O===________________________(家用漂白消毒)。
Ca(ClO)2+2HCl===________________(工业漂白)。
(4)漂白粉的保存及应用
漂白粉应________、________保存,并置于________干燥处。
漂白液、漂白粉和漂粉精既可作漂白棉、麻、纸张的________,又可用作游泳池等场所的________。
特别提醒 (1)Cl2与碱溶液的反应中,Cl2既是氧化剂又是还原剂。
(2)NaClO比HClO稳定得多,它的水溶液在低温下存放三年才分解一半左右。
[即学即练]
1.判断正误,正确的打“√”,错误的打“×”
(1)Cl2与H2O反应的离子方程式为
Cl2+H2O===2H++Cl-+ClO-。( )
(2)氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物。( )
(3)Cl2具有很强的氧化性,在化学反应中只能作氧化剂。( )
(4)氯水能漂白纸张,故氯气具有漂白性。( )
(5)可以用pH试纸测定氯水的pH。( )
(6)漂白粉的有效成分是Ca(ClO)2和CaCl2。( )
2.下列关于氯水的说法正确的是( )
A.新制氯水应保存在无色试剂瓶中
B.氯水放置数天后酸性增强
C.将氯水滴在pH试纸上,试纸一定显红色,因为氯水中含有HCl
D.光照新制氯水有气体逸出,该气体是Cl2
3.下列说法正确的是( )
A.漂白粉是纯净物,“84”消毒液是混合物,两者都能长期保存
B.漂白粉中含有次氯酸,所以漂白粉能使有机色质褪色
C.工业上将氯气通入澄清石灰水中制取漂白粉
D.漂白粉在空气中容易失效的原因是Ca(ClO)2与CO2、H2O反应生成的HClO不稳定
4.Cl2是一种重要的化工原料,下图是一些含氯产品:
(1)①中钢瓶上应贴的标签为________。
A.腐蚀品 B.爆炸品
C.有毒品 D.易燃品
(2)下列有关漂白粉和“84”消毒液的说法正确的是________。
A.漂白粉是纯净物,“84”消毒液是混合物
B.漂白粉的有效成分是Ca(ClO)2
C.工业上将氯气通入澄清石灰水制取漂白粉
D.“84”消毒液的有效成分是Na2O2
(3)Cl2可用于制盐酸,其化学方程式为________________________________________________________________________
________________________________________________________________________。
(4)工业上制漂白粉的化学方程式为________________________________________________________________________
________________________________________________________________________。
1.生活中难免会遇到一些突发事件,我们要善于利用学过的知识,采取科学、有效的方法保护自己。如果发生了氯气泄漏,以下自救得当的是( )
A.用湿毛巾或蘸有肥皂水的毛巾捂住口鼻撤退
B.向地势低的地方撤离
C.观察风向,顺风撤离
D.在室内放一盆水
2.下列物质不能使有色布条褪色的是( )
A.CaCl2溶液 B.NaClO溶液
C.漂白粉溶液 D.氯水
3.下列说法正确的是( )
A.实验室用排水法收集氯气
B.闻氯气气味时,用手轻轻在集气瓶口扇动,使极少量氯气飘进鼻孔
C.Cl-和Cl2均有毒
D.Cl-和Cl2均呈黄绿色
4.下列有关氯气的叙述中不正确的是( )
A.金属钠可在氯气中剧烈燃烧
B.通常状况下,干燥的氯气能与铁反应
C.光照氯气和氢气的混合物会发生爆炸
D.氯气与水反应生成盐酸和次氯酸
5.用玻璃棒蘸取新制氯水滴在蓝色石蕊试纸中部,观察到的现象是( )
6.氯水中含有多种成分,因而具有多种性质,根据如图新制氯水分别与四种物质发生的反应填空(a、b、c、d、e代表各物质与氯水的反应,且氯水足量)。
(1)e过程中发生的主要反应的化学方程式为
________________________________________________________________________。
(2)实验室保存饱和氯水的方法是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
第1课时 氯气的性质
分点突破一 氯气的物理性质
1.得到1个电子 强氧化性 成盐 NaCl MgCl2 CaCl2 海水 化合态
2.黄绿 气体 刺激性气味 有毒 2 大
即学即练
1.答案:(1)√ (2)√ (3)√ (4)×
2.答案:C
3.答案:②③
分点突破二 氯气的化学性质——与金属、非金属单质的反应
1.产生大量白烟 产生大量棕红色烟 产生大量棕黄色烟
2.安静地燃烧 苍白色火焰 白雾
即学即练
1.答案:(1)× (2)× (3)√ (4)× (5)√
2.答案:D
3.答案:A
分点突破三 氯气的化学性质——与水、碱的反应
1.(1)Cl2+H2O⇌HCl+HClO
2.不褪色 干燥的氯气不具有漂白性 褪色 褪色 湿润的氯气具有漂白性 次氯酸
3.碳酸 2HClO 2HCl+O2↑
4.(1)Cl2+2NaOH===NaCl+NaClO+H2O (2)次氯酸钠
5.(1)2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O 2CaCl2、Ca(ClO)2 Ca(ClO)2 Ca(ClO)2 (3)次氯酸钙 次氯酸 CaCO3↓+2HClO CaCl2↓+2HClO (4)密封 避光 阴凉 漂白剂 消毒剂
即学即练
1.答案:(1)× (2)× (3)× (4)× (5)× (6)×
2.答案:B
3.答案:D
4.解析:贮存Cl2的钢瓶应贴有有毒气体的标志;“84”消毒液的有效成分是NaClO。
答案:(1)C (2)B
(3)H2+Cl2 2HCl
(4)2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
随堂演练全通关
1.解析:因肥皂水显弱碱性,可以吸收氯气,A正确;氯气的密度大于空气,故应向地势高的地方撤离,B错误;逆风撤离,才可以脱离氯气的笼罩,C错误;氯气能与水反应,但速度慢且反应不充分,D错误。
答案:A
2.解析:漂白粉中含有Ca(ClO)2,NaClO、Ca(ClO)2与CO2和H2O反应可生成HClO,氯水中含有HClO,故氯水、NaClO溶液、漂白粉溶液均能使有色布色褪色。
答案:A
3.答案:B
4.答案:B
5.解析:氯水中的H+能使蓝色石蕊试纸变红,氯水中的HClO能使之褪色,使蘸到的中间部分变为白色,四周仍有一圈红色。
答案:B
6.解析:(1)氯水中含有Cl2,Cl2与氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的化学方程式为Cl2+2NaOH===NaCl+NaClO+H2O。(2)因为HClO不稳定,光照下易分解,所以实验室保存饱和氯水的方法是盛放在棕色试剂瓶中密封保存,并置于阴凉处。
答案:(1)Cl2+2NaOH===NaCl+NaClO+H2O
(2)盛放在棕色试剂瓶中密封保存,并置于阴凉处
颜色
状态
气味
毒性
溶解性
密度
____
色
____
____
____
1体积的水可溶解约________体积的氯气
比空气
________
化学方程式
反应现象
与钠反应
2Na+Cl2≜2NaCl
____________________
与铁反应
2Fe+3Cl2≜2FeCl3
____________________
与铜反应
Cu+Cl2≜CuCl2
____________________
实验操作
实验现象
化学方程式
在空气中点燃H2,然后把导管缓慢伸入盛满Cl2的集气瓶中
纯净的H2在Cl2中____________,发出____________
H2+Cl2
2HCl
Cl2和H2的混合气体在强光照射下,反应瞬间完成,放出的热量使气体急剧膨胀而发生爆炸。
不一定有O2参加
燃烧结束后,抽去盖在集气瓶口处的毛玻璃片
瓶口上方出现
____________
实验操作
实验现象
解释
有色布条
________________
________________
有色布条
________________
湿润的氯气
具有漂白性
有色鲜花
________________
________________
结论
氯气不具有漂白性,________具有漂白性
化学性质
性质的体现或用途
弱酸性
酸性很弱,比________还弱,只存在于水溶液中
稳定性
不稳定,见光易分解,化学方程式为________________________________________________________________________
强氧化性
①能杀死水中的病菌,起到消毒的作用
②能使某些染料和有机色素褪色,可用作棉、麻和纸张的漂白剂
人教版 (2019)必修 第一册第二节 氯及其化合物学案: 这是一份人教版 (2019)必修 第一册第二节 氯及其化合物学案,共3页。学案主要包含了氯气的物理性质等内容,欢迎下载使用。
鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应学案: 这是一份鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应学案,共17页。学案主要包含了电解质的电离,电解质的分类及电离的应用等内容,欢迎下载使用。
苏教版 (2019)必修 第一册第一单元 氯气及氯的化合物学案设计: 这是一份苏教版 (2019)必修 第一册第一单元 氯气及氯的化合物学案设计,共13页。













