





高中化学鲁科版 (2019)必修 第一册第3节 化学中常用的物理量——物质的量授课ppt课件
展开
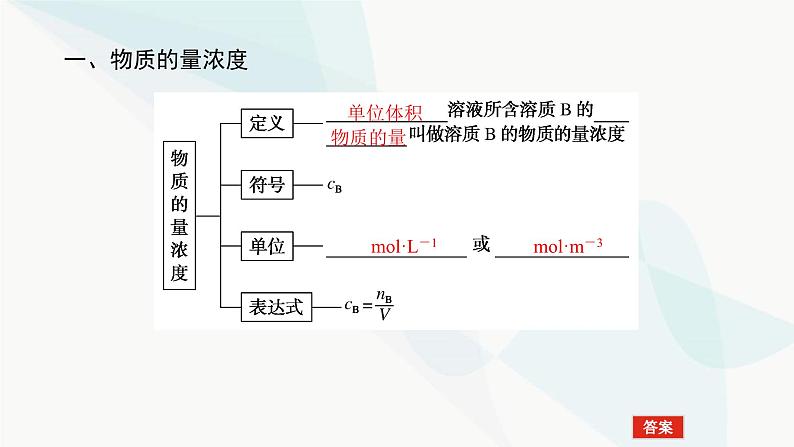
这是一份高中化学鲁科版 (2019)必修 第一册第3节 化学中常用的物理量——物质的量授课ppt课件,共60页。PPT课件主要包含了知识网络,学业基础,物质的量浓度,单位体积,物质的量,mol·L-1,mol·m-3,408×1022,核心素养,①③⑤等内容,欢迎下载使用。
学业要求1.通过“活动·探究”栏目的活动,了解一定体积的物质的量浓度溶液的配制,养成宏观辨识与微观探析的化学学科核心素养。2.了解物质的量浓度的含义,掌握溶液的体积、物质的量浓度和溶质的物质的量之间的转化关系,形成证据推理和模型认知的化学核心素养。3.通过“交流·研讨”栏目的活动,从物质的量的角度认识化学反应,体会定量研究对化学科学的重要作用,形成科学态度与社会责任的化学核心素养。
2.交流思考(1)1 L 1 ml·L-1 NaCl溶液,从中各取出100 mL和10 mL,则取出溶液中溶质物质的量浓度分别为 、 ;所含溶质的物质的量分别为 、 。(2)①62 g Na2O溶于水配成1 L溶液,溶质的物质的量浓度为 。②250 g胆矾溶于水得到1 L溶液,所得CuSO4溶液中溶质的物质的量浓度为 。③0.3 ml·L-1 Na2SO4溶液中Na+的浓度与0.3 ml·L-1 NaCl溶液中Na+的浓度 (填 “相等”或“不相等”)。④100 mL 0.2 ml·L-1H2SO4溶液中含H2SO4 ml,含H+ __________个。
3.1 ml·L-1葡萄糖(C6H12O6,M=180 g·ml-1)溶液的含义是( )A.含有1 ml葡萄糖B.1 L H2O中溶有1 ml葡萄糖C.含有180 g葡萄糖D.1 L葡萄糖溶液中含有1 ml葡萄糖
解析:1 ml·L-1葡萄糖溶液的含义是1 L葡萄糖溶液中含有1 ml葡萄糖,故选D。
4.下列与100 mL 0.1 ml·L-1 Na2CO3溶液中Na+的物质的量浓度相同的是( )A.1 ml·L-1 Na2SO3溶液10 mLB.0.2 ml·L-1 NaCl溶液50 mLC.0.2 ml·L-1 Na2SO4溶液 10 mLD.0.1 ml·L-1 NaNO3溶液 200 mL
解析:0.1 ml·L-1 Na2CO3溶液中Na+的物质的量浓度为0.2 ml·L-1。1 ml·L-1 Na2SO3溶液中Na+的物质的量浓度是2 ml·L-1,A不符合题意;0.2 ml·L-1 NaCl溶液中Na+的物质的量浓度是0.2 ml·L-1,B符合题意;0,2 ml·L-1 Na2SO4溶液中Na+的物质的量浓度是0.4 ml·L-1,C不符合题意;0.1 ml·L-1 NaNO3溶液中Na+的物质的量浓度是0.1 ml·L-1,D不符合题意。
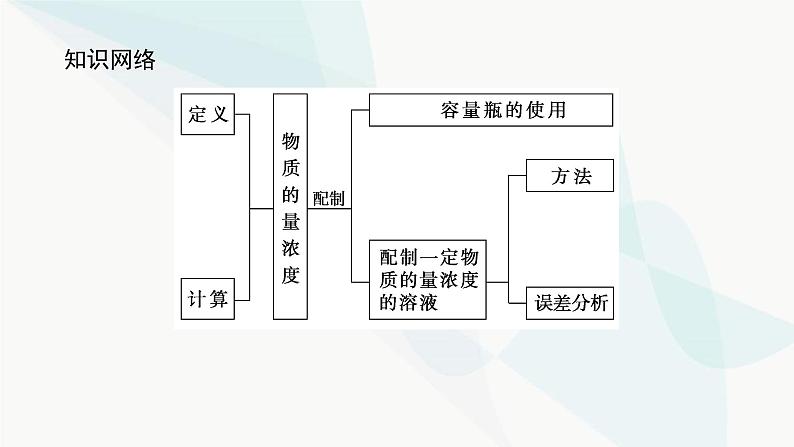
二、配制一定物质的量浓度的溶液1.配制一定物质的量浓度溶液专用仪器——容量瓶(1)容量瓶的结构与规格
100 mL、250 mL、500 mL、1 000 mL
(2)容量瓶的使用注意事项①使用前要检查容量瓶是否漏水。②选择容量瓶应遵循“大而近”的原则:所配溶液的体积等于或略小于容量瓶的容积。如配制450 mL 0.1 ml·L-1 NaCl溶液,需选择500 mL容量瓶。③使用容量瓶注意“五不”:不能溶解固体;不能稀释浓溶液;不能加热;不能作反应容器;不能长期贮存溶液。④使用后应将容量瓶洗净、晾干。
2.配制100 mL 0.4 ml·L-1氯化钠溶液
[即学即练]1.判断下列说法是否正确,正确的打“√”,错误的打“×”。(1)配制溶液时,可以用托盘天平称取10 g固体溶质( )(2)配制溶液时,可以把固体直接放入容量瓶中,加蒸馏水溶解( )(3)定容时,眼睛应平视凹液面与刻度线相切( )(4)要配制480 mL溶液,必须选择500 mL容量瓶( )(5)配制一定物质的量浓度的稀盐酸时,用量筒量取9.82 mL浓盐酸( )(6)在使用容量瓶配制NaOH或稀H2SO4溶液时,必须要等溶液恢复至室温再转移到容量瓶中( )
2.下列有关一定物质的量浓度溶液的配制说法不正确的是 (填序号)。
(1)为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线1~2 cm时,改用胶头滴管滴加蒸馏水至刻度线。(2)利用图a配制一定物质的量浓度的NaOH溶液。(3)利用图b配制一定物质的量浓度的NaCl溶液。(4)用容量瓶配制溶液时,若加水超过刻度线,立即用胶头滴管吸出多余液体。(5)配制溶液的定容操作可以用图c表示。
答案:(2)(3)(4)(5)
3.实验室用固体烧碱配制500 mL 0.10 ml·L-1的NaOH溶液。(1)需称量 g烧碱固体,固体应放在 中称量。(2)配制过程中,不需要使用的仪器是 (填字母)。A.烧杯 B.玻璃棒C.1 000 mL容量瓶 D.锥形瓶E.胶头滴管 F.500 mL容量瓶(3)在定容的过程中,完成定容操作后期加入少量水的做法是 。
用胶头滴管逐滴加水,当平视观察到凹液面与刻度线相切时立即停止加水
4.将5 ml·L-1盐酸10 mL稀释到200 mL,再取出5 mL,这5 mL溶液的物质的量浓度为( )A.0.05 ml·L-1 B.0.25 ml·L-1C.0.1 ml·L-1 D.0.5 ml·L-1
解析:设稀释后盐酸的物质的量浓度为c,则0.010 L×5 ml·L-1=0.200 L×c,解得c=0.25 ml·L-1,由于溶液具有均一性,所以取出的5 mL盐酸的浓度等于稀释后盐酸的浓度,为0.25 ml·L-1,故选B。
5.某同学用Na2CO3固体配制0.10 ml·L-1 Na2CO3溶液的过程如图所示。你认为该同学操作过程中错误的是( )A.①⑤⑥ B.②④⑦C.①⑥ D.⑤⑥⑦
解析:称量Na2CO3固体时,应将Na2CO3固体放在托盘天平的左盘,砝码放在右盘,①错误;定容时,视线应与溶液凹液面的最低处相平,⑥错误,故选C。
归纳总结(1)选错容量瓶或计算错误。应根据配制溶液的体积选择容量瓶,没有对应体积的容量瓶可选择偏大规格的,但溶质的质量或浓溶液的体积应根据容量瓶的规格计算。(2)溶液未冷却就转移到容量瓶。(3)溶解固体或稀释浓溶液的烧杯和玻璃棒均需要洗涤并转移。(4)定容后不能再加水。
三、物质的量用以化学方程式的计算1.化学方程式中化学计量(系)数的含义所以,对于该反应来说,可以理解为2 ml H2和1 ml O2在点燃条件下恰好完全反应生成2 ml H2O。
2.反应中各物质的物理量之间的比例关系(g表示气体) aA(g) + bB(g)===cC(g) + dD(g)化学计量(系)数之比: a ∶ b ∶ c ∶ d质量之比: aMA ∶ bMB ∶ cMC ∶ dMD气体体积之比: a ∶ b ∶ c ∶ d
3.根据化学方程式进行计算的一般步骤设:设所求物质的物质的量或质量、体积等;写:写出相应的化学方程式;标:在化学方程式中有关物质下面标出相关量;列:列出比例式;解:解上述含未知数的比例式;答:简明地写出答案。
[即学即练]1.标准状况下,3.25 g锌与足量的盐酸反应,计算产生H2的量,下列比例式正确的是( )
2.将1.15 g钠置于足量的水中,充分反应后,生成的NaOH的物质的量是多少?生成的气体在标准状况下占多大体积?
[提升2] 已知氨水的密度为0.990 g·mL-1时,溶质的质量分数为2%;氨水的密度为0.930 g·mL-1时,溶质的质量分数为18%。溶质质量分数分别为a%和5a%的氨水等体积混合后,混合溶液中溶质的质量分数( )A.等于3a% B.等于6a%C.大于3a% D.小于3a%
(4)溶液稀释或混合后,溶质物质的量浓度的计算。①溶质的物质的量不变。根据c1V1=c2V2计算(c1、c2分别为稀释前后溶液的物质的量浓度,V1、V2分别为稀释前后溶液的体积)②相同溶质的不同物质的量浓度的溶液混合。混合后溶质的总物质的量不变,可根据c1V1+c2V2=c(混)·V(混)计算混合后溶液中溶质的物质的量浓度[c(混)为混合后溶液的物质的量浓度,V(混)为混合后溶液的体积]。
二、配制一定物质的量浓度溶液的误差分析[例2] 下列所配制的溶液浓度偏高的是( )A.配制盐酸,用量筒量取盐酸时俯视刻度线B.配制盐酸定容时,仰视容量瓶刻度线C.称量4.0 g NaOH配制0.1 ml·L-1 NaOH溶液1 000 mL时,砝码错放在左盘D.NaOH溶解后未经冷却即注入容量瓶,并定容至刻度线
解析:A项,俯视量筒刻度线,使量取的盐酸体积小于计算值,导致浓度偏低;B项,定容时仰视容量瓶刻度线,将会导致加水量增多,使溶液浓度偏低;C项,由于所称NaOH固体的质量为整数值,不需要移动游码,故称取固体NaOH的质量是准确的,不会影响到所配制溶液的浓度;D项,因热胀冷缩,会使容量瓶中的溶液在冷却后液面低于刻度线,导致所配溶液浓度偏高。
[提升3] 某次实验中预计需要使用480 mL a ml·L-1的纯碱溶液,如图是某同学在实验室配制该溶液的流程图。回答下列问题:
(1)容量瓶上标有①温度 ②浓度 ③规格 ④压强 ⑤刻度线中的________(填序号)。(2)使用容量瓶前必须对容量瓶进行的一项操作是 。(3)应选择V= mL的容量瓶,需要称取 g Na2CO3。(4)所给出的流程图中的操作内容有两个明显的错误,请写出: 、 。(5)指出下列实验操作对所配制溶液浓度的影响(填写“偏大”“偏小”或“无影响”)。①溶解、转移溶液后,没有洗涤玻璃棒及烧杯: 。②定容时仰视刻度线: 。③容量瓶未干燥,有少量蒸馏水: 。
以配制一定物质的量浓度的NaCl溶液为例(表格中的“—”表示对n或V无影响):
状元随笔 画图法理解和记忆量取溶液或定容时俯视、仰视造成的误差1.量取误差用浓溶液配制稀溶液,计算出浓溶液的体积(设为V)后用量筒量取。若量取时俯视(如图1),则所取溶液的体积(设为V ′)偏小,溶液浓度偏低;若量取时仰视(如图2),则溶液浓度偏高。2.定容时俯视、仰视造成的误差“俯视”(如图3)可理解为“眼高水低”,加蒸馏水的量偏小,则所配制溶液浓度偏高,“仰视”(如图4)则相反。
1.用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )
2.下列溶液中溶质的物质的量浓度为1 ml·L-1的是( )A.将40 g NaOH溶解于1 L水中B.将22.4 L氯化氢气体溶于水配成1 L溶液C.将1 L 10 ml·L-1的浓盐酸与9 L水混合D.将10 g NaOH溶解于水中配成250 mL溶液
3.下列溶液中Cl-的浓度与150 mL 1 ml·L-1 MgCl2溶液中Cl-的浓度相等的是( )A.150 mL 1 ml·L-1 NaCl溶液B.75 mL 2 ml·L-1 CaCl2溶液C.150 mL 2 ml·L-1 KCl溶液D.75 mL 1 ml·L-1 AlCl3溶液
解析:1 ml·L-1 MgCl2溶液中Cl-的浓度为2 ml·L-1。150 mL 1 ml·L-1 NaCl溶液中Cl-的浓度为1 ml·L-1;75 mL 2 ml·L-1 CaCl2溶液中Cl-的浓度为4 ml·L-1,150 mL 2 ml·L-1 KCl溶液中Cl-的浓度为2 ml·L-1;75 mL 1 ml·L-1 AlCl3溶液中Cl-的浓度为3 ml·L-1。
4.为了配制100 mL 1 ml·L-1的NaOH溶液,其中有下列几个操作:①NaOH固体放在纸片上称量②选刚用蒸馏水洗净的100 mL容量瓶进行配制③NaOH在烧杯里刚好完全溶解,立即把溶液转移到容量瓶中④用蒸馏水洗涤烧杯内壁及玻璃棒2~3次,洗涤液也转入容量瓶中⑤使蒸馏水沿玻璃棒注入容量瓶,直到溶液的凹液面恰好与刻度线相切其中操作错误的是( )A.①②③ B.③④⑤C.②③⑤ D.①③⑤
解析:①NaOH固体不能放在纸片上称量,可放在小烧杯中称量;③溶解后应冷却至室温后再把溶液转移到容量瓶中;⑤最后定容时应改用胶头滴管向容量瓶中滴加蒸馏水。
6.取200 mL 0.3 ml·L-1 HNO3溶液和300 mL 0.6 ml·L-1 HNO3溶液混合(溶液体积变化忽略不计),则混合后所得溶液中HNO3的物质的量浓度为( )A.0.45 ml·L-1 B.0.36 ml·L-1C.0.48 ml·L-1 D.0.24 ml·L-1
7.已知某饱和NaCl溶液的体积为V mL,密度为ρ g·mL-1,质量分数为ω,物质的量浓度为c ml·L-1,溶液中NaCl的质量为m g。(1)用m、V表示溶液中溶质的物质的量浓度:________________。(2)用w、ρ表示溶液中溶质的物质的量浓度:________________。(3)用c、ρ表示溶液中溶质的质量分数:__________。(4)用w表示该温度下NaCl的溶解度:__________。
8.实验室用CuSO4·5H2O晶体配制460 mL 0.100 ml·L-1 CuSO4溶液。现有下列仪器:A.烧杯 B.500 mL容量瓶 C.药匙 D.玻璃棒E.托盘天平(带砝码) F.量筒 G.试剂瓶请回答下列问题:(1)配制时,还缺少的仪器是 。(2)用托盘天平称取的CuSO4·5H2O晶体的质量为 ,若定容时加蒸馏水不慎超过刻度线,处理的方法是 。
解析:(1)称量时需要用托盘天平、药匙,溶解时需要用量筒、烧杯、玻璃棒,转移溶液时需要用500 mL容量瓶,定容时需要用胶头滴管。(2)所需溶质质量m(CuSO4·5H2O)=n·M=0.05 ml×250 g·ml-1=12.5 g。
(3)若实验过程中遇到下列情况,则会导致所配溶液的浓度偏大的是________(填标号)。A.摇匀后发现液面低于刻度线,滴加蒸馏水至刻度线再摇匀B.定容时俯视容量瓶的刻度线C.容量瓶内底部有少量蒸馏水而未干燥处理D.称取的CuSO4·5H2O晶体失去了部分结晶水(4)若取50.0 mL上述已配好的溶液,与150 mL 0.200 ml·L-1的CuSO4溶液混合,最后得到的溶液的物质的量浓度为_____________ (溶液的体积变化忽略不计)。
0.175 ml·L-1
9.一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 ml/L NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05 ml。(1)原NaOH溶液的质量分数为 (保留1位小数)。(2)所得溶液中Cl-的物质的量为 ml。(3)所用氯气和氢气的物质的量之比n(Cl2)∶n(H2)= 。
相关课件
这是一份化学必修 第一册第3节 化学中常用的物理量——物质的量教案配套ppt课件,共60页。PPT课件主要包含了分点突破1,物质的量浓度,分点突破2,分点突破3,物质的量浓度的计算,分点突破4等内容,欢迎下载使用。
这是一份化学必修 第一册第3节 化学中常用的物理量——物质的量课前预习ppt课件,共47页。PPT课件主要包含了任务分项突破,课堂小结提升,学科素养测评,自主梳理,互动探究,题组例练,1mol,85g,托盘天平,玻璃棒等内容,欢迎下载使用。
这是一份2021学年第1章 认识化学科学第3节 化学中常用的物理量——物质的量教学ppt课件,共45页。PPT课件主要包含了知识网络,学业基础,物质的量浓度,单位体积,物质的量,mol·L-1,mol·m-3,玻璃棒,胶头滴管,mL容量瓶等内容,欢迎下载使用。









