


5.1 原子结构 原子核外电子排布(课件)-2024年高考化学一轮复习课件(全国通用)
展开考点一 原子结构 核素和同位素考点二 原子核外电子排布原理 链接高考
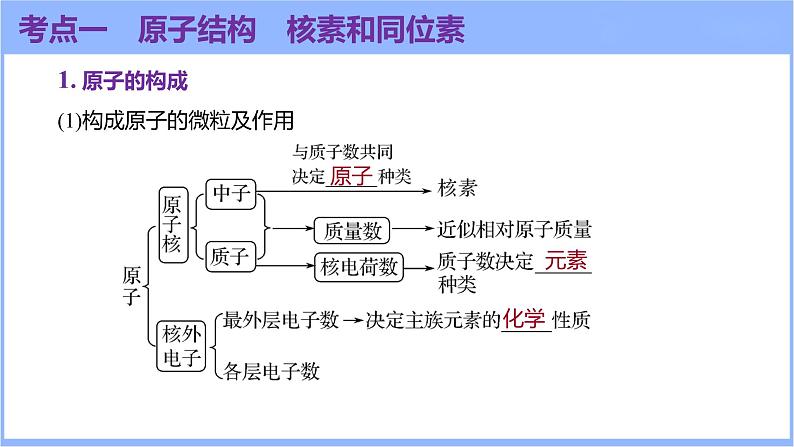
1. 原子的构成(1)构成原子的微粒及作用
考点一 原子结构 核素和同位素
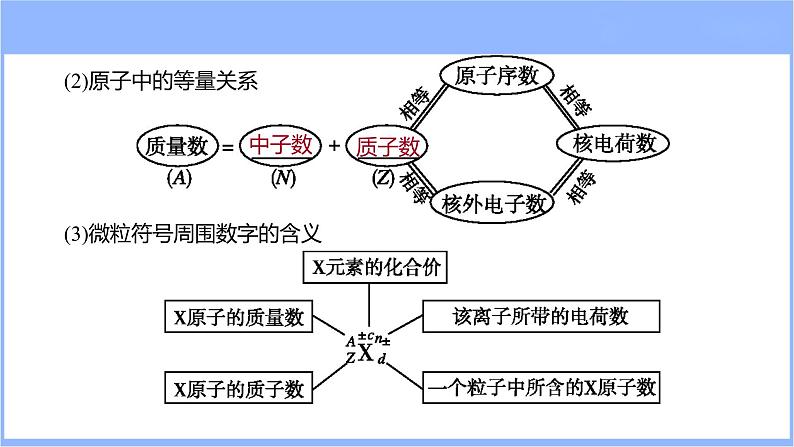
(2)原子中的等量关系(3)微粒符号周围数字的含义
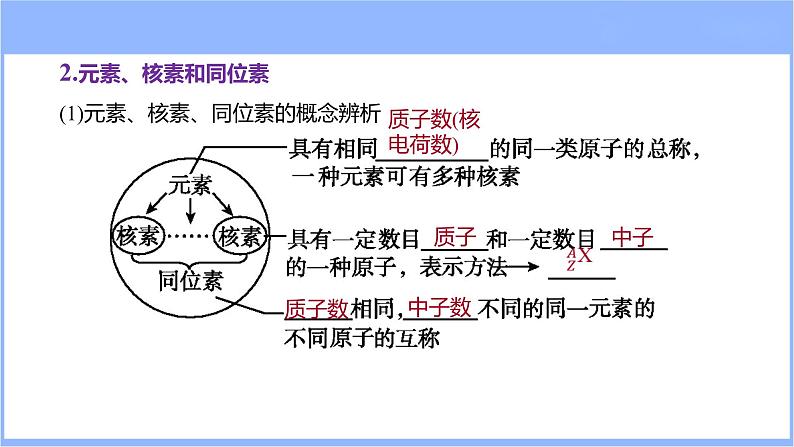
2.元素、核素和同位素(1)元素、核素、同位素的概念辨析
(4)几种重要核素的用途
(1) 1 ml重水分子和1 ml普通水分子中,中子数之比为2∶1( )
(2)中子数不同而质子数相同的微粒一定互为同位素( )
[解析]中子数不同而质子数相同的微粒不一定都是原子,如14C16O和 14N2,则它们不可能互为同位素。
基础知识秒杀(正确的打“√”,错误的打“×”)
[规律小结 ] 微粒中粒子数之间的定量关系(1)对于原子或离子:质量数=质子数+中子数。(2)对于原子:核电荷数=质子数=核外电子数。(3)对于离子:核电荷数=质子数≠核外电子数。
[素养养成] 寻找“等电子”微粒的思维方法寻找2、10、18电子微粒的方法(1)2电子微粒: (2)10电子微粒:以Ne为核心,推断同周期的非金属元素形成的微粒和下一周期的金属元素形成的微粒。
(3)18电子微粒:以Ar为核心,推断同周期的非金属元素形成的微粒和下一周期的金属元素形成的微粒。
1. 能层与能级(1)能层(n)(即电子层)原子核外电子是 排布的,根据电子的 差异,可将核外电子分成不同的能层。每个能层最多能容纳的电子数为 。 (2)能级同一能层的电子, 也可能不同,不同能量的电子分成不同的能级,通常用能级符号 等表示,同一能层里,各能级的能量按s、p、d、f的顺序升高。不同能层的能级表示方法是在能级符号前面加能层序号,如第3层的各能级表示为3s、3p、3d。则第n能层各能级的能量顺序为 。
ns
(3)能层与能级的关系
2. 电子云与原子轨道(1)电子云电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述。(2)原子轨道原子轨道表示电子在原子核外的一个空间运动状态。同一能层中各能级的电子分别占据各自的原子轨道,它们有不同的形状、个数和伸展方向。
[重难警示] ①第一能层(K),只有s能级;第二能层(L),有s、p两种能级,p能级上有三个原子轨道px、py、pz,它们具有相同的能量;第三能层(M),有s、p、d三种能级。②一个原子核外电子的空间运动状态种类数=该原子核外电子占据的原子轨道数。
3. 原子核外电子的排布(1)排布规律(书写原则)[核心点拨1] 洪特规则特例:当能量相同的原子轨道在全充满(p6、d10、f14)、半充满(p3、d5、f7)或全空(p0、d0、f0)状态时,体系较稳定,能量最低。例如,基态24Cr原子的电子排布式为1s22s22p63s23p63d54s1。
(2)构造原理(填充顺序)从氢开始,随着核电荷数的递增,新增电子填入能级的顺序称为 ,如图为构造原理示意图:
(3)核外电子排布表示方法(以硫原子为例)
4. 基态与激发态原子光谱(1)基态与激发态(2)原子光谱不同元素原子的电子发生跃迁时会 或 不同的光,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称原子光谱。利用原子光谱的特征谱线可以鉴定元素,称为光谱分析。
(3)基态、激发态及光谱示意图(电子的跃迁)[核心点拨2] ①电子的跃迁是物理变化,是在原子内部进行的,原子组成没有变化。②电子跃迁一般发生在能量相近的能级间,激发态原子释放能量不一定变成基态原子。
(2)氮原子的价层电子的轨道表示式(电子排布图)为 ( )
[解析]根据构造原理可知氮原子的价层电子排布为2s22p3,根据洪特规则和泡利原理可知其价层电子的轨道表示式为 。
(1)基态K原子中,核外电子占据最高能层的符号是N,占据该能层电子的电子云轮廓图形状为球形( )
[解析]基态K原子核外有4个能层:K、L、M、N,能量依次增高,处于N层上的1个电子位于s轨道,s电子云轮廓图形状为球形。
(3)1s、2s和3s能级轨道的形状均为球形,其能量随能层序数增大而升高 ( )(4)镍元素基态原子的核外电子排布式为1s22s22p63s23p63d84s2,3d能级上的未成对电子数为3( )
[解析] Ni是28号元素,根据核外电子的排布规律可知,其基态原子的核外电子排布式为1s22s22p63s23p63d84s2。根据洪特规则可知,Ni原子3d能级上8个电子尽可能分占5个不同的轨道,其未成对电子数为2。
(5)基态Zn2+核外电子排布式为[Ar]3d10 ( )
[解析] Zn为30号元素,其基态原子的核外电子排布式为1s22s22p63s23p63d104s2,失去最外层的2个电子即可得到Zn2+,基态Zn2+的核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10。
(6)基态氧原子核外电子的空间运动状态有5种,核外电子的运动状态有8种( )
[易错警示 ] 一、判断原子核外电子的空间运动状态
二、核外电子排布常见错误(1)在写基态原子的轨道表示式时,常出现以下错误:① (违反能量最低原则)② (违反泡利不相容原理)③ (违反洪特规则)④ (违反洪特规则)(2)当出现d轨道时,虽然电子按ns、(n-1)d、np的顺序填充,但在书写电子排布式时,仍把(n-1)d放在ns前,如Fe:1s22s22p63s23p63d64s2,而失电子时,却先失去4s轨道上的电子,如Fe3+:1s22s22p63s23p63d5。(3)注意比较原子核外电子排布式、简化电子排布式、价层电子排布的区别与联系。如基态Cu的电子排布式:1s22s22p63s23p63d104s1;简化电子排布式:[Ar]3d104s1;价层电子排布:3d104s1。
2. [2022·浙江卷] 下列说法不正确的是( )A.32S和 34S互为同位素B.C70和纳米碳管互为同素异形体C.CH2ClCH2Cl和CH3CHCl2互为同分异构体D.C3H6和C4H8一定互为同系物
[解析] C3H6和C4H8可以是烯烃,也可以是环烷烃,D项错误。
5. (1)[2022·湖南卷节选] 基态Se原子的核外电子排布式为[Ar] 。 (2)[2022·河北卷节选] 基态S原子的价电子中,两种自旋状态的电子数之比为 。
[解析] (1)硒元素的原子序数为34,其基态原子的核外电子排布式为[Ar]3d104s24p4。(2)基态S原子核外电子排布式为1s22s22p63s23p4,价电子轨道表示式为 ,则两种自旋状态的电子数之比为2∶1(或1∶2) 。
(3)[2022·全国甲卷节选] 基态F原子的价电子排布图(轨道表示式)为 。 (4)[2022·山东卷节选] 基态Ni原子的价电子排布式为 。
[解析] (3)F为第9号元素,其基态原子的电子排布式为1s22s22p5,则其价电子排布图为 。(4)已知Ni是28号元素,故基态Ni原子的价电子排布式为3d84s2。
2024届高中化学一轮复习课件:原子结构 原子核外电子排布: 这是一份2024届高中化学一轮复习课件:原子结构 原子核外电子排布,共3页。PPT课件主要包含了中子数,质子数,质子数核电荷数,几乎完全相同,差异较大,同位素,pdf,哑铃形,构造原理,最低能量等内容,欢迎下载使用。
2024届高考化学一轮复习原子结构 核外电子排布规律课件: 这是一份2024届高考化学一轮复习原子结构 核外电子排布规律课件,共60页。PPT课件主要包含了专项突破,归纳整合,p轨道,d轨道,f轨道,为什么等内容,欢迎下载使用。
2024届高三化学高考备考一轮复习专题:原子结构 核外电子排布课件: 这是一份2024届高三化学高考备考一轮复习专题:原子结构 核外电子排布课件,共42页。PPT课件主要包含了核外电子数,质子数,中子数,几乎完全相同,2原子结构示意图,电子层,pdf,概率密度分布,哑铃形,电子自旋等内容,欢迎下载使用。












