


高中化学人教版 (2019)必修 第一册第三节 物质的量教学演示ppt课件
展开
这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量教学演示ppt课件,共47页。PPT课件主要包含了化学与生活,物质的量,第一课时,物质的量的单位,国际计量局保存的原器,物理量与物理量的单位,知识回顾,宏观物质与微观粒子,宏观物质,微观粒子等内容,欢迎下载使用。
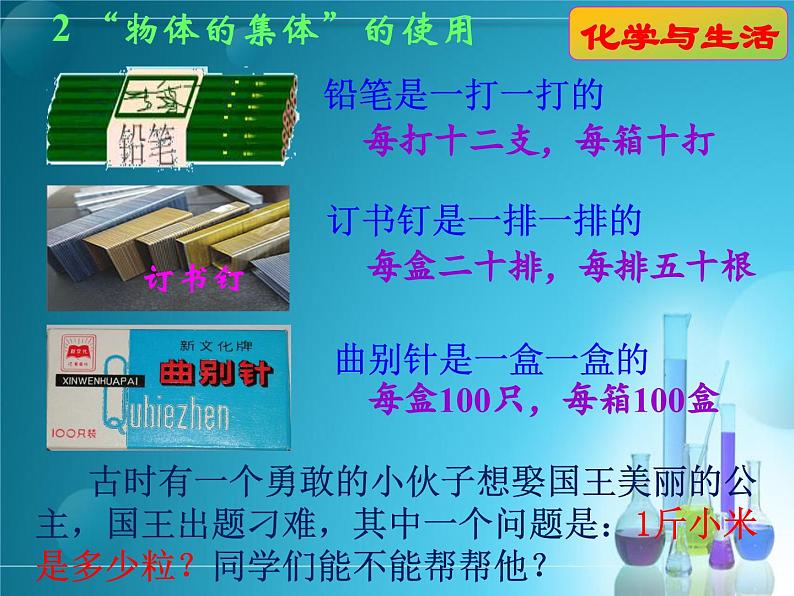
曲别针是一盒一盒的 每盒100只,每箱100盒
古时有一个勇敢的小伙子想娶国王美丽的公主,国王出题刁难,其中一个问题是:1斤小米是多少粒?同学们能不能帮帮他?
2 “物体的集体”的使用
每盒二十排,每排五十根
ⅰ.不同的物质可能有不同的计量方法
ⅱ.不同的计量方法之间可以相互转化
ⅲ.越小的物质用“集团”来计量越方便
如1打铅笔等于12支,100只曲别针为1盒
能总结,会归纳,也是一种学习哦!
思考1、根据上面的图例,联系生活中的计量方法,请思考下面的问题: 对于体积细小的物品,用打、排、盒等来计量物品的数目有哪些好处? 打、排、盒和只(个数,数量单位)有怎样的数量关系?
如铅笔、订书钉、曲别针分别用打、排、盒
思考2、微观粒子用什么方法计量方便呢?
走进《化学1》, 探索无机世界的奥秘, 从学习物质的量开始!
国际单位制中,长度单位 的“米”、质量单位的 “千克”
国际计量局保存的米原器
国际计量局保存的千克原器
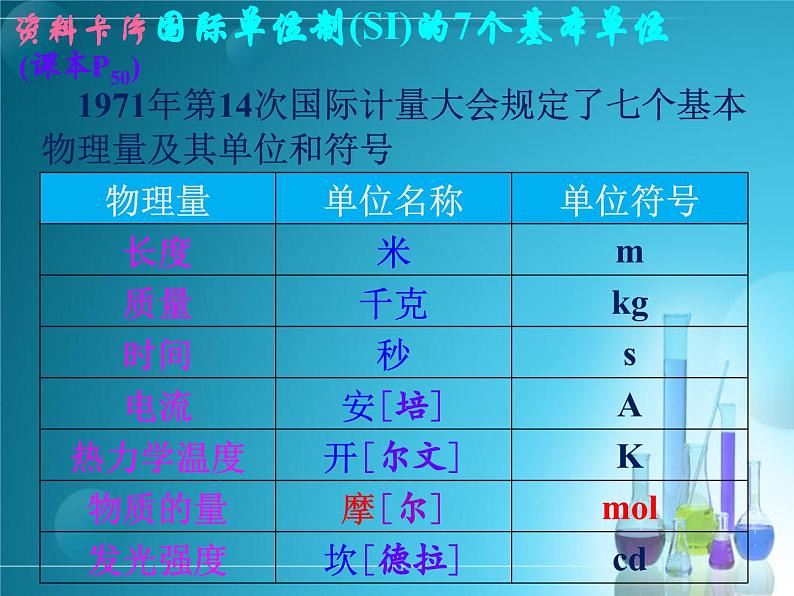
1971年第14次国际计量大会规定了七个基本物理量及其单位和符号
国际单位制(SI)的7个基本单位
资料卡片(课本P50)
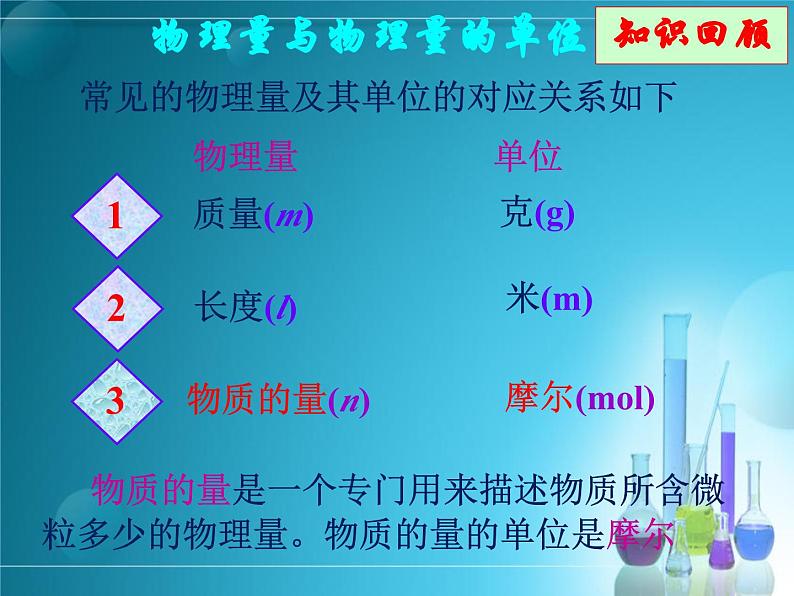
物质的量是一个专门用来描述物质所含微粒多少的物理量。物质的量的单位是摩尔
常见的物理量及其单位的对应关系如下
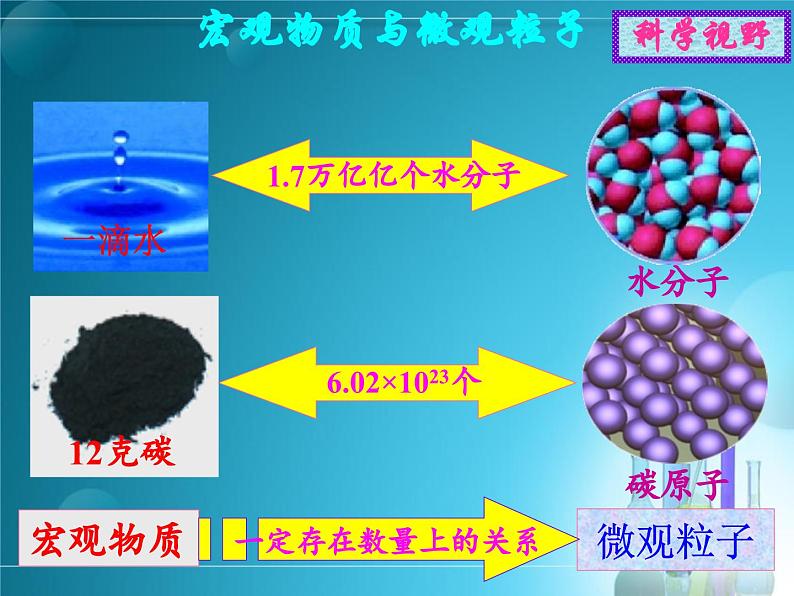
1个碳原子 1个氧分子 1个二氧化碳分子
12克炭 32克氧气 44克二氧化碳
化学反应是原子、离子或分子之间按一定的数目关系进行的。 思考4、原子、离子和分子等我们不仅直接用肉眼看不到而且难以称量。用什么方法把微观粒子的个数与宏观质量之间联系起来呢?
物质的量是把可见、可称量的宏观物质与难看见、难称量的微观粒子联系起来的一座桥梁。
物质与粒子间联系的桥梁
(4)微观粒子:表示一定数目粒子的集合体。
一、物质的量的单位—摩尔1、物质的量(n) 表示含有一定数目粒子的集合体的物理量叫物质的量(1)特征:物质的量是国际单位制七个基本物理量之一 仅用于计量微观粒子,不适用于宏观物质。(2)符号:n(3)单位:摩尔;简称“摩”,符号为ml
训练1、下列说法中正确的是( ) A. 物质的量适用于计量分子、原子、离子等粒子 B. 物质的量就是物质的质量 C. 摩尔是表示粒子多少的一种物理量 D. 摩尔是表示物质质量的单位
解析:物质的量是物理量,摩尔是物质的量这个物理量的单位。“物质的量”是一个整体,不能拆开理解。
1、物质的量(n)(5)物质的量使用规范①专有名词:“物质的量”是一个专有名词 由四个字组成,是一个整体,不能分割,也不可加字、减字;②适用范围:“物质的量”仅适用于计量微观粒子,不适用于宏观物质。
粒子指微观分子、原子、离子、电子、质子、中子、原子团等;
如不能用物质的量把铅笔、订书针,曲别针表示为1ml铅笔、1ml订书针、ml曲别针。但氢气分子可以表示为1mlH2
③表示方法:微观粒子要指明种类,一般用化学式表示。如1mlH2表示1摩尔氢气分子 使用物质的量时,一般用化学式表示,若用中文,则必须指明微粒的种类。ⅰ.原子:1摩尔氢原子或1摩尔H或 1mlHⅱ.分子:1摩尔二氧化碳分子 或 1摩尔CO2 或1 ml CO2ⅲ.离子:1ml钠离子或1 摩尔 Na+或1ml Na+ⅳ.原子团:1 ml硫酸根离子或1 摩尔SO42- 或1ml SO42-
1、物质的量(n)(5)物质的量使用规范
(1)摩尔是七个物理量之一。(2)摩尔是物质的质量单位。(3) 1摩尔大米含有 6.02×1023个米粒。
错误。物质的量是七个基本物理量之一
错误。摩尔是物质的量的单位
错误。物质的量只适用于微观粒子,不能用来说明宏观物质
训练2、根据化学知识,判断下面叙述是否正确?
必须指明微粒的种类,是氧原子、氧分子还是氧离子。
(1)1 摩尔氧(2)1 摩尔H(3)2 摩尔大米(4)硫酸的物质量为3摩尔(5)0.5 摩二氧化碳分子(6)3 ml NH3 有3 ml 氮,9 ml 氢
训练3、根据物质的量的定义,判断下列说法是否正确
应该表述为“1ml 氢原子”
应该表述为“3 ml N ,9 ml H”
国际上规定: 1ml任何粒子所含的粒子数与0.012kg 12C中所含的碳原子数相同。
思考5、物质的量与粒子数间有怎样的联系?
图2-20(P54):宏观物质与微观粒子间的联系
12C指质子数为6,中子数也为6的碳原子
国际上规定:1ml任何粒子所含的粒子数与0.012kg 12C中所含的碳原子数相同。
已知一个碳原子的质量为 1.993×10-23g 求0.012kg 12C 中所含的碳原子数。
≈ 6.02 ×1023
思考6、 1ml物质的粒子数又是多少呢?
0.012kg 12C
即1ml任何粒子所含的粒子数为6.02 ×1023个
阿伏加德罗 (1776-1856) 意大利物理学家、化学家,最早提出分子概念。
为了纪念阿伏加德罗的伟大功绩,国际科学界“将 0.012 kg12C 中所含的C原子数目称为阿伏加德罗常数”。它是自然科学中的基本常数之一。
1792年进都灵大学法律系学习,取得法学博士学位。1800年弃法从理,1820年被选为都灵科学院院士。他在化学上的重大贡献是建立分子学说。
A.Avgadr阿伏加德罗
国际规定:1 ml 任何粒子的粒子数叫做阿伏加德罗常数。通常用6.02× 1023 ml-1表示
(2)近似值:约为6.02× 1023
(3)单位:ml-1 (4)相互转化关系
阿伏加德罗常数(即NA)等于0.012 kg 12C所含的原子数,是一个精确值。
NA为阿伏加德罗常数,是一个精确值
微观粒子数,单位为“个”
阿伏加德罗常数,数值约为6.02× 1023,单位为ml-1
图2-19(P54):1ml物质的质量及所含的粒子数
训练 4. (双选)下列关于阿伏加德罗常数的说法正确的是( ) A.阿伏加德罗常数是一个纯数,没有单位 B.阿伏加德罗常数就是6.02×1023 C.阿伏加德罗常数是指1 ml 的任何粒子的粒子数 D.阿伏加德罗常数的近似值为:6.02×1023 ml-1
ⅰ.一打铅笔是12只铅笔, 1 ml C呢?
1 ml C含NA个碳原子,约含6.02× 1023个碳原子
ⅱ.一打羽毛球是12只羽毛球,1 ml O2呢?
1 ml H2O含NA个水分子,约含6.02× 1023个水分子;
ⅲ.一打钢笔是12只钢笔,1 ml H2O 呢?
1 ml O2含NA个氧分子,约含6.02× 1023个氧分子。
结论: 1 摩尔任何物质都含阿伏加德罗常数(NA)个该物质的微粒,约含6.02× 1023个。
思考6、物质的量与粒子数目之间怎么转换?
同时含2NA个氢原子和NA氧原子
ⅰ.原子:0.1ml 碳原子含有0.1×NA个碳原子ⅱ.分子:3ml 硫酸含有3×NA个硫酸分子ⅲ.离子:10ml 钠离子含有10×NA个钠离子ⅳ.电子:6ml 电子含有6×NA个电子ⅴ.中子:0.5ml 中子含有0.5×NA个中子
结论:物质的量是表示微观粒子的集体,可以用分数或小数表示。
物质的量(n) ==
①物质的量与粒子数间的关系
(5)阿伏伽德罗常数的应用
NA为常数,约为6.02×1023个
即物质的量与粒子数数成正比
训练5、根据题意,回答下列问题(1) 1ml H2O的质量是18g,约含有__________个水分子。(2) 0.5ml H2O的质量是9g,约含有_________个水分子。(3) 1ml AI的质量是27g,约含有__________个铝原子。(4) 2ml Al的质量是54g,约含有____________个铝原子。
(5)10ml Na+的质量是230g,约含有_________个钠离子,带__________个正电荷, 10mlNa+含有_______________个质子
11×6.02×1024
2×6.02 ×1023
(1)1 ml H2O含NA个水分子含 个 H,含 个 O,含 个 电子
(2)2 ml H2O含 2NA个 水分子含 个 H,含 个 O ,含 个质子
(3)3 NA个水分子的物质的量是 ml水分子,含 个H ,含原子核 个
(4)1 个水分子的物质的量是 ml
训练6、NA表示阿伏伽德罗常数,根据题意填写下列空白
(1) 3.01×1023个CO2的物质的量是多少?
(2) 1.204×1024个H2O的物质的量是多少?
(3) 2 ml Mg变成Mg2+时失去电子数是多少?
(4) N个 CO2的物质的量是多少?
2×2×6.02×1023 个
1 个 1 个 1 个
1 ml 1 ml 1 ml
2个 1个 2个
2ml 1ml 2ml
②物质的量与化学计量数之间的关系
结论:化学反应方程式中,化学计量数之比等于反应过程中各物质的物质的量之比。
1 NA个 1 NA个 1 NA个
2 NA个 1 NA个 2 NA个
训练8.下列说法中正确的是( ) A. 1ml任何物质均含有6.02 ×1023个原子 B. 阿伏加德罗常数就是 1ml粒子数的集体,0.012kg 12C约含有 6.02×1023个12C原子 C. 摩尔是一个基本的物理量 D. 1ml水中含有2ml氢和1ml氧
[提示]构成物质的微粒有很多种,不单单只是原子。描述物质的量时应具体,不能模糊。
一般地,1ml不同的物质中所含的粒子数相等,但由于不同粒子的质量不同, 1ml不同物质的质量也不相同。如1ml水和1ml铝
思考3、那么物质的量与质量怎么转化呢?
图2-19(课本P54):1ml物质的质量及所含粒子数
1ml水约6.02 ×1023个水分子,质量为18g。
1ml铝约6.02 ×1023个铝原子,质量为27g。
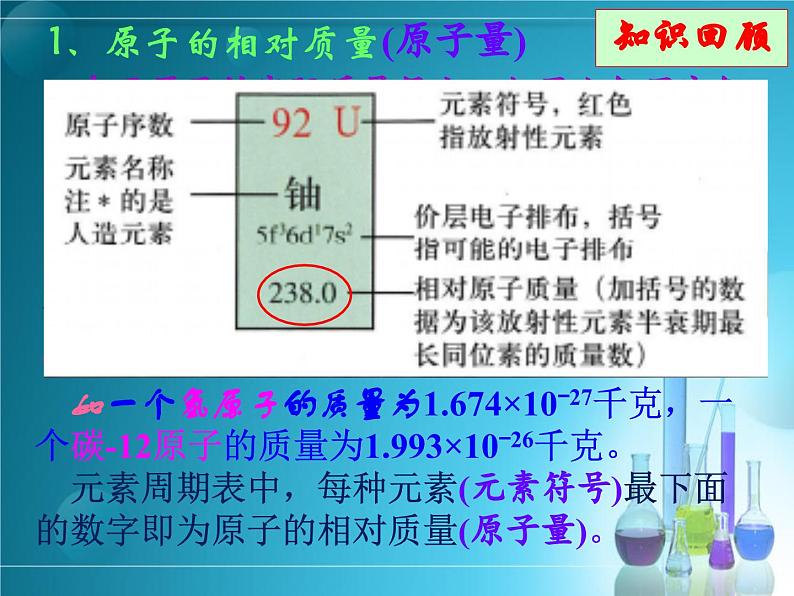
结论:以克为单位,1 ml 任何物质的质量在数值上都等于它的相对质量。
即1ml氧原子的质量==1 g×Ar(O)
(1) 1摩尔物质的质量
如氧原子的相对质量(Ar)的计算
①物质的量与物质的质量转换
结论: 1ml摩尔物质的质量(g) ,数值与该粒子的相对原子质量或相对分子质量相等。
图2-21(课本P55):物质的量为1ml的几种物质
思考7、 1ml摩尔物质的质量量是多少克?
即1 ml S、Cu、Al、Zn、NaCl和Fe的质量分别是32g、63.5g、27g、65g、 58.5g和56g。
结论:1ml任何粒子的质量(g),其数值都与该粒子的相对原子质量或相对分子质量相等。
ⅰ.原子:1ml任何原子的质量(以克为单位)在数值上等于该原子的相对原子质量。ⅱ.分子: 1ml任何分子的质量(以克为单位)在数值上等于该分子的相对分子质量。ⅲ.离子:1ml任何离子的质量(以克为单位)在数值上等于该离子的相对质量。ⅳ.原子团:1ml任何原子团的质量(以克为单位)在数值上等于该原子团的相对质量。
②1摩尔粒子或物质的质量: 1ml任何粒子或物质的质量以克为单位时,其数值与该粒子的相对原子质量或相对分子质量相等。
训练9、根据摩尔质量的数值等于该粒子的相对质量,完成成下列填空(1)1mlFe的质量是:_________(2)1mlO2的质量是:_________ (3)1mlH2SO4的质量是:______ (4)1mlFe2+的质量是:________(5)1mlSO42-的质量是:_______
解析:1ml任何粒子或物质的质量以克为单位时,其数值都与该粒子的相对原子质量或相对分子质量相等。
①符号:M②单位:克/摩或g/ml 或 g·ml-1③数值:等于该物质的相对分子质量或相对原子质量。④公式:
每摩尔物质所具有的质量,在数值上就是该物质的摩尔质量。
(2)摩尔质量——物理量
单位物质的量的物质所具有的质量叫物质的摩尔质量。
1 ml H2O的质量是18 g,水的摩尔质量是18 g/ml
1 ml Fe的质量是56 g,铁的摩尔质量是56 g/ml
1 ml O2的质量是32 g,氧气的摩尔质量是32 g/ml
1 ml NaCl的质量是58.5 g,氯化钠的摩尔质量是58.5 g/ml
1 ml O2的质量与氧气的摩尔质量
1 ml H2O的质量与水的摩尔质量
1 ml Fe的质量与铁的摩尔质量
1 ml NaCl的质量与NaCl的摩尔质量
1 ml SO42-的质量与 SO42-的摩尔质量
1 ml SO42-的质量是96 g, SO42-的摩尔质量是96 g/ml
训练10、钠的相对质量为23,下列说法正确的是( ) A. Na的摩尔质量为 23 g B. Na的摩尔质量为 23 C. Na的摩尔质量为 23 g·ml-1 D. Na的摩尔质量为 23 ml-1
[提示] 注意摩尔质量的单位。
物质的量将可称量的物质的质量与微观粒子的数目联系起来。
物质的质量m、物质的量n、粒子数N之间的关系如下:
例1、 (P55) 26.5gNa2CO3的物质的量是多少?
解析:Na2CO3的相对分子质量为106,摩尔质量为106g/ml
答: 26.5gNa2CO3的物质的量是0.25ml
先公式、后数字;标数量、带单位;再计算
(3)摩尔质量的有关计算
训练11、在0.5 ml O2中含有的O2的分子数目是多少?含有的O的原子数目是多少?含有电子的数目是多少?
解析1:O2的分子数:N == n×NA== 0.5 ml ×6.02×1023 ml-1 ==3.01×1023
解析2:O原子数为:N == n×2×NA == 0.5 ml×2×6.02×1023 ml-1 == 6.02×1023
解析3:O2的电子数为:N == n×2×8×NA == 4.816×1024
(4)物质的量在化学方程式中的计算
如1ml锌与足量盐酸的反应 Zn + 2HCl ==== ZnCl2 + H2 ↑
物质的量 1ml 2ml 1ml 1ml
物质质量 1×65g 2×36.5g 1×136g 1×2g
1 2 1 1
横向意义要相同,纵向单位要一致。
②计算方法:各已知量与未知量成正比
①计算原理:化学计量数之比等于各物质的物质的量之比
1×NA 2×NA 1×NA 1×NA
例2、32.5g锌与足量盐酸反应,生成H2的物质的量是多少?消耗盐酸的物质的量是多少?
一、物质的量的单位1、物质的量:表示物质含微粒数目的物理量
符号为 n,单位为摩尔(ml),简称摩
2、阿伏加德罗常数:1摩尔任何粒子约含有6.02×1023个的微粒(1)物质的量与微粒数之间的换算关系
n=N÷6.02×1023
N=n×6.02×1023
n—物质的量; N—微粒个数
(2)阿伏加德罗常数应用
即微粒数之比等于物质的量之比
2、摩尔质量——物理量
(1)符号:M(2)单位:克/摩或g/ml 或 g·ml-1
(3)数值:等于该物质的相对分子质量或相对原子质量。
通过物质的量(n)这个桥梁可间接进行m与N之间的换算。
练习 1.物质的量是化学学习中的重要化学用语,请说出下列语句的含义。 (1) 1 ml H (2) 3 ml H2 (3) 1 ml CO2
表示3 ml的氢气分子
表示1 ml二氧化碳分子
[解析]物质的量的表示方法:物质的量数值的多少(ml)+能表示微观粒子的符号
练习2. 下列关于摩尔的说法中,其中不正确的是( ) A.摩尔是一个物理量,含6.02×1023个粒子 B. 摩尔是国际单位制的七个基本单位之一 C.摩尔是物质的量的单位,简称摩,符号为ml D.摩尔的基准是0.012 kg 12C中所含的碳原子数
练习3.下列关于物质的量的说法中,正确的是 ( ) A. 物质的量是物质数量的单位 B. 物质的量实际上表示物质的质量 C. 物质的量实际上表示含有一定数目的粒子集体 D. 物质的量就是物质的数量
相关课件
这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量教课ppt课件,共27页。PPT课件主要包含了新课引入,质量分数,体积分数,体检单,物质的量,物质的量浓度,符号cB,实验目的,实验设计,实验原理等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量教学课件ppt,共20页。PPT课件主要包含了学习目标等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第一册第三节 物质的量教学ppt课件,共25页。PPT课件主要包含了新闻热点,课堂任务,类比迁移,国际七个基本单位,及时巩固,5NA,还需要哪个物理量,mol物质的质量,课堂练习等内容,欢迎下载使用。










