






人教版 (2019)选择性必修2第一节 共价键说课课件ppt
展开1.熟知共价键的定义与形成过程,知道共价键的特征——具有饱和性和方向性,培养宏观辨识与微观探析的化学核心素养。2.能够从不同的角度对共价键分类,会分析σ键和π键的形成及特点,培养证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
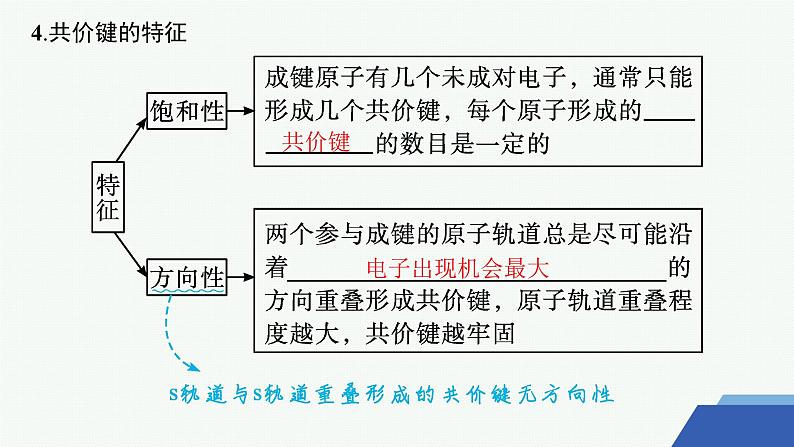
一、共价键的形成1.共价键定义吸引电子能力相近的原子之间通过 所形成的 ,叫共价键。
2.共价键的形成过程(以氢气分子形成为例)当两个氢原子相互接近时,若两个氢原子核外电子的自旋方向 ,它们接近到一定距离时,两个 轨道发生重叠,电子在两原子核间出现的机会 。随着核间距的减小,核间电子出现的机会增大,体系的能量逐渐 ,达到能量最低状态。核间距进一步减小时,两原子间的斥力使体系的能量迅速上升,这种排斥作用又将氢原子推回到平衡位置。氢分子的形成过程中能量(主要指势能)随核间距的变化如图中曲线a所示: 若两个氢原子核外电子的自旋方向相同,当它们相互接近时,原子间总是排斥作用占主导地位(如图中曲线b所示)。所以两个带有自旋方向 的电子的氢原子不可能形成氢分子。
3.共价键的本质当成键原子相互接近时,原子轨道发生 ,自旋方向 的未成对电子形成 ,两原子核间的电子云密度 ,体系的能量 。
教材阅读 想一想阅读教材“共价键具有方向性”一段。思考:结合H、N、O的轨道表示式分析,为什么N、O与H形成的简单化合物为NH3、H2O?
N原子轨道中有3个未成对电子,可以与3个H原子形成共价键。而O原子轨道中有2个未成对电子,可以与2个H原子形成共价键,故N、O与H形成的简单化合物分别为NH3、H2O。
易错辨析 判一判(1)金属元素与非金属元素之间可能形成共价键。( )(2)所有物质中的原子间都存在化学键。( )提示 稀有气体原子之间不存在化学键。(3)原子轨道在空间都具有方向性。( )提示 s轨道与s轨道重叠形成的共价键无方向性。(4)共价键只存在于非金属单质和共价化合物中。( )提示 某些离子化合物中也含有共价键,如NaOH、Na2O2等。
二、共价键的类型1.σ键和π键(1)分类依据:成键原子的原子轨道 方式。 (2)σ键和π键的比较:
2.极性键和非极性键
3.配位键(1)定义:由一个原子提供 与另一个 的原子形成的共价键。 (2)表示:配位键常用A→B表示,其中A是 的原子,B是 或提供空轨道的原子,
(3)以 为例探讨配位键的形成氮原子和氢原子形成氨分子时,氮原子提供 个未成对电子与 个氢原子形成3对共用电子对,还有1对电子未与其他原子共用,这对电子称为 。当氨分子遇到氢离子时,氨分子中的氮原子提供孤电子对与氢离子形成共价键,即氨分子中氮原子上的孤电子对所占据的轨道与氢离子的 空轨道发生重叠形成共价键,从而形成铵根离子。 微点拨 配位键与共价键形成的主要不同点:配位键的共用电子对是由某个原子提供,共价键的共用电子对是成键原子双方共同提供。
教材阅读 想一想自学教材“共价键的类型”。思考:一种物质中是否可以只含有π键,不含σ键?
提示 不可以。共价键中单键全部是σ键,双键和三键中也都有一个σ键。
易错辨析 判一判(1)s轨道只能参与形成σ键,不能参与形成π键。( )(2)两个原子间可以只形成σ键,但不能只形成π键。( )(3)C2H6和C2H4分子中共价键都是σ键。( )提示 C2H4分子的结构简式为CH2═CH2,分子中含有碳碳双键,碳碳双键中有一个σ键和一个π键。(4)1 ml丙酮(CH3COCH3)分子中含有σ键的数目为8×6.02×1023。( )提示 丙酮的结构式为 ,分子中含有6个C—H键、2个C—C σ键, C═O键中含有1个σ键和1个π键,故1 ml丙酮含有9 ml σ键。
探究 共价键的特征和类型
1.为了解释共价分子的结构,美国化学家路易斯于1916年提出了共价键的概念。他认为分子中原子间通过共用电子对使每个原子都达到稀有气体的稳定结构。路易斯的共价键概念初步解释了一些原子形成简单共价分子的过程及共价键与离子键的区别。
2.紫外线的光子所具有的能量约为399 kJ·ml-1。下表是有关蛋白质分子中重要化学键的信息:
防晒霜之所以能有效减少紫外线对人体的危害,是因为它所含的有效成分的分子中有π键,这些π电子可在吸收紫外线后被激发,从而阻挡部分紫外线对皮肤的伤害。
1.通过NH3、PCl5、Cl2分析,原子间通过共价键形成共价分子时,每个原子都一定能达到稀有气体的稳定结构吗?
2.根据上面信息分析人体长时间照射紫外线后皮肤易受伤害的原因。
提示 不一定。题给分子中NH3、Cl2原子间通过共价键使每个原子都达到稀有气体的稳定结构,但PCl5中,P原子本身最外层有5个电子,与5个Cl原子结合形成共用电子对,则P原子最外层达到10电子结构,不是稀有气体的稳定结构。
提示 紫外线具有的能量比蛋白质分子中主要化学键C—C键、C—N键和C—S键的键能都大,紫外线的能量足以使这些化学键断裂,从而破坏蛋白质分子,导致人体皮肤受到伤害。
3.下列哪种物质可能成为防晒霜的有效成分?a.乙醇b.乙醚(C2H5OC2H5)c.氯仿
提示 选d。乙醇、乙醚和氯仿分子中都只有单键,均为σ键,不能阻挡紫外线;对氨基苯甲酸的苯环、羧基中的碳氧双键均含有π键,因此可能成为防晒霜的有效成分。
1.共价键的特征:饱和性和方向性。2.共价键的分类
3.典型有机物的化学键类型(1)乙烷、乙烯、乙炔中的化学键
(2)苯的化学键苯的分子式是C6H6,结构简式为 ,苯分子中的每个碳原子都分别与1个氢原子、2个碳原子形成σ键,共12个σ键;同时每个碳原子各有一个垂直于分子平面的p轨道,形成了一个以6个碳原子为中心的π键(称为大π键)。苯的这种结构,使任意两个相邻碳原子间形成的共价键的键能和键长完全相同。
4.物质类别与化学键的关系
视角1 共价键的形成1.下列不属于共价键成键因素的是( )A.共用电子在两个原子核之间高概率出现B.成键原子的原子轨道发生重叠C.形成化学键,体系能量降低,趋于稳定D.两原子体积大小要适中
解析 形成共价键时,原子轨道在两个原子核间重叠,电子在两个原子核之间出现的概率增大,使得它们同时受到两个原子核的吸引,从而导致体系能量降低,稳定性增强,但对成键原子体积的大小没有要求。综上所述,D项符合题意。
视角2 共价键的特征2.下列说法正确的是( )A.若把H2S分子写成H3S分子,违背了共价键的饱和性B.H3O+的存在,说明共价键不应有饱和性C.所有共价键都有方向性D.两个原子轨道发生重叠后,两核间的电子仅存在于两核之间
解析 S原子的最外层有6个电子,故其只能形成两个共用电子对,若把H2S分子写成H3S分子,违背了共价键的饱和性,A正确;H3O+中含有配位键,是水分子与H+通过配位键形成的,与共价键的饱和性并不矛盾,B不正确;氢原子的电子云是球形的,氢气分子中的共价键没有方向性,C不正确;两个原子轨道发生重叠后,两核间的电子不仅可以在两核之间运动,也可以在其中任何一个原子核周围运动,D不正确。
视角3 共价键的类型3.有下列十种物质:①NH4Cl ②CH3CH2OH ③N2 ④HCl ⑤CO2 ⑥CH3CH3 ⑦C2H4 ⑧C2H2 ⑨H2O2 ⑩HCHO。请按要求回答下列问题(填写编号):(1)只有σ键的有 ,既有σ键又有π键的有 ,其中σ键和π键个数之比为1∶1的物质为 。 (2)只含有极性键不含其他价键的物质有 ,只含有非极性键的物质有 ,含有配位键的化合物有 。 (3)含有双键的有 ,含有三键的有 。 (4)写出下列物质的电子式:① ,③ ,⑦ 。
答案 (1)②④⑥⑨ ③⑤⑦⑧⑩ ⑤(2)④⑤⑩ ③ ① (3)⑤⑦⑩ ③⑧
解析 NH4Cl为离子化合物,其余九种物质的结构式分别为
根据以下三点判断化学键类型:①单键只有σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键;②两个同种元素原子之间形成的共价键是非极性键,两个不同种元素原子之间形成的共价键是极性键;③NH4Cl为离子化合物,含有极性共价键、配位键和离子键。
【变式设问】(1)1 ml HCHO中含有的σ键数目为多少?
(2)一个N2分子和一个乙炔分子中含有的π键个数是否相等?
提示 3×6.02×1023。1个HCHO分子内含有1个碳氧双键和2个碳氢键,1个双键中含有1个σ键、1个π键,碳氢键为σ键,则1 ml HCHO中含有3 ml σ键,即σ键的数目为3×6.02×1023。
提示 相等。一个N2分子和一个乙炔分子均含有2个π键。
4.[2023河北邢台高二期末]下列关于σ键和π键的说法中错误的是( )A.s-s σ键与s-p σ键的电子云形状的对称性相同B.所有的σ键的强度都比π键的大C.H原子只能形成σ键而O原子可以形成σ键和π键D.在H2O2中只有σ键没有π键
解析 s能级电子云是球形,p能级电子云是纺锤形,但s-s σ键与s-p σ键的对称性相同,均为轴对称,A正确;并不是所有σ键的强度都比π键的大,如在N2中,σ键的强度比π键的小,B错误;氢原子的s轨道只能形成头碰头的σ键,氧原子的p轨道可以形成头碰头的σ键和肩并肩的π键,C正确;H2O2分子中只有单键,则只有σ键没有π键,D正确。
5.下列有关σ键和π键的判断不正确的是( )A.两个p轨道不能形成σ键,只能形成π键B.分子中含有共价键,则至少含有一个σ键C.已知乙烯的结构式为 ,则乙烯分子中存在5个σ键和1个π键D.乙烷分子中只存在σ键,即6个C—H键和1个C—C键都为σ键,不存在π键
解析 两个p轨道既能形成σ键,也能形成π键,A项不正确;含有共价键的分子中一定有σ键,可能有π键,如HCl、N2等,B项正确;共价双键中有一个σ键和一个π键,故乙烯分子中有4个C—H σ键,C═C键中有1个σ键、1个π键,C项正确;单键都为σ键,乙烷分子结构式为 ,其中6个C—H键和1个C—C键都是σ键,D项正确。
6.下列物质中,既含有极性键,又含有非极性键的是( )A.苯(C6H6)D.NH4Cl
解析 苯(C6H6)分子中含有碳氢极性键和碳碳非极性键,A正确;CO2分子中共价键为极性键,不存在非极性键,B错误;H2O中含O—H键,只含有极性键,所以C错误;NH4Cl中存在离子键、极性键和配位键,不存在非极性键,D错误。
人教版 (2019)选择性必修2第一节 共价键精品课件ppt: 这是一份人教版 (2019)选择性必修2第一节 共价键精品课件ppt,共18页。PPT课件主要包含了知识回顾,阳离子,得失电子,电子对共用,极性键和非极性键,离子键,共价键,共用电子对,共价键的定义,共价键的本质等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修2第三单元 共价键 共价晶体示范课ppt课件: 这是一份高中化学苏教版 (2019)选择性必修2第三单元 共价键 共价晶体示范课ppt课件,共23页。PPT课件主要包含了共价键的形成,共用电子对,非金属,共价键的特征,未成对电子,自旋方向相反,共价键的类型,头碰头,肩并肩,极性键和非极性键等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修2专题3 微粒间作用力与物质性质第三单元 共价键 共价晶体作业ppt课件: 这是一份高中化学苏教版 (2019)选择性必修2专题3 微粒间作用力与物质性质第三单元 共价键 共价晶体作业ppt课件,共21页。PPT课件主要包含了B级关键能力提升练,按要求填空,C级学科素养创新练等内容,欢迎下载使用。













