






高中化学人教版 (2019)必修 第一册第三节 氧化还原反应教课ppt课件
展开思考:这里面都涉及了初中学过的什么反应? 请写出高炉炼铁的主要方程式,并判断它的反应类型?
氧化反应——初三化学上册《氧气》
还原反应——初三化学上册《碳及其氧化物》
同时发生对立统一缺一不可
任务1:根据初中的氧化反应与还原反应的知识,分析以下反应
物质水平——得失氧的视角
氧化还原反应的定义 一种物质失去氧,必然有另一种物质得到氧。氧化反应和还原反应在同一个反应中同时发生的反应叫做氧化还原反应。
(得氧) 被氧化(氧化反应)
(失氧)被还原(还原反应)
(失氧) 被还原(还原反应)
思考:两个方程式有什么共同点?得失氧对物质性质自身有什么影响?
O的化合价均没有发生改变
1774年,拉瓦锡创立氧化学说(燃烧是物质与氧气的反应)推翻了流行千年的燃素说,以解释燃烧等实验现象,指出动物的呼吸实质上是缓慢氧化。
拉瓦锡 1743~1794 (法)
弗兰克兰 1825~1899(英)
1852年,弗兰克兰在研究金属有化合物时提出化合价概念,并逐步得到完善后,人们把化合价升高的反应叫做氧化反应,把化合价降低的反应叫做还原反应。
科学史话:氧化还原反应概念的发展
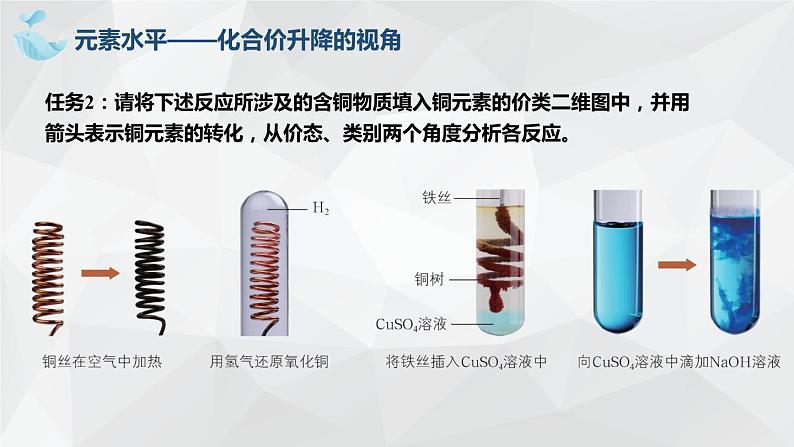
任务2:请将下述反应所涉及的含铜物质填入铜元素的价类二维图中,并用箭头表示铜元素的转化,从价态、类别两个角度分析各反应。
元素水平——化合价升降的视角
Fe + Cu2+ === Fe2++Cu
Cu2+ + 2OH === Cu(OH)2↓
宏观特征——化合价变化
任务:“铁单质置换铜”“金属铜在空气中加热”是大家熟悉的反应,请标注这两个反应中铜元素的化合价变化情况,并尝试用一定的方式或者化学用语呈现分析结果。
被______,发生______反应
思考:为什么氧化还原反应中会有元素化合价的升降变化呢?请结合初中学习过的原子结构示意图,以钠和氯气生成氯化钠反应为例分析。
化合价升高被氧化,发生氧化反应
化合价降低被还原,发生还原反应
结论:氧化还原反应的本质是-----电子的得失
结论:化合价升降的原因--共用电子对偏移
共用电子对偏向Cl,偏离H
0 0 +1 -1
电子对偏离,化合价升高,被氧化
电子对偏向,化合价降低,被还原
氧化还原反应的表征——线桥法
化合价升高,失去2e-,被氧化
Fe + Cu2+ === Fe2+ + Cu
化合价降低,得到2e-,被还原
练习:请分别用双线桥和单线桥法表征下面反应。
氧化还原反应的宏观特征
氧化还原反应的微观本质
电子的转移(电子得失或共用电子对偏移)
思考:氧化还原反应和四大反应之间有什么样的关系呢?
辩证思考:氧化还原反应进行的过程中真的有电子转移吗? 如何通过实验来证明氧化还原反应中存在电子转移? 实验器材和药品:铜丝、塑料带、锌片、烧杯、稀硫酸;
实验一:无明显现象实验二:锌片和铜丝表面均出现大量气泡 实验三:锌片表面有大量气泡产生
原因:铜丝中有电子定向移动,锌失去电子,电子移动到铜丝上。
结论:氧化还原反应中的确存在电子的转移
Zn + 2H+ = Zn2+ + H2↑
第2课时 氧化剂与还原剂
认识氧化剂和还原剂
Fe2O3+2Al Al2O3+2Fe 所属基本反应类型是________________。在该反应中_________元素的化合价升高,该元素的原子____________电子,被____________;而_________元素的化合价降低,该元素的原子____________电子,被____________。该反应中Fe2O3发生了____________反应,Al发生了____________反应。
+3 0 0 +3
注意:氧化剂、还原剂、氧化产物、还原产物都是指物质而不是元素。
得到电子(或电子对偏向)的物质。
失去电子(或电子对偏离)的物质。
在有些反应中,氧化剂和还原剂可能是同一种物质 氧化产物和还原产物也可能是同一种物质
还原剂:化合价升高→物质失电子→被氧化→还原性→氧化产物
氧化剂:化合价降低→物质得电子→被还原→氧化性→还原产物
【例2】下列说法正确的是( ) A. K2FeO4中Fe元素的化合价为+3价 B. C2O42-中C元素的化合价为+3价 C. 氧化剂本身被还原,生成氧化产物 D. 在一个反应中,氧化剂和还原剂不可能是同一物质
【例3】用双线桥法表示下列方程式电子转移的方向和数目,指出下列反应中的氧化剂、还原剂、氧化产物和还原产物。
MnO2+4HCl(浓) = MnCl2+Cl2↑ + 2H2O
Cl2+2NaOH = NaCl +NaClO+H2O
2H2S+SO2 = 3S↓ + 2H2O
【例2】用双线桥法表示下列方程式电子转移的方向和数目,指出下列反应中的氧化剂、还原剂、氧化产物和还原产物。
+4 -1 +2 0
该反应中,只有一部分氯原子化合价发生变化,还有一部分氯原子价态不变,故失去电子数为2×e-,而不是4×e-。
0 -1 +1
-2 +4 0
思考:氧化剂与还原剂一定是不同物质吗?氧化产物与还原产物一定是不同物质吗?
(氧化剂:CuSO4,还原剂:Fe,氧化产物:FeSO4,还原产物:Cu)
(氧化剂:MnO2,还原剂:HCl,氧化产物:Cl2,还原产物:MnCl2)
(氧化剂:NO2,还原剂:NO2,氧化产物:HNO3,还原产物:NO)
(氧化剂:SO2,还原剂:H2S,氧化产物:S,还原产物:S)
(氧化剂:KMnO4,还原剂:KMnO4,氧化产物:O2,还原产物:K2MnO4和MnO2)
某种物质有两种“身份”
1.指出下列反应的氧化剂、还原剂、氧化产物和还原产物。
2.分析下列变化过程是氧化还是还原,再填空:
①Fe → FeCl2,需加_______剂,如____________②CuO→ Cu, 需加_______ 剂,如____________③HCl→ Cl2 ,是 _______ 反应,HCl是_______剂④HCl→ H2 ,是 ________ 反应,HCl是_______剂⑤Fe3+→ Fe,需加________剂,Fe3+具有______性。
常见的氧化剂①活泼性较强的非金属单质:如Cl2、O2等。②变价元素的高价态化合物:如KMnO4、FeCl3、HNO3等。③过氧化物:如Na2O2、H2O2等。④其他:如HClO、漂白粉[有效成分为Ca(ClO)2]、MnO2等。
过氧化氢(双氧水)
① 金属单质,如 Na,K,Zn,Fe 等。
② 某些非金属单质,如 H2,C,Si等。
③ 元素处于低化合价时的氧化物,如 CO,SO2 等。
④ 元素处于低化合价时的酸,如 HCl (浓),HBr,HI,H2S 等。
⑤ 元素处于低化合价时的盐,如 Na2SO3,FeSO4 等。
红酒中添加二氧化硫的原因:
红酒的某些成分在储存的过程中会被氧气氧化,而使红酒的口感变差。所以我们应该在红酒中加入一些什么剂呢?
二氧化硫就是这种加入的还原剂,所以我们说二氧化硫应该具有还原性
焦亚硫酸钾是用来代替二氧化硫的一种抗氧化剂
【变式】下列说法正确的是( ) A. Cr2O72- →CrO4-,实现该转化需加氧化剂 B. 3NO2+H2O=2HNO3+NO,NO2只发生氧化反应 C. KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O,反应中HCl只体现还原性 D. 2H2O+2Na=2NaOH+H2↑,反应中H2O被还原
化学人教版 (2019)第三节 氧化还原反应教课ppt课件: 这是一份化学人教版 (2019)第三节 氧化还原反应教课ppt课件,共1页。
人教版 (2019)必修 第一册第三节 氧化还原反应课前预习ppt课件: 这是一份人教版 (2019)必修 第一册第三节 氧化还原反应课前预习ppt课件,共15页。PPT课件主要包含了学习目标,氧化剂,还原剂,还原产物,氧化产物,价态规律,既有氧化性也有还原,补充说明,1高低规律,2归中律等内容,欢迎下载使用。
化学必修 第一册第三节 氧化还原反应多媒体教学ppt课件: 这是一份化学必修 第一册第三节 氧化还原反应多媒体教学ppt课件,共32页。PPT课件主要包含了为什么,化学反应的类型,基本反应类型,离子反应,非离子反应,还有什么反应类型呢,氧化反应,还原反应,物质得氧的反应,物质失氧的反应等内容,欢迎下载使用。













