

高中化学苏教版 (2019)必修 第二册第二单元 化学反应中的热练习题
展开一、单选题
1.下列反应既是氧化还原反应,又是符合图象的是反应的是
A.灼热的炭与CO2反应
B.Ba(OH)2·8H2O与NH4Cl反应
C.铝片与稀H2SO4反应
D.甲烷在O2中的燃烧反应
2.下列过程中,需吸收能量的是( )
A.H+H→H2B.天然气燃烧
C.I2→I+ID.S+O2→SO2
3.下列说法正确的是
A.一般的化合反应为放热反应,所以C和CO2反应放热
B.含有共价键的化合物一定是共价化合物
C.所有的燃烧反应、中和反应一定是放热反应
D.需要加热才能发生的化学反应一定是吸热反应
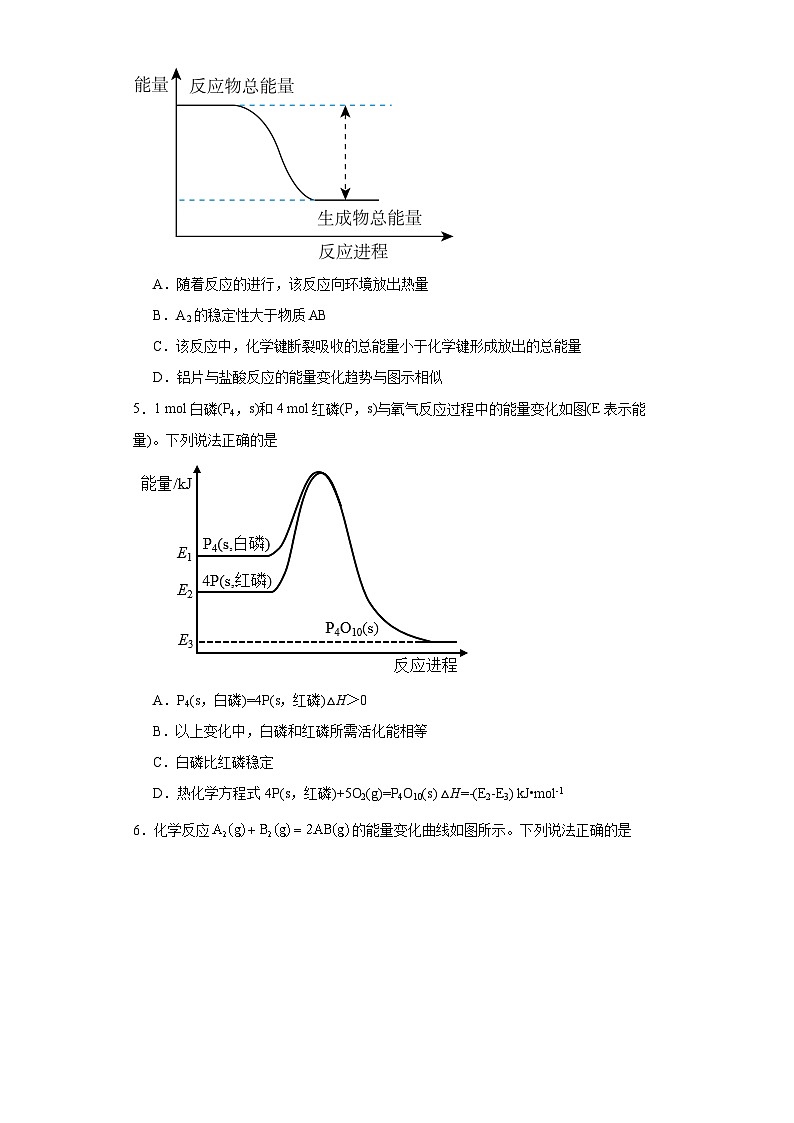
4.已知化学反应的能量变化如图所示,则有关说法错误的是
A.随着反应的进行,该反应向环境放出热量
B.A2的稳定性大于物质AB
C.该反应中,化学键断裂吸收的总能量小于化学键形成放出的总能量
D.铝片与盐酸反应的能量变化趋势与图示相似
5.1 ml白磷(P4,s)和4 ml红磷(P,s)与氧气反应过程中的能量变化如图(E表示能量)。下列说法正确的是
A.P4(s,白磷)=4P(s,红磷)△H>0
B.以上变化中,白磷和红磷所需活化能相等
C.白磷比红磷稳定
D.热化学方程式4P(s,红磷)+5O2(g)=P4O10(s) △H=-(E2-E3) kJ•ml-1
6.化学反应的能量变化曲线如图所示。下列说法正确的是
A.该反应为放热反应
B.三种物质中的能量最高
C.该反应生成,需吸收能量
D.断裂键和键时放出能量
7.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的,如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。则下列说法正确的是
A.通常情况下,NO比N2稳定
B.通常情况下,N2(g)和O2(g)混合能直接生成NO
C.1mlN2(g)和1mlO2(g)反应吸收的能量为180kJ
D.1mlN2(g)和1mlO2(g)具有的总能量大于2mlNO(g)具有的总能量
8.利用固体表面催化工艺进行NO分解的过程如图所示。
下列说法不正确的是
A.NO是无色有毒气体B.催化剂能改变NO的分解速率
C.NO分解生成和D.过程②释放能量,过程③吸收能量
9.下列过程中能量变化与如图所示能量变化不相符的是
A.浓硫酸的稀释B.生石灰溶于水中
C.铝与稀硫酸的反应D.稀盐酸与碳酸氢钠的反应
10.石墨在一定条件下可转化为金刚石,12g石墨完全转化为金刚石时,吸收热量,下列说法正确的是
A.石墨不如金刚石稳定
B.金刚石与石墨的结构是相同的
C.等质量的石墨与金刚石完全燃烧,金刚石放出的热量多
D.等物质的量的石墨与金刚石完全燃烧,石墨放出的热量多
二、填空题
11.化学反应的本质是有新物质生成,物质的变化是化学反应的基本特征之一;化学反应的另一基本特征是 ,通常表现为 的释放或吸收。
12.(I)回答下列问题:
(1)下列反应中,属于放热反应的是 (填序号,下同),属于吸热反应的是 。
①物质燃烧 ②二氧化碳通过炽热的碳 ③氢氧化钠溶于水的过程 ④炸药爆炸 ⑤碳酸钙高温分解
(II)表中的数据是破坏1ml物质中的化学键所消耗的能量(kJ)。
根据上述数据回答下列问题:
(2)下列物质本身具有的能量最低的是 。
A.H2B.Cl2C.Br2D.I2
(3)下列氢化物中,最稳定的是 。
A.HFB.HClC.HBrD.HI
(4)X2+H22HX(X代表Cl、Br、I)是 (填“吸热”或“放热”)反应。
(5)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是 。
13.回答下列问题:
(1)①已知断裂或形成1ml化学键所吸收或放出的能量叫做该化学键的键能,单位为。白磷在氧气中燃烧的化学方程式可用结构式表示如图:
根据下表中数据计算:(白磷)在氧气中充分反应 (填“吸收”或“放出”) kJ能量,在此过程中能量的转化形式为 。
②白磷在氧气中燃烧的能量变化可用图中的 (填字母)表示。
③已知在一定条件下,白磷转化为红磷释放能量,故白磷比红磷的稳定性 (填“强”或“弱”)。
(2)下列变化中属于放热反应的是 (填字母)
A.晶体与晶体的反应
B.镁条与二氧化碳反应
C.干冰升华为气体
D.碳酸钙高温煅烧
E.铝热反应
(3)根据下图所示的转化关系判断,生成放出 kJ能量。
14.化学反应伴随着能量变化是化学反应的基本特征之一。某同学进行如下实验,以检验化学反应中的能量变化。
请回答下列问题:
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是 热反应,Ba(OH)2·8H2O与NH4Cl的反应是 热反应。反应过程 (填“①”或“②”)的能量变化可用下图表示。
(2)①中发生反应的离子方程式是 ;在该反应中,作为还原剂的物质是 (填化学式)。
15.已知H2 ( g ) + 1/2O2 ( g ) = H2O ( g ) ,反应过程中能量变化如图: 请回答下列问题:
(1)图中a,b分别代表什么意义?
a. ;b. 。
(2)该反应的∆H (填“< 0”或“> 0”)。
16.城市使用的燃料,现大多为煤气、液化石油气。煤气的主要成分是CO和H2的混合气体,它有煤炭与水蒸气在高温下反应制得,故又称水煤气。试回答:
(1)写出制取水煤气的主要化学方程式 ,该反应是 反应(填吸热、放热)。
(2)设液化石油气的主要成分为丁烷(C4H10),其充分燃烧后产物为CO2和H2O,试比较完全燃烧等质量的C4H10及CO所需的氧气的质量比(结果保留1位小数) 。
17.人们可以从不同的角度、不同的层面来认识物质的变化。请以2H2+O22H2O为例,谈谈你对化学变化的认识 。
18.利用如图装置可以很方便地测得某反应是放热反应还是吸热反应。回答下列问题:
(1)将铁片加入小试管内,然后注入足量的盐酸,有关反应的离子方程式是 ,小试管中看到的现象是 。
(2)弯管中A端液面 (填“上升”或“下降”),原因是 ;说明此反应是 (填“放热”或“吸热”)反应。
(3)由实验推知,FeCl2溶液和H2的总能量 (填“大于”、“小于”或“等于”)铁片和盐酸的总能量。
19.Ⅰ.(1)下列变化中属于吸热反应的是 (填字母序号)。
①液态水汽化②将胆矾加热变为白色粉末③苛性钠固体溶于水;④氯酸钾分解制氧气⑤生石灰跟水反应生成熟石灰⑥干冰升华
A.①② B.②④ C.③ D.①⑥
Ⅱ.蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。CH4(g)+2H2O(g)CO2(g)+4H2(g)。若1mlCH4气体完全反应时,吸收akJ热量。
(2)写出甲烷的结构式 。
(3)C=O的键能为 kJ/ml(用含a、b、c、d的式子表示)。
(4)恒温条件下,在体积恒为0.5L的密闭容器中通入一定量甲烷和水蒸气,发生上述反应.测得甲烷物质的量随时间变化如表所示。0~10min内用水蒸气的浓度变化表示该反应的平均速率为v(H2O)= 。
(5)若想加快该反应的速率,可采取的措施有 (任写一项即可)。
(6)恒温恒容情况下,下列叙述能说明此反应达到平衡状态的是 。
A.混合气体的平均相对分子质量保持不变
B.CO2和H2的体积分数比为1:4
C.混合气体的密度保持不变
D.生成1mlCO2的同时,有4mlH—H键断裂
20.已知下列热化学方程式:
① H2(g)+1/2O2(g)=H2O(l) ΔH=-285 kJ/ml
② H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/ml
③ C(s)+1/2O2(g)=CO(g) ΔH=-241.8 kJ/ml
④ C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/ml
回答下列各问题:
(1)上述反应中属于放热反应的是 。
(2)H2的燃烧热为 ;C的燃烧热为 。
(3)燃烧10 g H2生成液态水,放出的热量为 。
(4)CO的燃烧热为 ;其热化学方程式为 。
三、实验探究题
21.为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:
(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是 。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是 ,说明该反应属于 (填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是 ;
②若观察到烧杯里产生气泡,则说明M溶于水 (填“一定是放热反应”、“一定是吸热反应”或“可能是放热反应”),理由是 。
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2 + 2H2O= 4KOH + 3O2↑)是放热反应。
方法①:选择上述装置 (填“Ⅰ”、“Ⅱ”或“Ⅲ”)进行实验。
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到 ,则说明该反应是放热反应。
22.研究化学反应中的能量变化时,在一只小烧杯里,加入20 g已研磨成粉末的Ba(OH)2·8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10 g NH4Cl晶体,根据下图所示实验步骤进行操作。回答下列问题:
(1)写出实验过程中发生反应的化学方程式: 。
(2)检验有NH3生成的方法是 。
(3)反应中产生的NH3会污染环境,对人体有害。为减少其挥发,实验时在烧杯上方盖了一个多孔塑料板,反应后移走多孔塑料板,发现混合物成糊状,证明有 生成。为了更好的解决NH3的污染问题,可以做一个简单的改进,你的改进方法是 。
23.(一)下列反应中,能量变化符合图 1 的有 (填序号,下同),符合图 2 的有 。
①煅烧石灰石 ②木炭燃烧 ③炸药爆炸 ④酸碱中和 ⑤碳与二氧化碳高温反应 ⑥食物因氧化而腐败
(二)为了探究化学能与热能的转化,某实验小组设计了如下图(I、II、III)三套实验装置:
(1)某同学选用装置I进行实验(实验前 U 形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U 形管中可观察到的现象是 。
(2)为探究固体 M 溶于水的热效应,选择装置II进行实验(反应在甲中进行)。
①观察到烧杯里产生气泡,则可推出 M 溶于水 是放热反应(填“一定”或“可能” ),理由是 ;
②若观察到烧杯里的玻璃管内形成一段水柱,则 M 可能是 。
(3)至少有两种实验方法能证明超氧化钾与水的反应(4KO2+2H2O=4KOH+3O2↑)是放热反应还是吸热反应。
方法①:选择上述装置 (填 “I”或“III”)进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是 反应。
物质
Cl2
Br2
I2
H2
能量/kJ
243
193
151
436
物质
HF
HCl
HBr
HI
能量/kJ
568
432
366
298
化学键
键能/
198
360
498
585
化学键
C—H
H—H
H—O
键能kJ/ml
b
c
d
时间/min
0
10
20
40
50
60
n(CH4)/ml
0.50
0.35
0.25
0.10
0.10
0.10
参考答案:
1.A
【分析】生成物能量大于反应物能量,表示吸热反应。
【详解】A.灼热的炭与CO2的反应既属于氧化还原反应,又是吸热反应,A正确;
B.Ba(OH)2•8H2O与NH4Cl的反应属于吸热反应但是不是氧化还原反应,B错误;
C.铝片与稀H2SO4反应是氧化还原反应,又是放热反应,C错误;
D.甲烷在氧气中的燃烧属于放热反应,也是氧化还原反应,D错误;
故选A。
2.C
【详解】A.形成氢氢键,放出热量,选项A不符合;
B.天然所燃烧,放出热量,选项B不符合;
C.碘碘键的断裂需要吸收能量,选项C符合;
D.硫与氧气的化合相当于燃烧反应,放出热量,选项D不符合。
答案选C。
3.C
【详解】A. 一般的化合反应为放热反应,但C和CO2反应吸热,A错误;
B. 含有共价键的化合物不一定是共价化合物,例如NaOH中含有共价键,是离子化合物,B错误;
C. 所有的燃烧反应、中和反应一定是放热反应,C正确;
D. 需要加热才能发生的化学反应不一定是吸热反应,例如木炭燃烧等,D错误;
答案选C。
【点睛】选项C是解答的易错点,注意反应是放热还是吸热与反应条件没有关系,只与反应物总能量和生成物总能量的相对大小有关。
4.B
【详解】A.该反应为放热反应,随着反应的进行,该反应向环境释放热量,故A正确;
B.能量越低越稳定,反应物的总能量比生成物的能量高,但是A2的能量的大小无法与AB能量比较,所以稳定性无法比较,故B错误;
C.化学键断裂吸收能量,化学键形成释放能量,该反应为放热反应,故放出的总能量大于吸收的总能量,故C正确;
D.图示是放热反应,铝片与盐酸的反应为放热反应,符合图中的能量变化,故D正确。
答案为:B。
5.D
【详解】A.由图示可知1 ml白磷的能量比4 ml红磷的能量高,因此白磷转化为等质量的红磷时,释放能量,则P4(s,白磷)=4P(s,红磷)△H<0,A错误;
B.根据图示可知:红磷的活化能比白磷的活化能高,故在以上变化中,白磷和红磷所需活化能不相等,B错误;
C.物质含有的能量越低,物质的稳定性就越强。由图可知白磷的能量比等质量的红磷能量高,因此红磷比白磷稳定,C错误;
D.红磷燃烧反应是放热反应,则其反应的热化学方程式为:4P(s,红磷)+5O2(g)=P4O10(s) △H=-(E2-E3) kJ•ml-1,D正确;
故合理选项是D。
6.C
【详解】A.该反应反应物的能量小于生成物的能量,是吸热反应,A错误;
B.由图可知,2mlAB(g)的能量高于1mlA2(g)和1mlB2(g)的总能量,但是1mlAB的能不一定比1mlA2(g)或1mlB2(g)高,B错误;
C.根据物质变化能图,该反应生成2mlAB吸收(a-b) kJ能量,C正确;
D.断键是吸热过程,应该吸收能量,D错误;
故选C。
7.C
【详解】A. N2键能为946kJ/ml,NO键能为632kJ/ml,键能越大,越稳定,则通常情况下,N2比NO稳定,选项A错误;
B. 通常情况下,N2(g)和O2(g)混合反应生成NO需要一定的条件,不能直接生成NO,选项B错误;
C. 断开化学键需要吸收能量为946kJ/ml+498kJ/ml=1444kJ/ml,形成化学键放出的能量为2×632kJ/ml=1264kJ/ml,则1ml N2(g)和1ml O2(g)反应吸收的能量为(1444-1264)kJ=180kJ,则1ml N2(g)和1ml O2(g)反应吸收的能量为180kJ,选项C正确;
D. 吸收能量为1444kJ/ml,放出的能量为1264kJ/ml,说明该反应是吸热反应,1ml N2(g)和1ml O2(g)具有的总能量小于2ml NO(g)具有的总能量,选项D错误,
答案选C。
8.D
【详解】A.NO是一种无色无味、难溶于水、有毒的气体,A正确;
B.图示过程为NO分解生成N2和O2的过程,催化剂可以加快NO的分解速率,B正确;
C.图示过程为NO分解生成N2和O2的过程,C正确;
D.过程②中,2个NO分子转化为2个N原子和2个O原子,发生了化学键的断裂,该过程需要吸收能量;过程③中,2个N原子结合生成1个N2分子,2个O原子结合生成1个O2分子,涉及了化学键的生成,该过程释放能量,D错误;
故选D。
9.D
【分析】如图所示为酒精灯的燃烧,为放热反应,以此解题。
【详解】A.浓硫酸稀释过程放热过程,不符合题意,A错误;
B.生石灰与水反应生成熟石灰,为放热反应,不符合题意,B错误;
C.铝与稀硫酸的反应为放热反应,不符合题意,C错误;
D.盐酸与碳酸氢钠的反应是吸热反应,符合题意,D正确;
故选D。
10.C
【详解】A.由题意可知,石墨在一定条件下可转化为金刚石的反应为反应物总能量小于生成物总能量的吸热反应,物质的能量越高越不稳定,则石墨的稳定性强于金刚石,故A错误;
B.金刚石与石墨是碳元素形成的不同种单质,结构不同、性质不同,故B错误;
C.由题意可知,石墨在一定条件下可转化为金刚石的反应为反应物总能量小于生成物总能量的吸热反应,所以等质量的石墨与金刚石完全燃烧,金刚石放出的热量多,故C正确;
D.由题意可知,石墨在一定条件下可转化为金刚石的反应为反应物总能量小于生成物总能量的吸热反应,所以等质量的石墨与金刚石完全燃烧,金刚石放出的热量多,故D错误;
故选C。
11. 能量变化 热量
【详解】化学反应的本质是有新物质生成,物质的变化是化学反应的基本特征之一,物质在发生化学反应时会有化学键的断裂与形成,断裂反应物的化学键会吸收能量,生成生成物的化学键又会释放能量,因此化学反应的另一基本特征是能量变化,通常表现为热量的释放或吸收。
12.(1) ①④ ②⑤
(2)A
(3)A
(4)放热
(5)Cl2
【详解】(1)①物质燃烧放出大量热,为放热反应;
②二氧化碳通过炽热的碳,二氧化碳与碳高温生成一氧化碳,为吸热反应;
③氢氧化钠溶于水的过程,会放出热量,但没产生新物质,是物理变化;
④炸药爆炸,放出大量的热,为放热反应;
⑤碳酸钙高温分解生成氧化钙和二氧化碳,为吸热反应;
综上分析,属于放热反应的是①④,属于吸热反应的是②⑤。
(2)A.根据表中数据可知,破坏1mlH2中的化学键所消耗的能量为436kJ;
B.根据表中数据可知,破坏1mlCl2中的化学键所消耗的能量为243kJ;
C.根据表中数据可知,破坏1mlBr2中的化学键所消耗的能量为193kJ;
D.根据表中数据可知,破坏1mlI2中的化学键所消耗的能量为151kJ;
综上分析,破坏1mlH2中的化学键所消耗的能量最高,则说明氢气很稳定,具有的能量最低,答案选A。
(3)A.根据表中数据可知,破坏1mlHF中的化学键所消耗的能量为568kJ;
B.根据表中数据可知,破坏1mlHCl中的化学键所消耗的能量为432kJ;
C.根据表中数据可知,破坏1mlHBr中的化学键所消耗的能量为366kJ;
D.根据表中数据可知,破坏1mlHI中的化学键所消耗的能量为298kJ;
综上分析,破坏1mlHF中的化学键所消耗的能量最高,则说明HF很稳定,答案选A。
(4)若X2为Cl2,则旧键断裂吸收的能量为:436kJ+243kJ=679kJ,新键形成释放的能量为:2432kJ=864kJ,反应放出热量864kJ-679kJ=185kJ;
若X2为Br2,则旧键断裂吸收的能量为:436kJ+193kJ=629kJ,新键形成释放的能量为:2366kJ=732kJ,反应放出热量732kJ-629kJ=103kJ;
若X2为I2,则旧键断裂吸收的能量为:436kJ+151kJ=587kJ,新键形成释放的能量为:2298kJ=596kJ,反应放出热量596kJ-587kJ=9kJ;
综上分析,三个反应均为放热反应。
(5)1mlH2与1mlCl2恰好完全反应生成2mlHCl,断裂1mlH-H键和1mlCl-Cl键吸收436kJ+243kJ=679kJ的能量,形成2mlH-Cl键释放2432kJ=864kJ的能量,则反应放出864kJ-679kJ=185kJ的热量;
1mlH2与1mlBr2恰好完全反应生成2mlHBr,断裂1mlH-H键和1mlBr-Br键吸收436kJ+193kJ=629kJ的热量,形成2mlH-Br键释放2366kJ=732kJ的热量,则反应放出732kJ-629kJ=103kJ的热量;
1mlH2与1mlI2恰好完全反应生成2mlHI,断裂1mlH-H键和1mlI-I键吸收436kJ+151kJ=587kJ的热量,形成2mlH-I键释放2298kJ=596kJ的热量,则反应放出596kJ-587kJ=9kJ的热量;
综上分析,消耗等物质的量的H2时,放出热量最多的为Cl2。
13.(1) 放出 298.2 化学能转化成热能 a 弱
(2)BE
(3)45.5
【详解】(1)①1ml白磷在氧气中燃烧断键吸收的总能量为198×6+498×5=3678kJ,成键放出的总能量为585×4+360×12=6660kJ,(白磷)在氧气中充分反应放出(6660-3678)×0.1=298.2kJ能量,在此过程中能量的转化形式为化学能转化为热能;
②白磷在氧气中燃烧是放热反应,能量变化可用图a表示。
③能量越低越稳定,白磷转化为红磷释放能量,红磷能量低,白磷比红磷的稳定性弱。
(2)A.晶体与晶体的反应吸收能量,属于吸热反应,故不选A;
B.镁条在二氧化碳中燃烧生成氧化镁和碳,反应放出能量,属于放热反应,故选B;
C.干冰升华为气体,属于物理变化,故不选C;
D.碳酸钙高温煅烧生成氧化钙和二氧化碳,反应吸热,属于吸热反应,故不选D;
E.铝热反应放出大量的热,属于放热反应,故选E;
选BE。
(3)的物质的量为=0.5ml,根据图示的转化关系,生成1ml液体甲醇放出91kJ的能量,生成0.5mlCH3OH放出91×0.5=45.5kJ能量。
14. 放 吸 ① 6H++2Al===2Al3++3H2↑ Al
【详解】(1)本题考查化学反应中能量变化,反应①:反应后温度升高,说明是放热反应,即铝和盐酸反应属于放热反应,反应②:反应温度降低,此反应是吸热反应,即Ba(OH)2·8H2O和NH4Cl属于吸热反应,反应物总能量大于生成物总能量,说明此反应是放热反应,即属于①;
(2)考查离子反应方程式的书写和氧化还原反应概念,反应①的离子方程式为2Al+6H+=2Al3++3H2↑,化合价升高的物质是还原剂,即Al是还原剂。
15.(1) 活化能 焓变
(2)<
【分析】依据化学反应的反应热可以根据反应的实质,断裂化学键吸收能量,生成化学键放出能量,二者的差值是反应的焓变;依据反应物和生成物的能量高低和反应的能量守恒分析判断。
【详解】(1)图象中可以分析判断,a为拆化学键吸收的能量,即反应的活化能;b为反应生成化学键放出的热量减去反应断裂化学键吸收的热量,即反应的焓变;
故答案为活化能,焓变;
(2)反应物的能量高于生成物的能量,依据化学反应的能量守恒,反应是放热反应,焓变小于0;
故答案为<。
【点睛】本题考查了化学反应的热效应的实质和计算方法,反应的能量守恒是解题关键,题目较简单。
16.(1) C+H2OCO+H2 吸热
(2)6.3:1
【详解】(1)根据信息,将煤(主要成分是碳)在高温条件下与水蒸气反应,制得水煤气CO和H2的混合气体),即制取得到水煤气,该反应的化学方程式为:C+H2OCO+H2,该反应发生时吸收热量,因此该反应是吸热反应;
(2)丁烷燃烧的化学方程式为2C4H10+13O28CO2+10H2O,根据方程式可知:2 ml丁烷即116 g丁烷完全燃烧消耗13 ml O2,则1 g丁烷燃烧消耗O2的物质的量是n(O2)=;CO燃烧的化学方程式为:2CO+O22CO2,根据方程式可知:2 mlCO即56 gCO完全燃烧消耗1 ml O2,则1 gCO燃烧消耗O2的物质的量是n(O2)=,故等质量的丁烷和CO完全燃烧消耗O2的物质的量的比为::==6.3:1。根据物质的量比质量关系式m=n·M可知气体的质量比等于气体的物质的量的比,故燃烧等质量的C4H10及CO所需的氧气的质量比为6.3:1。
17.反应过程中有新物质的生成;原子进行重新排列组合;有旧键断裂,新键形成;同时伴随着能量变化
【详解】从宏观分析:反应过程中有新物质生成,氢气与氢气反应转化生成新物质水;从微观角度:2个氢气分子与1个氧气分子中原子重新排列组合生成2个水分子;从化学键角度:反应中既有旧键H-H、O=O断裂、又有新键H-O键的形成;在物质变化的过程中,伴随着能量变化,反应过程氢气与氧气反应生成水的过程中放出了热量。故答案为:反应过程中有新物质的生成;原子进行重新排列组合;有旧键断裂,新键形成;同时伴随着能量变化。
18.(1) Fe+2H+=Fe2++H2↑ 剧烈反应,有大量气泡产生,溶液变为浅绿色
(2) 下降 反应放热使锥形瓶内气体温度升高,压强增大,从而使A端液面下降 放热
(3)小于
【详解】(1)铁片与盐酸反应的离子方程式为Fe+2H+=Fe2++H2↑,因此反应现象为剧烈反应,有大量气泡产生,溶液变为浅绿色;
(2)铁片与盐酸的反应为放热反应,反应放出的热量使气体膨胀,使U形管液面A下降;
(3)铁片与盐酸的反应为放热反应,反应物的总能量高于产物的总能量,即FeCl2溶液和H2的总能量低于铁片和盐酸的总能量。
19. B 2b+2d-2c- 0.06ml·L-1·min-1 升温(或加压或采用合适的催化剂) AD
【详解】(1)吸热过程或放热过程与吸热反应或放热反应不同:
①水汽化是物理变化,不属于吸热反应,故①错误;
②CuSO4·5H2O受热分解生成CuSO4和H2O,属于吸热反应,故②正确;
③苛性钠固体溶于水是放热过程,属于物理变化,故③错误;
④氯酸钾分解制氧气属于吸热反应,故④正确;
⑤生石灰跟水反应生成熟石灰是化合反应,属于放热反应,故⑤错误;
⑥干冰升华为物理变化,故⑥错误;
正确的为②④;答案选B;
(2)甲烷为CH4,属于共价化合物,分子中C原子与H原子之间形成1对共用电子对,其结构式为;
(3)设C=O的键能为x,根据反应CH4(g)+2H2O(g)CO2(g)+4H2(g)的焓变及和各化学键键能可知4b+4d-2x-4c=a,故x=2b+2d-2c- kJ/ml;
(4)0~10min内△n(CH4)=0.50ml-0.35ml=0.15ml,根据反应方程式可知该时段内△n(H2O)=0.30ml,容器的容积为0.5L,所以v(H2O)==0.06ml·L- 1·min-1;
(5)若想加快该反应的速率,可采取的措施有升温(或加压或采用合适的催化剂);
(6)A.该反应中反应物和生成物均为气体,所以未平衡时气体的总质量不发生改变,该反应前后气体系数之和不相等,所以未平衡时气体的总物质的量改变,则平均相对分子质量会发;生改变,当该值不变时说明反应平衡,选项A符合题意;
B.反应过程中可能出现CO2和H2的体积分数比为1:4,但这不能说明气体的浓度不再改变,故不能说明反应达到平衡,选项B不符合题意;
C.该反应中反应物和生成物均为气体,所以未平衡时气体的总质量不发生改变,容器恒容,则混合气体的密度一直不变,选项C不符合题意;
D.CO2生成表示正反应,H-H键断裂表示逆反应,1ml CO2生成的同时有4ml H-H键断裂也即正反应速率与逆反应速率相等,说明反应达到平衡,选项D符合题意;
答案选AD。
20. ①②③④ 285 kJ/ml 393.5 kJ/ml 1425 kJ 151.7 kJ/ml CO(g)+1/2O2(g)===CO2(g);ΔH=-151.7 kJ/ml
【详解】(1)热化学方程式中△H为负值的反应为放热反应,△H为正值的为吸热反应:①H2(g)+O2(g)=H2O(l)△H=-285kJ•ml-1,②H2(g)+ O2(g)=H2O(g)△H=-241.8kJ•ml-1,③C(s)+ O2(g)=CO(g)△H=-110.5kJ•ml-1,④C(s)+O2(g)=CO2(g)△H=-393.5kJ•ml-1,以上4个反应均为放热反应,故答案为①②③④;
(2)1ml纯净物完全燃烧生成稳定的氧化物所放出的热量为燃烧热,H2的燃烧热为285 kJ•ml-1,C的燃烧热为393.5kJ/ml,故答案为285kJ•ml-1;393.5kJ/ml;
(3)依据反应①进行计算燃烧10g H2生成液态水放出的热量;
H2(g)+ O2(g)=H2O(l)△H=-285.8kJ•ml-1
2g 285kJ
10g Q
Q==1425kJ,故答案为1425 kJ;
(4)③ C(s)+1/2O2(g)=CO(g) ΔH=-241.8 kJ/ml,④ C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/ml,根据盖斯定律,将④-③得:CO(g)+1/2O2(g)===CO2(g);ΔH=-151.7 kJ/ml,故答案为151.7 kJ/ml;CO(g)+1/2O2(g)===CO2(g);ΔH=-151.7 kJ/ml。
21.(1)III
(2) 左端液柱降低,右端液柱升高 放热
(3) 产生气泡,反应完毕后,冷却至室温,烧杯里的导管内形成一段液柱 可能是放热反应 有热量放出不一定为化学变化,所以不一定属于放热反应,也可能是反应产生气体
(4) Ⅰ(或Ⅱ) 棉花燃烧
【详解】(1)装置Ⅰ可通过U形管中红墨水液面的变化判断铜与浓硝酸的反应是放热还是吸热;装置Ⅱ可通过烧杯中是否产生气泡判断铜与浓硝酸的反应放热还是吸热;装置Ⅲ只是一个铜与浓硝酸反应并将生成的气体用水吸收的装置,不能证明该反应是放热反应还是吸热反应;
(2)氢氧化钡与硫酸反应属于中和反应,中和反应都是放热反应,所以锥形瓶中气体受热膨胀,导致U形管左端液柱降低,右端液柱升高;
(3)①若M为钠,钠与水反应生成氢氧化钠和氢气,反应完毕后,冷却至室温,烧杯里的导管内形成一段液柱,故答案为产生气泡,反应完毕后,冷却至室温,烧杯里的导管内形成一段液柱;
②若观察到烧杯里产生气泡,说明M溶于水可能放出热量,有热量放出不一定为化学变化,所以不一定属于放热反应,也可能是反应产生气体;
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2+2H2O═4KOH+3O2↑)是放热反应还是吸热反应:方法①:选择上述装置Ⅰ(或Ⅱ)进行实验,Ⅰ装置右边U形管中左端液柱降低,右端液柱升高(或烧杯中导管中有气泡放出),证明该反应为放热反应;故答案为Ⅰ(或Ⅱ);
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应放出大量热,使棉花燃烧,证明该反应是放热反应。
22.(1)Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
(2)在烧杯上方放一张湿润的红色石蕊试纸,试纸变蓝,证明有氨气生成。或用蘸有浓盐酸的玻璃棒放在烧杯上方,看到白烟,证明有氨气生成
(3) 水 用浸有稀硫酸的棉花覆盖在多孔塑料片上来吸收产生的NH3
【分析】Ba(OH)2·8H2O与氯化铵混合反应探究反应的热效应,进行分析解答;
【详解】(1)氢氧化钡晶体与氯化铵晶体在常温下反应生成氯化钡、氨气、水,化学方程式是Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O;
(2)氨气的检验可用湿润的红色石蕊试纸,在烧杯上方放一张湿润的红色石蕊试纸,试纸变蓝,证明有氨气生成。或用蘸有浓盐酸的玻璃棒放在烧杯上方,挥发的氨气和氯化氢结合生成氯化铵固体,会看到白烟,证明有氨气生成;
(3)反应后晶体为糊状,说明反应中有水生成;为了防止氨气污染空气,可用酸吸收产生的氨气,用浸有稀硫酸的棉花覆盖在多孔塑料片上来吸收产生的NH3;或在通风厨内进行实验。
23. ②③④⑥ ①⑤ 左端液柱降低,右端液柱升高 可能 有热量放出不一定为化学变化,所以不一定属于放热反应 硝酸铵、氯化铵 I 放热
【详解】(一)①煅烧石灰石为吸热反应;
②木炭燃烧为放热反应;
③炸药爆炸为放热反应;
④酸碱中和反应为放热反应;
⑤碳与二氧化碳高温反应为吸热反应;
⑥食物因氧化而腐败为放热反应;
图1所示的反应为放热反应,能量变化符合图1的有②③④⑥;图2所示为吸热反应,符合图2的有①⑤;
(二)(1)氢氧化钡与稀硫酸发生中和反应会放出热量,使锥形瓶中的液体受热膨胀,所以会使U形管中左端液柱降低,右端液柱升高;
(2)①有气泡产生,说明M溶于水放出热量,但不一定发生了化学反应,如NaOH固体溶液水放热,但为物理变化过程,吸热反应和放热反应均是指化学反应,所以M溶于水可能是放热反应,原因时:有热量放出不一定为化学变化,所以不一定属于放热反应;
②观察到烧杯里的玻璃管内形成一段水柱,说明M溶于水后导致大试管中温度降低,压强减小,证明M溶于水为吸热过程或与水反应为吸热反应,溶于水能够吸收热量的物质有:硝酸铵、氯化铵等;
(3)方法①:选择上述装置Ⅰ进行实验,Ⅰ装置右边U型管中左端液柱降低,右端液柱升高(或烧杯中导管中有气泡放出),证明该反应为放热反应;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应放出大量热,使棉花燃烧,证明该反应是放热反应。
【点睛】吸热反应和放热反应都是指化学变化,某些物理变化过程可能也会伴随热量的变化,但不能称为吸热反应或放热反应。
苏教版 (2019)必修 第二册专题6 化学反应与能量变化第二单元 化学反应中的热巩固练习: 这是一份苏教版 (2019)必修 第二册专题6 化学反应与能量变化第二单元 化学反应中的热巩固练习,共26页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第二册第二单元 化学反应中的热测试题: 这是一份高中化学苏教版 (2019)必修 第二册第二单元 化学反应中的热测试题,共15页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
苏教版 (2019)必修 第二册专题6 化学反应与能量变化第二单元 化学反应中的热同步达标检测题: 这是一份苏教版 (2019)必修 第二册专题6 化学反应与能量变化第二单元 化学反应中的热同步达标检测题,共14页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。













