


广东省深圳市宝安区2023-2024学年高二上学期期中考试化学试题(含答案)
展开
这是一份广东省深圳市宝安区2023-2024学年高二上学期期中考试化学试题(含答案),文件包含广东省深圳市宝安区2023-2024学年高二上学期期中考试化学试题docx、广东省深圳市宝安区2023-2024学年高二上学期期中考试化学试卷参考答案docx等2份试卷配套教学资源,其中试卷共8页, 欢迎下载使用。
(时间:75分钟,满分:100)
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷为1-16题,共44分;第Ⅱ卷为17-20题,共56分。
注意事项:
1、答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题纸上。
2、第Ⅰ卷、第Ⅱ卷均完成在答题纸上。
3、考试结束,监考人员将答题纸收回。
可能用到的原子量: H 1 C 12 N 14 O 16
第Ⅰ卷 (本卷共计44 分)
一、选择题(本题共16小题,每小题只有一个符合题意的选项,1~10题每小题2分,11~16题每小题4分,总共44分。)
1.2023年杭州亚运会秉承“绿色亚运”的理念。其使用“零碳甲醇”作为主火炬燃料,绿色零碳甲醇是利用焦炉气中的副产氢气和从工业尾气捕捉的二氧化碳合成。下列说法正确的是( )
A.火炬使用零碳甲醇,碳排放量为零,符合“碳中和”理念
B.石油、煤、水煤气可从自然界直接获取,属一次能源
C.亚运焰火的五颜六色是金属单质的焰色反应
D. CO2 + 3H2 = CH3OH + H2O,生成CH3OH反应的原子利用率为64%
2. 已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是285.8kJ·ml-1、1411.0kJ·ml-1和1366.8kJ·ml-1,则由
C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为( )
A.-44.2kJ·ml-1 B.+44.2kJ·ml-1
C.-330kJ·ml-1 D.+330kJ·ml-1
3. 下列实验操作会使结果偏低的是( )
A.测锥形瓶中NaOH浓度时,装标准液的酸式滴定管在使用前没有润洗就进行滴定实验
B.测锥形瓶中NaOH浓度时,滴定后仰视酸式滴定管进行读数
C.中和反应的ΔH的测定,用温度计测量盐酸温度后,未用水冲洗干净,就直接测量NaOH溶液的温度
D.标准盐酸滴定测量氨水的浓度时,用酚酞作指示剂
4.下列关于焓判据和熵判据的说法中,不正确的是( )
A.放热的自发过程可能是熵减小的过程,吸热的自发过程一定为熵增加的过程
B.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3kJ·ml-1, ΔS=-280.1J·ml-1·K-1。此反应在常温常压下能自发进行
C.碳酸钙分解为吸热反应,该反应室温下不能自发进行,但在高温下则能自发进行
D.吉布斯自由能大于0的反应一定不能发生
5.2A(g) 2B(g) + C(g) △H < 0 ,现欲使正反应速率减小,C的浓度增大,可行的措施是( )
A.加压 B.减压 C.减少C的浓度 D.降温
6.下列事实能用勒夏特列原理解释的是( )
A.对CO(g)+NO2(g)CO2(g)+NO(g)平衡体系,减小体积使压强增大混合气体颜色变深
B.氯水中存在下列平衡:Cl2+H2OHCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
C.合成氨中用铁触媒作催化剂提高氨的单位时间产量
D.升高温度有利于合成氨
7.下列说法正确的是( )
A.常温下醋酸分子不可能存在于pH >7的碱性溶液中
B.室温下pH=3的酸与pH=11的碱等体积混合后显酸性,则生成了一种强酸弱碱盐
C.在NH4Cl溶液中加入稀HNO3能抑制NHeq \\al(+,4)水解
D.某二元酸的酸式盐NaHA溶液中,一定存在:c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-)
8.下列实验操作规范且能达到目的的是( )
9.下列说法正确的是( )
A.恒温恒压,N2+3H22NH3达平衡时,各物质的物质的量均为1ml。再充3mlN2,平衡正向移动
B.常温下,pH=3的醋酸与pH=3的盐酸体积比1:2混合后,混合溶液的pH=3
C.一定温度下的密闭容器中,发生反应2Cu2O(s)+O2(g) 4CuO(s),达平衡时压强为P0,将容器体积减小至原来的一半,达到新的平衡时气体压强为P ,则P0 < P < 2P0
D.恒温恒体积的容器,对反应2NO2(g) N2O4(g),在一定条件下达到平衡。若增加NO2的物质的量,可使再次平衡时c(NO2)/c(N2O4)的值增大
10.室温下,取20mL pH=3的HNO2溶液,加入0.1ml/L的氨水,测得溶液的导电能力随加入氨水体积的变化如图所示,则室温下HNO2的电离平衡常数约为( )
A.2.0×10﹣5 B.1.0×10﹣6
C.1.0×10﹣5 D.2.0×10﹣4
11.可逆反应2NO2(g) 2NO(g) + O2(g)在体积不变的容器中进行,达到平衡状态的标志是( )
①单位时间内生成n ml O2的同时,生成2n mlNO2;
②单位时间内生成n ml O2的同时,生成2n ml NO;
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态;
④混合气体的颜色不再发生改变的状态;
⑤混合气体的密度不再改变的状态;
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
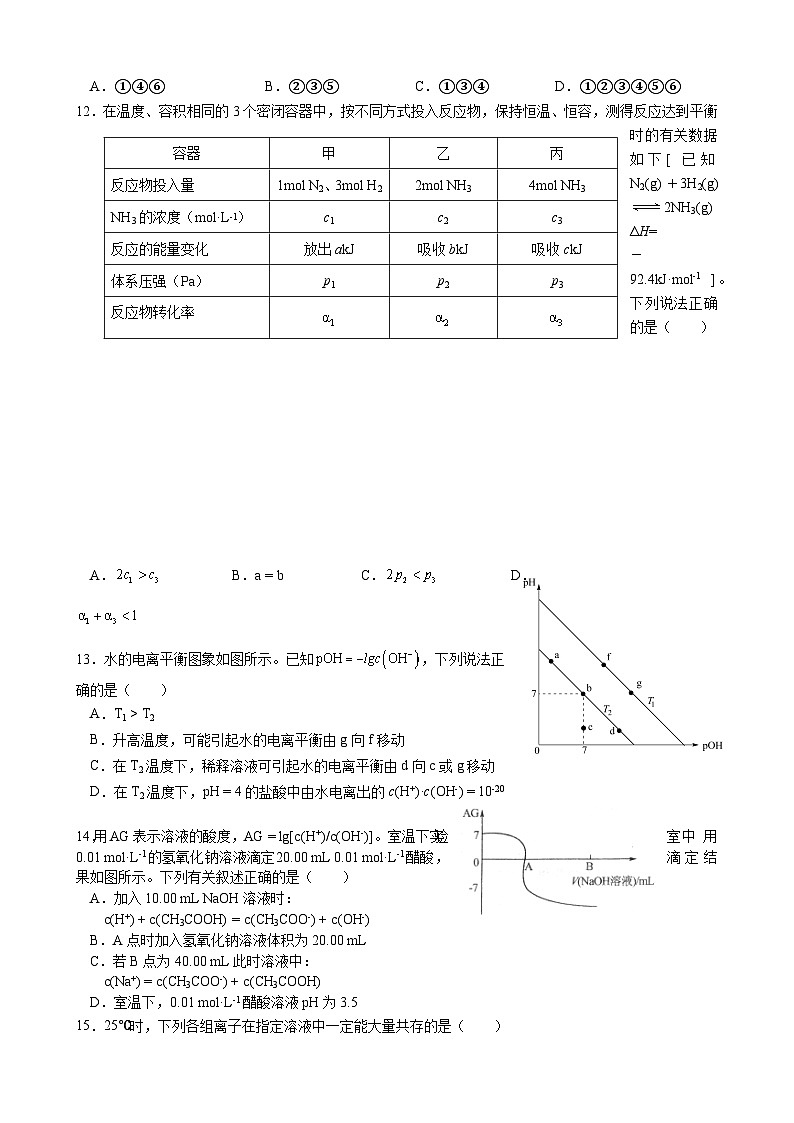
12.在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[ 已知N2(g)+3H2(g)2NH3(g) ΔH=-92.4kJ·ml-1 ]。下列说法正确的是( )
A. B.a = b C. D.
13.水的电离平衡图象如图所示。已知,下列说法正
确的是( )
A.T1 > T2
B.升高温度,可能引起水的电离平衡由g向f移动
C.在T2温度下,稀释溶液可引起水的电离平衡由d向c或g移动
D.在T2温度下,pH = 4的盐酸中由水电离出的c(H+)·c(OH-) = 10-20
14.用AG表示溶液的酸度,AG = lg[c(H+)/c(OH-)]。室温下实验室中用0.01 ml·L-1的氢氧化钠溶液滴定20.00 mL 0.01 ml·L-1醋酸,滴定结果如图所示。下列有关叙述正确的是( )
A.加入10.00 mL NaOH溶液时:
c(H+) + c(CH3COOH) = c(CH3COO-) + c(OH-)
B.A点时加入氢氧化钠溶液体积为20.00 mL
C.若B点为40.00 mL此时溶液中:
c(Na+) = c(CH3COO-) + c(CH3COOH)
D.室温下,0.01 ml·L-1醋酸溶液pH为3.5
15.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.含有大量NO3-的溶液:H+、NH4+、I-、SO42-
B.与铝作用放出氢气的溶液:CrO42-、Mg2+、NO3-、Fe2+
C.c(H+)/c(OH-) = 10-12的溶液:K+、AlO2-、CO32-、Na+
D.由水电离出c(H+)=10-12 ml·L-1的溶液:Na+、K+、CO32-、SO42-
16.在一定温度和压强条件下发生了反应:CO2(g)+3H2 (g)CH3OH(g)+H2O(g) △H<0,反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是( )
A.P3>P2 ; T3>T2
B.P2>P4 ; T4>T2
C.P1>P3 ; T3>T1
D.P1>P4 ; T2>T3
第ⅠI卷 (本卷共计56分)
二、填空题(本题共4小题,每小题14分,总共56分。)
17(14分)按要求回答下列问题
(1)NaHCO3水解的离子方程式 。
(2)Al2(SO4)3溶液和NaHCO3溶液混合的离子方程式 。
(3)在25℃下,将a ml/L的氨水与0.01 ml/L的盐酸等体积混合,溶液显中性。用含a的代数式表示NH3H2O的电离常数Kb=________________。
(4)已知下表中数据
写出少量CO2通入到过量的NaClO溶液中的离子方程式:_________________________________________。
(5)已知:CO(g) + H2O(g) CO2(g) + H2(g) △H =-41 kJ∙ml-1
CO2(g) + 4 H2(g) CH4(g) + 2H2O(g) △H =-187 kJ∙ml-1
写出CO与H2生成CH4和水蒸气的热化学方程式 。
(6)CO + 2H2 CH3OH(g),恒温恒容时体积比1:1投入CO与H2,下列不能判断是否达到平衡的是( )
a. 平均分子量不再变化 b. 混合气密度不再变化
c . CO体积分数不再变化 d. 单位时间生成CH3OH与CO的体积相等
(7)Na2CO3溶液中各离子(五种)浓度从大到小的顺序为 。
原子序数
原子半径
xx
+1x
yx
+4x
zx
+5x
dx
-2
e
+1x
f
+3x
g
-2
h
-1
18(14分)随原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。根据判断出的元素回答问题:
(1)f在元素周期表的位置是______________________。
(2)比较g、h的最高价氧化物对应的水化物的酸性强弱是:__________________(用化学式表示)。
(3)化合物e2d2中化学键的类型为__________________。
(4)写出x和z组成的四原子共价化合物的其电子式______________。
(5)e、f的最高价氧化物对应水化物相互反应的离子方程式为__________________________________。
(6)(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为___________________。
(7)比较g、h元素的非金属性除了比较其单质与氢气化合难易、气态氢化物的稳定性、最高价氧化物水化物酸性之外,请你再设计一个简单的实验证明:_________________________________________。
19(14分)已知反应①:Fe(s)+CO2(g)FeO(s)+CO(g),其化学平衡常数为K1;
反应②:Fe(s)+H2O(g)FeO(s)+H2(g),其化学平衡常数为K2,
在温度973K和1173K的情况下,K1、K2的值分别如下:
回答下列问题:
(1)反应①的平衡常数的表达式是K1 = _______________。
(2)现有反应③:CO2(g)+H2(g)CO(g)+H2O(g),该反应的平衡常数K3,根据反应①与②可推导出K1、K2与K3之间的关系式为K3=___________,据此关系式及上表数据,能推断出反应③是__________(填“吸热”或“放热”)反应。
(3)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
t1 t2 时间
t1 t2 t3 时间
化学反应速率
浓度
图甲 图乙
CO2
CO
图甲中t2时刻发生改变的条件是________________。图乙中t2时刻发生改变的条件是_______________,判断依据是 。
(4)一定条件下处于化学平衡状态的反应③当使CO2和CO的浓度同时增大为原来的两倍时,该反应的化学平衡______________移动(填“不”、“逆向”或“正向”)。
20(14分)三氯化铬(CrCl3)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取CrCl3的反应为Cr2O3(s)+3CCl4(g)2CrCl3(s)+3COCl2(g),其实验装置如下图所示:
N2→
热水
无水CCl4
管式炉
Cr2O3
无水CaCl2
NaOH溶液
小瓷舟
A B
C
G
D E F
已知:①COC12(俗称光气)有毒,遇水发生水解:COCl2+H2O=CO2+2HCl;
②碱性条件下,H2O2可将Cr3+氧化为CrO42-(黄色);酸性条件下,H2O2将Cr2O72-(橙色)还原为Cr3+(绿色)。
(1)A装置用于干燥N2和观察其流速,A中的试剂是___________,无水CaCl2的作用是___________,反应结束后要继续通入一段时间氮气,主要目的是______________________________________________。
(2)装置E用来收集产物。实验过程中若D处因发生凝华出现堵塞,A装置中可观察到的现象是___________________________,可通过________________________________(填操作)使实验继续进行。
(3)尾气与装置G中过量的NaOH溶液发生反应的离子方程式是_______________________________。
(4)测定产品中CrCl3质量分数的实验步骤如下:
I.取1.59 g CrCl3产品,在强碱性条件下,加入过量30%H2O2溶液,小火加热使CrCl3完全转化为CrO42-,再继续加热一段时间。
II.冷却后加适量的蒸馏水,再滴入适量的稀硫酸和浓磷酸(浓磷酸作用是分子指示剂提前变色),使CrO42-转化为Cr2O72-。
III.在溶液中加入适量浓H2SO4,滴入3滴试亚铁灵做指示剂,用新配制的c ml·L-1(NH4)2Fe(SO4)2标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗(NH4)2Fe(SO4)2标准溶液V mL(滴定中Cr2O72-被Fe2+还原为Cr3+)。
①产品中CrCl3质量分数为_________________(已知CrCl3的摩尔质量为159g/ml)。
②下列操作将导致产品中CrCl3质量分数测定值偏高的是___________(填字母标号)。
a.步骤I中未继续加热一段时间
b.步骤III中(NH4)2Fe(SO4)2溶液部分变质
c.步骤II用盐酸替代硫酸
d.步骤III滴定过程中,有少量标准液滴在锥形瓶外目的
操作
A
配制FeCl3溶液
将一定质量的FeCl3固体放入烧杯,直接用蒸馏水溶解
B
由FeSO4溶液得到FeSO4固体
将溶液蒸发结晶
C
测定氯水溶液pH
玻璃棒蘸取溶液点在干燥的pH试纸上,与比色卡对照
D
润洗滴定管
加入待装液3~5mL,倾斜转动滴定管,使液体浸润全部滴定管内壁,将液体从滴定管下部放出,重复2-3次
容器
甲
乙
丙
反应物投入量
1ml N2、3ml H2
2ml NH3
4ml NH3
NH3的浓度(ml·L-1)
c1
c2
c3
反应的能量变化
放出akJ
吸收bkJ
吸收ckJ
体系压强(Pa)
p1
p2
p3
反应物转化率
酸
电离常数(25 ℃)
H2CO3
Kal=4.3×10-7 ;Ka2=5.6×10-11
HClO
Ka=2.4×10-9
温度
K1
K2
973K
1.47
2.38
1173K
2.15
1.67
相关试卷
这是一份广东省深圳市宝安区2023-2024学年高二上学期1月调研测试(期末)化学试题(含答案),共11页。试卷主要包含了01,5分,7%,10,36等内容,欢迎下载使用。
这是一份广东省深圳市宝安区2023-2024学年高二上学期1月调研测试(期末)化学试题(PDF版含答案),共10页。
这是一份广东省深圳市高级中学2023-2024学年高二上学期期中考试化学试题含答案,共13页。试卷主要包含了化学与生活息息相关、密不可分等内容,欢迎下载使用。









