
化学苏教版 (2019)第二单元 化学反应的方向与限度达标测试
展开
这是一份化学苏教版 (2019)第二单元 化学反应的方向与限度达标测试,共28页。试卷主要包含了单选题,填空题,实验探究题等内容,欢迎下载使用。
一、单选题
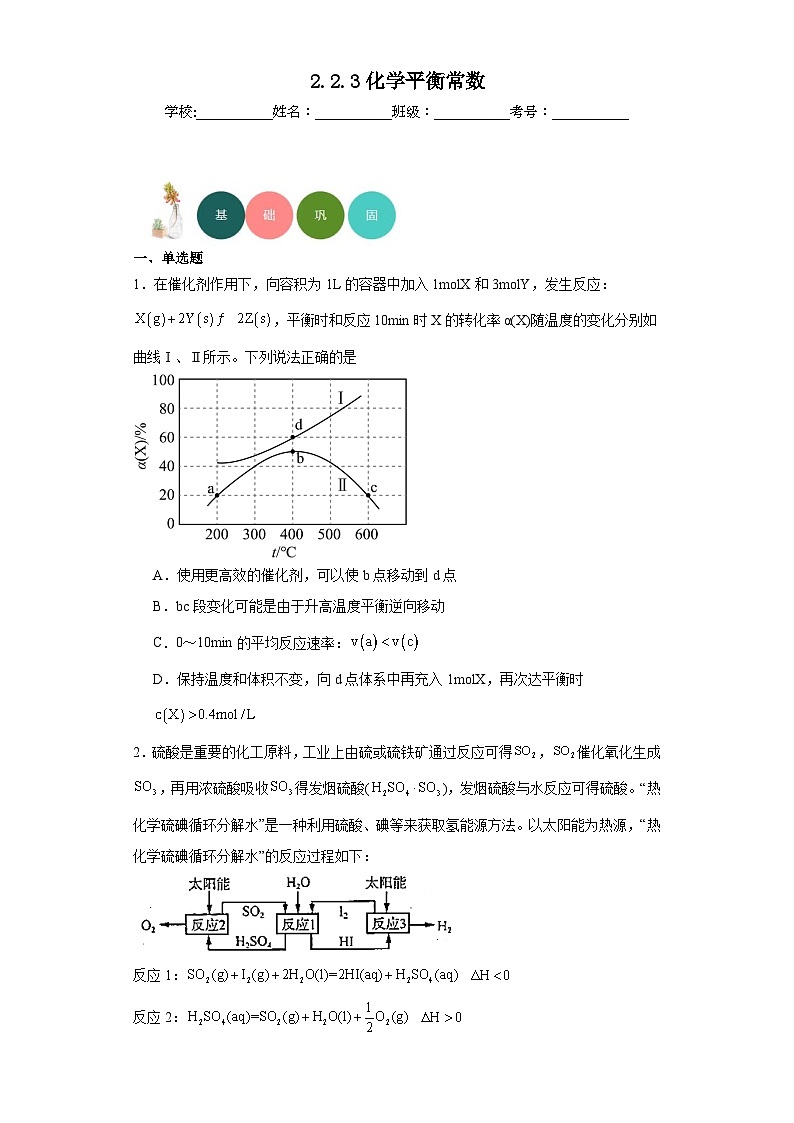
1.在催化剂作用下,向容积为1L的容器中加入1mlX和3mlY,发生反应:,平衡时和反应10min时X的转化率α(X)随温度的变化分别如曲线Ⅰ、Ⅱ所示。下列说法正确的是
A.使用更高效的催化剂,可以使b点移动到d点
B.bc段变化可能是由于升高温度平衡逆向移动
C.0~10min的平均反应速率:
D.保持温度和体积不变,向d点体系中再充入1mlX,再次达平衡时
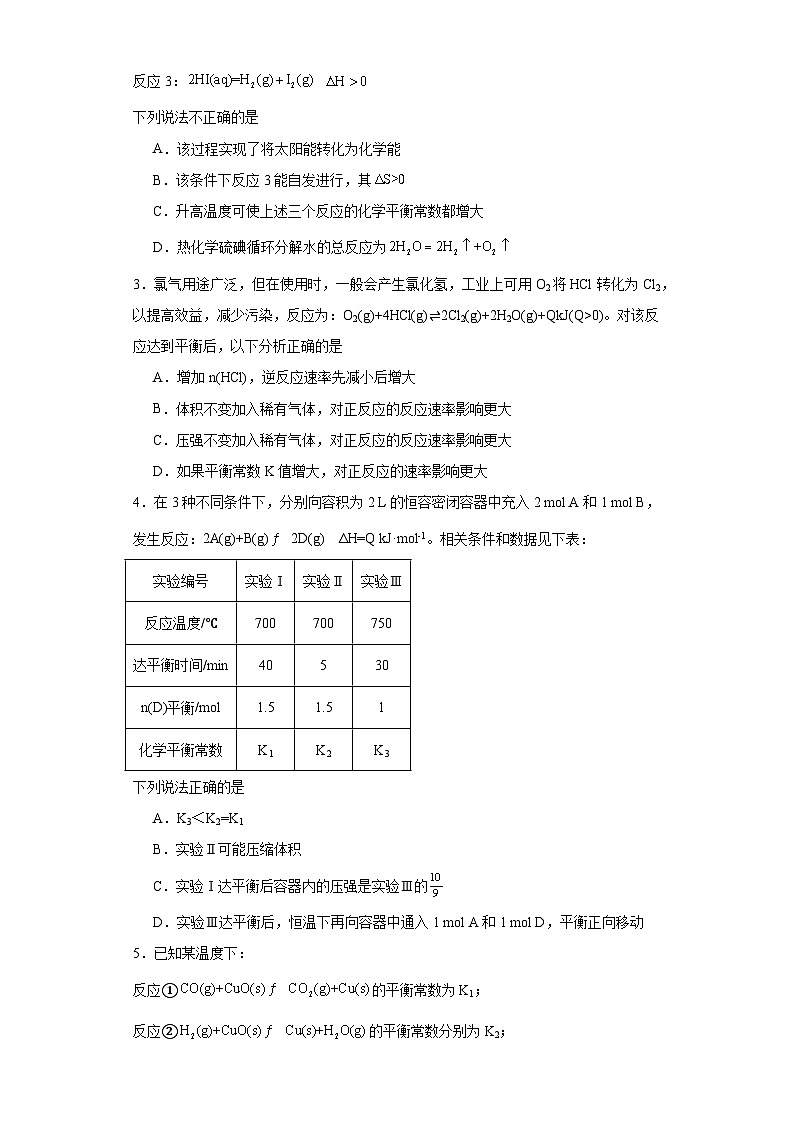
2.硫酸是重要的化工原料,工业上由硫或硫铁矿通过反应可得,催化氧化生成,再用浓硫酸吸收得发烟硫酸(),发烟硫酸与水反应可得硫酸。“热化学硫碘循环分解水”是一种利用硫酸、碘等来获取氢能源方法。以太阳能为热源,“热化学硫碘循环分解水”的反应过程如下:
反应1:
反应2:
反应3:
下列说法不正确的是
A.该过程实现了将太阳能转化为化学能
B.该条件下反应3能自发进行,其
C.升高温度可使上述三个反应的化学平衡常数都增大
D.热化学硫碘循环分解水的总反应为
3.氯气用途广泛,但在使用时,一般会产生氯化氢,工业上可用O2将HCl转化为Cl2,以提高效益,减少污染,反应为:O2(g)+4HCl(g)⇌2Cl2(g)+2H2O(g)+QkJ(Q>0)。对该反应达到平衡后,以下分析正确的是
A.增加n(HCl),逆反应速率先减小后增大
B.体积不变加入稀有气体,对正反应的反应速率影响更大
C.压强不变加入稀有气体,对正反应的反应速率影响更大
D.如果平衡常数K值增大,对正反应的速率影响更大
4.在3种不同条件下,分别向容积为2 L的恒容密闭容器中充入2 ml A和1 ml B,发生反应:2A(g)+B(g)2D(g) ΔH=Q kJ·ml-1。相关条件和数据见下表:
下列说法正确的是
A.K3<K2=K1
B.实验Ⅱ可能压缩体积
C.实验Ⅰ达平衡后容器内的压强是实验Ⅲ的
D.实验Ⅲ达平衡后,恒温下再向容器中通入1 ml A和1 ml D,平衡正向移动
5.已知某温度下:
反应①的平衡常数为K1;
反应②的平衡常数分别为K2;
反应③的平衡常数为K3;
则下列说法正确的是
A.
B.
C.对于反应①,恒温恒容下,增加CO的量,平衡常数K1增大
D.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
6.与是燃油汽车尾气中的两种有害气体,常温常压下它们之间的反应: ,,反应速率较小。有关该反应的说法正确的是
A.与在排入大气之前未反应完全
B.增大压强,平衡将向右移动,
C.升高温度,既增大反应速率又增大K
D.选用适宜催化剂,可以增大K,使尾气排放达到标准
7.反应的平衡常数,反应平衡常数,则,的关系为(平衡常数为同温度下的测定值)
A.B.C.D.
8.在一密闭容器中,对于可逆反应,下列能正确表示该反应的平衡常数表达式的是
A.B.
C.D.
9.在一密闭容器中,存在可逆反应,该反应的平衡常数表达式为
A.B.
C.D.
10.向一恒温恒容的密闭容器中充入和发生反应:,测得部分物质的物质的量浓度与时间关系如图1所示,在催化下反应机理与能量变化如图2所示。
下列说法正确的是
A.时,表明反应达到平衡
B.时改变某种条件,重新达到平衡后,该反应的化学平衡常数一定减小
C.投料改为和,的平衡体积分数增大
D.寻找合适催化剂降低阶段②活化能,能有效提高的平衡转化率
二、填空题
11.已知CO和H2在催化剂作用下合成甲醇的反应如下:CO(g)+2H2(g) CH3OH(g) ΔH1=-99 kJ/ml,反应的化学平衡常数K表达式为 ;下图中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。
12.回答下列问题:
(1)容器中通入等物质的量的乙烷和氢气,在等压(p)下发生反应C2H6(g)=C2H4(g)+H2(g) ΔH1=+137 kJ·ml-1,乙烷的平衡转化率为α。反应的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+O2(g) SO3(g) ΔH=-98 kJ·ml-1。将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为α,则SO3压强为 ,平衡常数Kp= (以分压表示,分压=总压×物质的量分数)。
13.在一定体积的密闭容器中,进行如下化学反应:CH4(g)+H2O(g)CO(g)+3H2(g),不同温度下达到平衡时,反应体系中各物质的浓度如下表:
(1)该反应的平衡常数表达式为K= ,正反应为 反应(填放热、吸热)。
(2)能判断该反应是否已达到化学平衡状态的依据是
a.容器压强不变 b.c(CH4)=c(H2O)
c.v正(CH4)=v逆(H2) d .混合气体中c(CO)不变
氮化铝是共价键化合物,高碳热还原制备氮化铝的总反应化学方程式为(未配平):
Al2O3(s)+C(s)+N2(g)→AlN(s)+CO(g) ……①
某氮化铝样品中含有氧化铝杂质.已知氮化铝和NaOH溶液能反应,并产生氨气,其反应方程式为:AlN+NaOH+H2O→NaAlO2+NH3↑……②,
氧化铝也能与氢氧化钠溶液反应而全部溶解……③
(3)配平化学化学方程式①: Al2O3(s)+ C(s)+ N2(g)→ AlN(s)+ CO(g)
(4)反应②中产生气体的检验方法为 ;
反应③的离子方程式 。
14.在2L密闭容器中,起始投入4mlN2和6mlH2在一定条件下生成NH3,平衡时仅改变温度测得的数据如表所示(已知:T1”、“或=或”、“、
相关试卷
这是一份高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度课后测评,共29页。试卷主要包含了单选题,填空题,实验探究题等内容,欢迎下载使用。
这是一份选择性必修1专题3 水溶液中的离子反应第二单元 溶液的酸碱性课时训练,共27页。试卷主要包含了单选题,填空题,实验探究题等内容,欢迎下载使用。
这是一份苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第三单元 盐类的水解课时练习,共27页。试卷主要包含了单选题,填空题,实验探究题等内容,欢迎下载使用。









