

海南省部分学校2022-2023学年高三上学期11月联考化学试题(一模)(含答案)
展开
这是一份海南省部分学校2022-2023学年高三上学期11月联考化学试题(一模)(含答案),共19页。试卷主要包含了单选题,多选题,填空题等内容,欢迎下载使用。
一、单选题
1、下列有关化学用语的表示错误的是( )
A.绿矾的化学式B.乙酸的结构简式:
C.氟离子的结构示意图:D.中子数为9的O原子:
2、钠及其化合物在日常生活和工农业生产中用途广泛,下列说法正确的是( )
A.苛性钠和苛性钾均为强碱,且苛性钠碱性强于奇性钾
B.烧碱和小苏打均常用于焙制糕点
C.金属钠在空气中久置最终转化为碳酸氢钠
D.过氧化钠作为供氧剂时发生氧化还原反应
3、下列离子组中所有离子都能大量共存的是( )
A.、、、B.、、、
C.、、、D.、、、
4、下列指定反应的离子方程式正确的是( )
A.用NaOH溶液吸收少量:
B.向稀溶液中滴加稀硝酸:
C.向溶液中加入过量氨水:
D.用盐酸、淀粉KI溶液检验含碘盐中的:
5、是一种用途广泛的优良供氧剂,可用于鱼类养殖、农作物栽培、污水处理等多方面。某恒容密闭容器中发生反应:。下列说法正确的是( )
A.反应结束恢复到初始温度,气体压强一定变为原来的一半
B.常温常压下,和的摩尔体积相等
C.既是氧化产物,也是还原产物
D.转移1ml电子时,生成11.2L氧气
6、下图表示Cu或Fe元素不同的化合价与物质类别的关系。下列说法正确的是( )
A.a可以是黄铜或青铜
B.若a为铁,向i溶液中逐滴加入NaOH溶液即可制备f
C.若a为铜或铁,f和g一定是难溶于水的有色物质
D.若a为铜或铁,a与j的反应一定是置换反应
7、下列有关化学药品的保存或溶液配制的操作正确的是( )
A.盛与乙醇的试剂瓶可保存于同一个药品橱中
B.固体密封保存在棕色细口瓶中
C.配制一定物质的量浓度的溶液,定容时,眼睛平视容量瓶刻度线
D.配制溶液时要加少量稀盐酸防止水解
8、设表示阿伏加德罗常数的值,下列说法正确的是( )
中含有的电子数为
白磷(,正四面体结构)含共价键的数目为1.2
C.标准状况下,11.2L 中含氧原子数为1.5
中含共价键的数目为
9、短周期主族元素X、Y、Z、W的原子序数依次增大,X、Z同主族,X的原子半径在短周期元素中最小,Y原子最外层比内层多3个电子,W原子在同周期主族元素中原子半径最小。下列判断正确的是( )
A.X与Y、Z、W均能形成共价化合物
B.简单离子的半径:Y>Z>W
C.Z的氧化物对应的水化物含共价键、离子键
D.W的氧化物对应水化物的酸性比Y的强
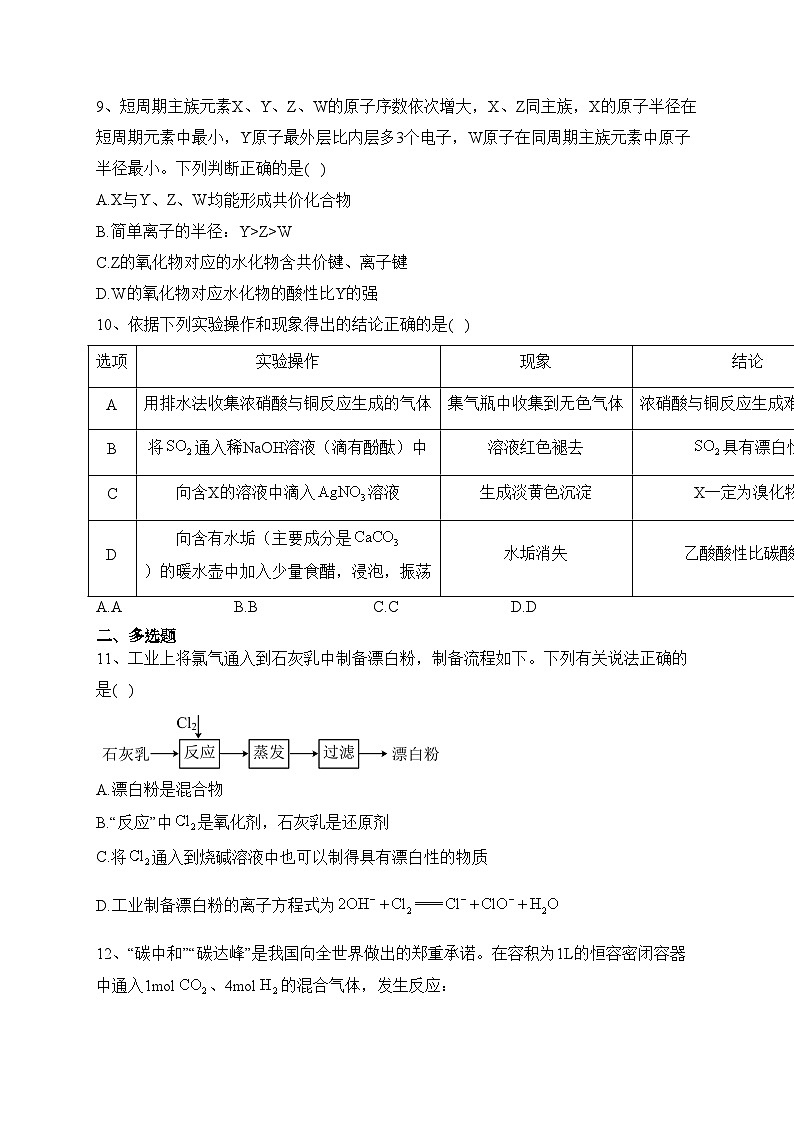
10、依据下列实验操作和现象得出的结论正确的是( )
A.AB.BC.CD.D
二、多选题
11、工业上将氯气通入到石灰乳中制备漂白粉,制备流程如下。下列有关说法正确的是( )
A.漂白粉是混合物
B.“反应”中是氧化剂,石灰乳是还原剂
C.将通入到烧碱溶液中也可以制得具有漂白性的物质
D.工业制备漂白粉的离子方程式为
12、“碳中和”“碳达峰”是我国向全世界做出的郑重承诺。在容积为1L的恒容密闭容器中通入1ml、4ml的混合气体,发生反应:,8min时反应刚好达到平衡,测得此时容器内为0.4ml。下列说法正确的是( )
A.该反应的逆反应为吸热反应
B.升高温度,的生成速率增大,消耗速率减小
C.0~8min内的平均反应速率
D.平衡体系中的物质的量分数为
13、硫酸铜溶于水显蓝色是因为水溶液中存在,下列有关说法正确的是( )
A.是共价化合物
B.基态的核外电子排布式为
C.与水分子形成配离子是因为有空轨道,中O有孤对电子
D.的空间构型为正四面体形
14、下列有关物质的用途及对应解释均正确的是( )
A.AB.BC.CD.D
三、填空题
15、废弃电池是一种有害垃圾,合理处理则能变废为宝。下图是废弃锌锰电池的处理流程图:
已知:锰粉的主要成分是Mn元素的+2、+3、+4价氧化物和ZnO。
回答下列问题:
(1)“废弃锌锰电池→锰粉”的操作是拆分、煅烧,煅烧类似于实验室中的焙烧,实验室焙烧使用的仪器是下列中的_______(填仪器名称)。
(2)“酸溶”采用锰粉比锰块的浸取速率快,为提高“酸溶”的浸取速率,还可以采取的措施有_______(填一条),“酸溶”过程中的主要作用是_______。
(3)“氧化”操作的氧化产物是_______(填化学式)。
(4)“洗涤、干燥”时,检验洗涤干净的实验方法及现象是_______。
(5)滤液X可以用于制取化肥,其中除外,主要含_______、(填离子符号)。
(6)由制备ZnO的条件是加热,写出该反应的化学方程式:_______。
16、有W、X,Y、Z、M五种元素,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,W的单质是密度最小的气体,X、Z同主族,且Z的原子序数是X的2倍,Y是所在周期中原子半径最小的金属元素,M为金属元素,其相对原子质量是Z的2倍。回答下列问题:
(1)X、Y、Z的电负性由大到小的顺序是_______(用元素符号表示)。
(2)五种元素中形成的二元化合物分子含18电子的有_______(用化学式表示),写出其中一种分子的电子式:_______。
(3)甲为X,M元素形成的黑色化合物,甲与,在加热条件下生成M的单质和两种无态的物质,写出该反应的化学方程式:_______。
(4)写出Z的+4价氧化物在酸性环境中被氧化为Z的最高价氧化物对应的水化物的离子方程式:_______。
(5)电解熔融状态Y的氧化物生成Y的单质的反应中,生成2.7g固体时,收集到的气体为_______mL(标准状况)。
17、亚硝酸钠是一种白色结晶性粉末,易溶于水,微溶于乙醇,可用作织物染色的媒染剂、漂白剂、金属热处理剂等。某学校化学实验小组利用图装置制备。
已知信息:
Ⅰ.在实验开始之前,装置内通入一段时间。干燥状态的NO,与反应分别生成、。
Ⅱ.酸性溶液可氧化NO、生成,Mn元素被还原为。
回答下列问题:
(1)仪器A的名称为_______。仪器A侧管的作用是_______。
(2)装置丙中盛有的试剂是_______(填名称)。
(3)装置丁中发生反应的化学方程式是_______,若缺少装置丙,则装置丁中制备的物质可能会含杂质NaOH、_______。
(4)装置戊的作用是_______,下列可代替装置戊(其中所盛液体均为酸性溶液)的是_______(填序号)。
A.B.C.
(5)称取3.0g装置丁中的产品(假设杂质不参加反应),用规格为500mL的容量瓶配成标准溶液,取25.00mL,加入到锥形瓶中,进行滴定,测得恰好消耗的酸性溶液,则制备的产品的纯度为_______%。
18、F是某些药物合成的中间体,以芳香烃A为原料制备F的合成路线如图所示:
已知:。
回答下列问题:
(1)光照条件下,A发生一氯取代生成B,则A的化学名称是_______。
(2)B的结构简式是_______,B生成C的条件是_______。
(3)C所含的官能团名称是_______,在浓硫酸和加热条件下,C与冰醋酸反应的化学方程式是_______。
(4)C→D,E→F的反应类型分别为_______、_______。
(5)下列关于D的说法正确的是_______(填序号)。
A.能与Na反应生成
B.能使酸性溶液褪色
C.能与银氨溶液发生银镜反应
D.1mlD最多能与3ml,发生加成反应
(6)X是E的同分异构体,写出符合下列条件的X的结构简式:_______(任写一种)。
①含有苯环,某环上含有3个取代基
②不能与Na反应
③加热时能与新制反应生成砖红色沉淀
19、砷(As)与磷同主族,砷的化合物在药物,半导体,科研中具有较为广泛的用途。回答下列问题:
(1)基态磷原子的核外电子排布式是____,基态砷原子的价电子中有____个未成对电子。
(2)As,Se为同周期相邻元素,则第一电离能:As_______Se(填“>”“S>Al;故答案为:O>S>Al;
(2)原子的电子数=原子序数,则二元化合物且含18个电子的物质:或;故答案为:、;或;
(3)X,M元素形成的黑色化合物为CuO,根据元素守恒定律Cu与,在加热条件下生成Cu的单质和两种无毒的物质,该无毒的物质为、,故反应方程式为:;故答案为:;
(4)Z的+4价氧化物为,在酸性环境中被氧化为Z的最高价氧化物为,对应的水化物为,故方程式为:;故答案为:;
(5)Y的氧化物,生成单质Al的反应方程式,,生成2.7g固体Al为0.1ml,则生成的为0.075ml,;故答案为:1680。
17、答案:(1)恒压分液漏斗;平衡压强,使液体(浓硝酸)能顺利滴下
(2)碱石灰
(3);、
(4)吸收尾气NO,并防止倒吸;C
(5)92
解析:碳单质与浓硝酸加热反应生成二氧化氮、二氧化碳,生成的气体经乙,二氧化氮与水反应转化成NO,再经丙中的碱石灰除去二氧化碳和水,干燥的NO进入丁中与过氧化钠反应生成亚硝酸钠,为防止空气中水蒸气进入丁中,在丁的右侧连接装有碱石灰的干燥管;最后用高锰酸钾除去过量的NO防止污染空气,据此解答。
(1)由仪器的构造可知A为恒压分液漏斗,A中的测管连接分液漏斗上下,可以平衡压强,使液体(浓硝酸)能顺利滴下,故答案为:恒压分液漏斗;平衡压强,使液体(浓硝酸)能顺利滴下;
(2)由以上分析丙中为碱石灰用于除去二氧化碳和水,故答案为:碱石灰;
(3)装置丁中NO与过氧化钠反应生成亚硝酸钠,反应为:;若没有丙,则二氧化碳和水会进入丁中与过氧化钠反应生成碳酸钠和氢氧化钠,同时生成的氧气与NO反应生成二氧化氮,二氧化氮与过氧化钠反应生成硝酸钠,故答案为:;、;
(4)装置戊中为高锰酸钾用于除去NO,防止污染空气,同时倒置漏斗可防止出现倒吸现象;在ABC装置中AB都伸入溶液中不能防止倒吸,而C中存在安全装置,故C可以代替,故答案为:吸收尾气NO,并防止倒吸;C;
(5)高锰酸钾与亚硝酸钠发生以下反应:,的酸性溶液中;则样品中亚硝酸钠的物质的量为:;亚硝酸钠的质量分数为:,故答案为:92;
18、答案:(1)甲苯
(2);NaOH水溶液、加热
(3)羟基;
(4)氧化反应;取代反应
(5)BC
(6)(或、、、、)
解析:(1)光照条件下,发生一氯取代,则发生的是甲基上的取代,则A为;
故答案为:甲苯。
(2)B生成C:+HCl;
故答案为:;NaOH水溶液、加热
(3)根据分析,C为,在浓硫酸和加热条件下,C与冰醋酸反应为:;
故答案为:羟基;。
(4)的反应,去H反应,为氧化反应;反应中,Cl元素取代了羟基,为取代反应;故答案为:氧化反应;取代反应。
(5)根据中的官能团判断物质性质,醛基具有较强的氧化性,所以可以使褪色,银氨溶液发生银镜反应,能与4ml发生加成反应;
故答案为:BC。
(6)根据同分异构体原理书写;、、、、、;
故答案为:(或、、、、)。
19、答案:(1)或;3
(2)>
(3)氯化铝属于分子晶体,状态改变时需要克服分子间作用力;Cl;平面三角形;三角锥形
(4)(,,)
解析:(1)①磷原子的原子序数为15,其基态原子的电子排布式为:或;
②基态砷原子的电子排布式为:,核外有3个未成对电子。
(2)同一周期主族元素从左向右第一电离能呈增大趋势,但第ⅡA族和第VA族元素最外层电子处于全满、半满状态,较稳定,第一电离能比同周期相邻元素的第一电离能大,As>Se;
(3)①氯化铝属于分子晶体,状态改变时需要克服分子间作用力;
②由图可知提供孤对电子的原子是氯原子;
③由价层电子对互斥理论可知氯化铝的价层电子对是3,孤电子对为0,结构是平面三角形;
④由价层电子对互斥理论可知三氯化砷的价层电子对是4,孤电子对为1,结构是三角锥形;
(4)由图可知a点的原子位于底面的面心,b点的原子位于内部的8个小正方体中一个小正方体的体心,所以b点的原子坐标为(,,)。
选项
实验操作
现象
结论
A
用排水法收集浓硝酸与铜反应生成的气体
集气瓶中收集到无色气体
浓硝酸与铜反应生成难溶的NO
B
将通入稀NaOH溶液(滴有酚酞)中
溶液红色褪去
具有漂白性
C
向含X的溶液中滴入溶液
生成淡黄色沉淀
X一定为溴化物
D
向含有水垢(主要成分是)的暖水壶中加入少量食醋,浸泡,振荡
水垢消失
乙酸酸性比碳酸强
选项
用途
解释
A
用厨余垃圾制备农用有机肥料
厨余垃圾中含N、P、K等元素
B
北京冬奥会采用跨临界直冷制冰技术
液态挥发时吸热且无毒,不会破坏臭氧层
C
晶体硅拉制成丝,制作光导纤维
晶体硅的导电性介于异体和绝缘体之间
D
过氧乙酸()用于灭活病毒
羧基电离产生
相关试卷
这是一份海南省部分学校2023-2024学年高二上学期1月期末联考化学试题(含答案),共9页。试卷主要包含了氨主要来源于工业合成氨,其他条件相同的情况下,探究恒容等内容,欢迎下载使用。
这是一份2024海南省部分学校高三上学期12月联考(四)化学PDF版含答案,共5页。
这是一份2022-2023学年山西省部分学校高三上学期11月联考化学试题PDF版含答案,共10页。









