










高中化学人教版 (2019)必修 第二册第一节 化学反应与能量变化精品作业ppt课件
展开现代社会中,人类的一切活动(从衣食住行到文化娱乐,从社会生产到学科研究等)都离不开能量,而许多能量的利用与化学反应中能量变化密切相关。从煤、石油、天然气等提供的热能,到各种化学电池提供的电能,都是通过化学反应获得的。 化石燃料燃烧会释放大量的热。除了燃烧,其他化学反应也伴随这放热或吸热现象。
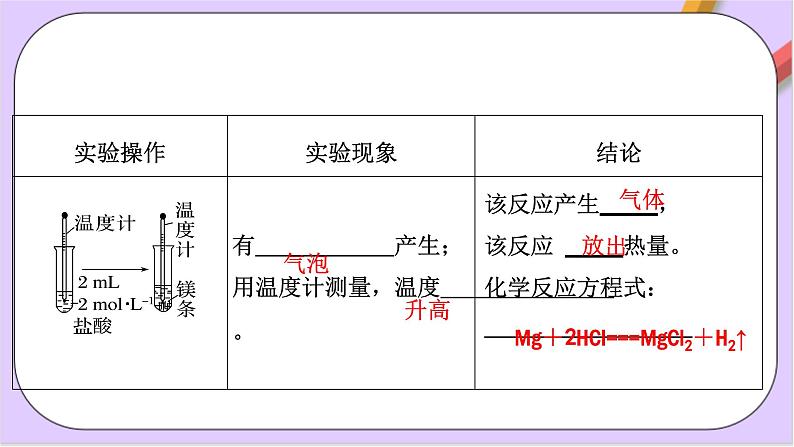
Mg+2HCl===MgCl2+H2↑
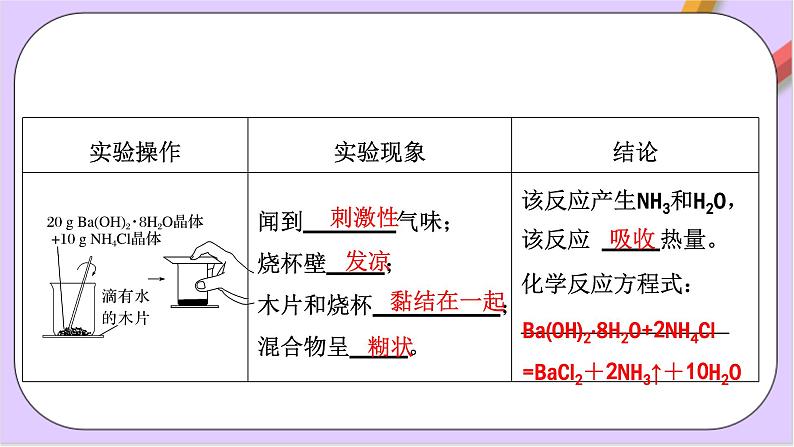
Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
把释放热量的化学反应称为放热反应。
一、放热反应与吸热反应
把吸收热量的化学反应称为吸热反应。
例如:氢氧化钡与氯化铵的反应
在25 ℃和101 kPa条件下
放出436 kJ的能量
吸收436 kJ的能量
结论:在相同条件下,由原子形成1 ml化学键时所 , 与断开1 ml相同化学键所 是相等的。
二、化学键与化学反应中能量变化的关系
断开1 ml H-H 键要吸收 436 kJ 的能量断开1 ml Cl-Cl 键要吸收 243 kJ 的能量生成1 ml H-Cl 键要释放 431 kJ 的能量
H2 + Cl2 = 2HCl
E吸收=436+243=679 kJ E放出=431×2=862 kJ
E吸收< E放出 放热反应
+436 kJ (H2)+243 kJ (Cl2)
2×(-431 kJ)= - 862 kJ
断键吸收能量E1>成键释放能量E2 该反应为吸热反应断键吸收能量E1<成键释放能量E2 该反应为放热反应
化学键的断裂和形成是化学反应中能量变化的主要原因。
化学反应中的物质变化总会伴随着能量变化, 通常主要表现为热量的释放或吸收
各种物质都具有能量,物质的组成、结构与状态不同,所具有的能量也不同。放热反应可以看成是反应物所具有的化学能转化为热能释放出来,吸热反应可以看成是热能转化为化学能被生成物所“储存”。
反应物的总能量 > 生成物的总能量
反应物的总能量 < 生成物的总能量
三、能量转化与能量利用
可通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率
可通过使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能源利用率。
具有资源丰富、可以再生、对环境无污染等特点
1.下列反应属于放热反应的是( )A.煅烧石灰石制生石灰B.煤的气化制水煤气C.Ba(OH)2·8H2O与反应 D.H2SO4与NaOH的中和反应
2.下列有关能量转化的说法中正确的是( )
A.Na与H2O的反应属于吸热反应B.“H—Cl→H+Cl”过程中放出热量C.干冰升华过程放出热量D.反应“C+H2O(g)CO+H2”中的能量变化可以用如图表示
3.汽车受到猛烈碰撞时,安全气囊内的NaN3固体迅速分解,产生氮气和金属钠,该过程中的能量变化如下图所示。下列说法错误的是( )
A.NaN3属于离子化合物B.NaN3的分解反应属于放热反应C.E1表示2mlNaN3固体的能量D.NaN3作为安全气囊的气体发生剂,具有产气快、产气量大等优点
高中人教版 (2019)第二节 化学反应的速率与限度一等奖作业课件ppt: 这是一份高中人教版 (2019)第二节 化学反应的速率与限度一等奖作业课件ppt,文件包含622化学反应限度教学课件课件pptx、622化学反应限度分层作业含解析docx、622化学反应限度分层作业无答案docx等3份课件配套教学资源,其中PPT共40页, 欢迎下载使用。
人教版 (2019)必修 第二册第二节 化学反应的速率与限度精品作业ppt课件: 这是一份人教版 (2019)必修 第二册第二节 化学反应的速率与限度精品作业ppt课件,文件包含621化学反应速率课件pptx、621化学反应速率分层作业含解析docx、621化学反应速率分层作业无答案docx等3份课件配套教学资源,其中PPT共30页, 欢迎下载使用。
化学必修 第二册第一节 化学反应与能量变化完整版作业课件ppt: 这是一份化学必修 第二册第一节 化学反应与能量变化完整版作业课件ppt,文件包含612化学反应与电能课件pptx、612化学反应与电能分层作业含解析docx、612化学反应与电能分层作业无答案docx等3份课件配套教学资源,其中PPT共34页, 欢迎下载使用。













