

还剩21页未读,
继续阅读
所属成套资源:鲁教版化学九年级下册教学课件
成套系列资料,整套一键下载
鲁教版化学九年级下册 第八单元 单元复习训练课件
展开
这是一份鲁教版化学九年级下册 第八单元 单元复习训练课件,共29页。
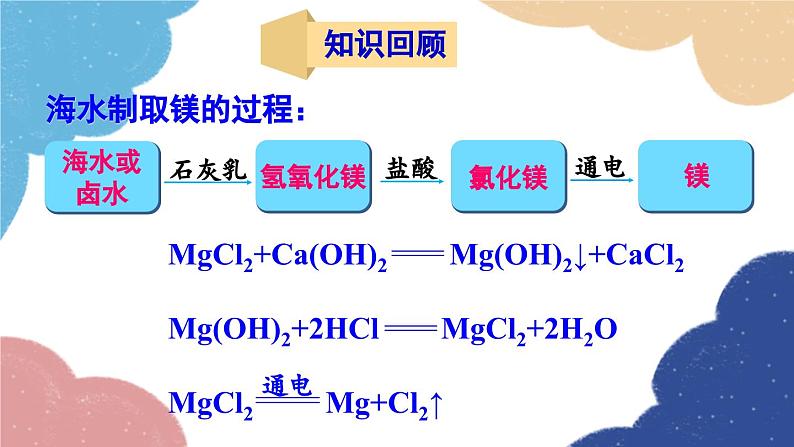
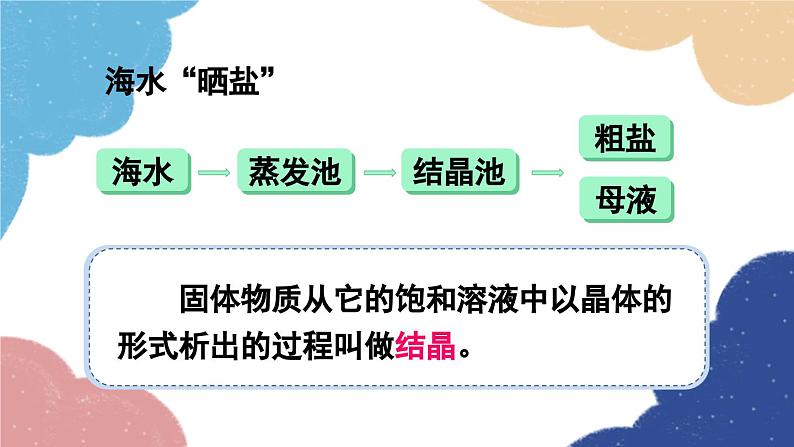
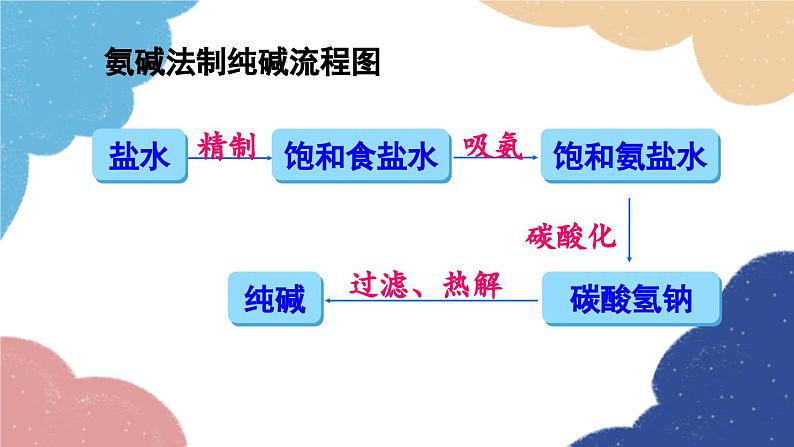
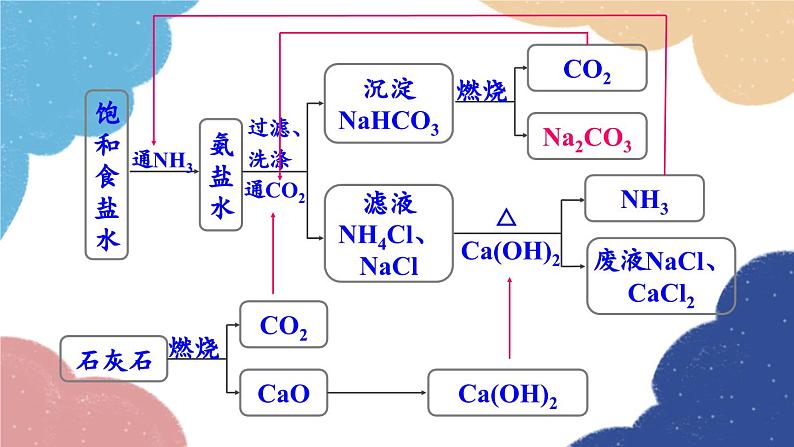
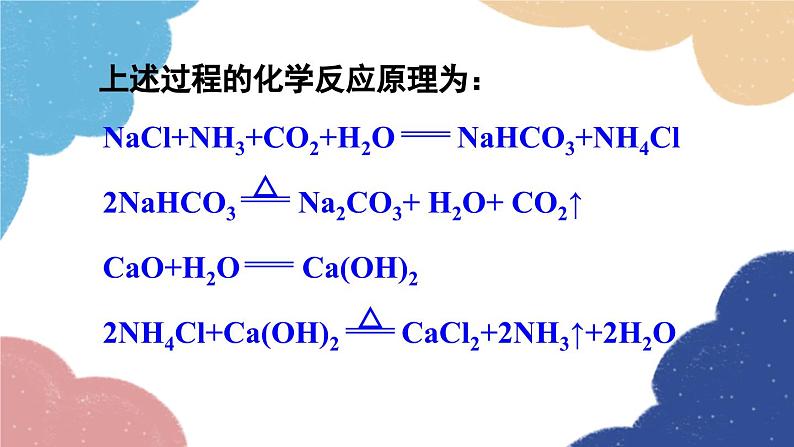
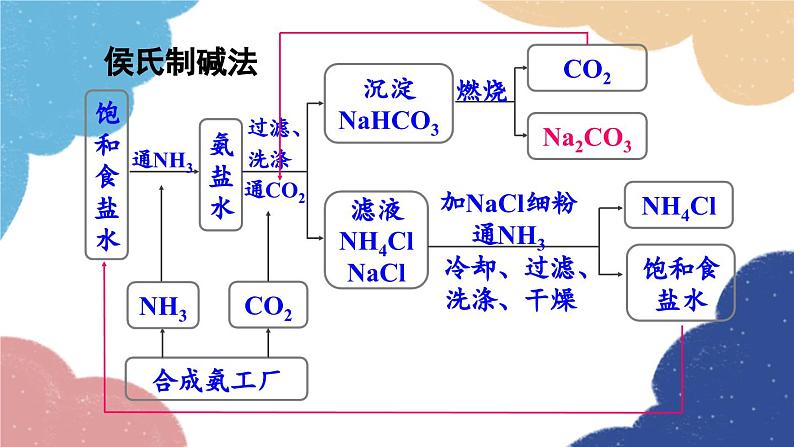
单元复习训练鲁教版·九年级化学下册知识回顾海水制取镁的过程:海水淡化 蒸馏法结晶法膜法海水“晒盐”氨碱法制纯碱流程图饱和食盐水上述过程的化学反应原理为:侯氏制碱法上述过程的化学反应原理为:Na2CO3NaHCO3纯碱、苏打小苏打、酸式碳酸钠白色晶体白色粉末可溶显碱性灭火器、制饮料、发酵粉、治疗胃酸石油精炼、洗涤剂、制造玻璃等。易熔显弱碱性受热不易分解受热易分解溶解度 固体物质的溶解度是指在一定温度下,某固体物质在100g溶剂(通常为水)里达到饱和状态时所溶解的质量。1234一定温度下;100g溶剂里;溶液为饱和状态;溶质的质量。描述溶解度时要注意以下几点: 温度对固体溶解度的影响 根据溶解度曲线可分为“三种类型”: (1)“陡升型”——大多数固体物质的溶解度随温度升高而显著增大,如KNO3; (2)“缓升型”——少数固体物质溶解度受温度的影响变化不大,如NaCl; (3)“缓降型”——极少数物质的溶解度随温度的升高而减小,如Ca(OH)2。硝酸钾的溶解度曲线AB 1.曲线上任一点:表示某物质在某温度时的溶解度;溶液所处的状态是饱和溶液; 2.曲线上方的点:表示某温度下某物质的溶液中溶质有剩余;溶液所处的状态是饱和溶液 ; 3.曲线下方的点:表示某温度下某物质溶液中溶质的量不足;溶液所处的状态是不饱和溶液。溶解度/g温度/℃80 ℃时,100 g水中最多溶解169 g硝酸钾 由80 ℃冷却到20 ℃ 20 ℃时,100 g水中只能溶解31.6 g硝酸钾,析出硝酸钾晶体的质量为:169 g-31.6 g=137.4 g 降温结晶粗盐中难溶性杂质的去除1. 溶解:用玻璃棒轻轻搅拌,加速溶解2. 过滤:一贴、二低、三靠3. 蒸发:用玻璃棒不断搅拌,当析出较多固体时停止加热,用余热使滤液蒸干粗盐提纯粗盐中可溶性杂质的去除这些反应都属于复分解反应。 因此,酸、碱、盐之间发生的复分解反应,其实质是离子之间相互结合,生成难溶性的碱或盐、不稳定的酸(分解放出气体)或水。盐和碱的溶解性:难溶记四盐:AgCl、BaSO4、CaCO3、BaCO3易溶记三碱:NaOH、KOH、Ba(OH)2微溶记三物:Ca(OH)2、CaSO4、Ag2SO4都溶记四类:钾、钠、铵盐、硝酸盐随堂演练 1.从海水中可以提取镁,其中的一个步骤是将卤水(含MgCl2、NaCl、KCl的混合液)转化为氯化镁晶体。实验室中模拟该转化的过程如下,回答有关问题。 (1)制备氢氧化镁:向卤水中加入适量生石灰(CaO),充分反应后过滤。 ①该过程中发生了多个反应,其中会大量放热的反应是(填化学方程式)_________________________________。CaO+H2O====Ca(OH)2 ②过滤操作需用到的玻璃仪器除烧杯外,还_________________________________________________________。 (2)制备氯化镁溶液:用盐酸溶解Mg(OH)2。为了便于后续操作,盐酸不宜过量。 ①反应的化学方程式是________________________。 ②通过计算,可准确知道所需盐酸的量。理论上溶解5.8 g Mg(OH)2需要36.5%HCl溶液________g。漏斗、玻璃棒2HCl+Mg(OH)2==MgCl2+2H2O20 ③由于准确称量Mg(OH)2的步骤繁琐,实验中并不常用,而是通过一定操作方法来达到控制盐酸用量的目的。操作是:将Mg(OH)2加入烧杯中,___________________________________,直到Mg(OH)2完全溶解为止。 (3)制备氯化镁晶体:蒸发浓缩MgCl2溶液,冷却结晶。用胶头滴管逐滴加入稀盐酸溶液 2. 如图为硝酸钾的溶解度曲线,下列说法中,正确的是( ) A. 硝酸钾的溶解度受温度影响不大 B. 100 g水最多能溶解30 g硝酸钾 C. 降温能使接近饱和的硝酸钾溶液变成饱和溶液 D. 20 ℃时硝酸钾的溶解度比40 ℃时硝酸钾的溶解度大C 3. 在无色溶液中,下列离子组能大量共存的是( )A. Ca2+ Na+ CO32- Cl-B. Na+ K+ OH- Cl-C. Cu2+ K+ Cl- NO3-D. H+ Na+ OH- SO42-B 4. 现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量的某物质X,溶液的pH随滴入X的量的变化关系如图所示,则X可能是( )A.水B. 纯碱C. 澄清石灰水D. 稀盐酸B1.从教材习题中选取,2.完成练习册本课时的习题.课后作业
单元复习训练鲁教版·九年级化学下册知识回顾海水制取镁的过程:海水淡化 蒸馏法结晶法膜法海水“晒盐”氨碱法制纯碱流程图饱和食盐水上述过程的化学反应原理为:侯氏制碱法上述过程的化学反应原理为:Na2CO3NaHCO3纯碱、苏打小苏打、酸式碳酸钠白色晶体白色粉末可溶显碱性灭火器、制饮料、发酵粉、治疗胃酸石油精炼、洗涤剂、制造玻璃等。易熔显弱碱性受热不易分解受热易分解溶解度 固体物质的溶解度是指在一定温度下,某固体物质在100g溶剂(通常为水)里达到饱和状态时所溶解的质量。1234一定温度下;100g溶剂里;溶液为饱和状态;溶质的质量。描述溶解度时要注意以下几点: 温度对固体溶解度的影响 根据溶解度曲线可分为“三种类型”: (1)“陡升型”——大多数固体物质的溶解度随温度升高而显著增大,如KNO3; (2)“缓升型”——少数固体物质溶解度受温度的影响变化不大,如NaCl; (3)“缓降型”——极少数物质的溶解度随温度的升高而减小,如Ca(OH)2。硝酸钾的溶解度曲线AB 1.曲线上任一点:表示某物质在某温度时的溶解度;溶液所处的状态是饱和溶液; 2.曲线上方的点:表示某温度下某物质的溶液中溶质有剩余;溶液所处的状态是饱和溶液 ; 3.曲线下方的点:表示某温度下某物质溶液中溶质的量不足;溶液所处的状态是不饱和溶液。溶解度/g温度/℃80 ℃时,100 g水中最多溶解169 g硝酸钾 由80 ℃冷却到20 ℃ 20 ℃时,100 g水中只能溶解31.6 g硝酸钾,析出硝酸钾晶体的质量为:169 g-31.6 g=137.4 g 降温结晶粗盐中难溶性杂质的去除1. 溶解:用玻璃棒轻轻搅拌,加速溶解2. 过滤:一贴、二低、三靠3. 蒸发:用玻璃棒不断搅拌,当析出较多固体时停止加热,用余热使滤液蒸干粗盐提纯粗盐中可溶性杂质的去除这些反应都属于复分解反应。 因此,酸、碱、盐之间发生的复分解反应,其实质是离子之间相互结合,生成难溶性的碱或盐、不稳定的酸(分解放出气体)或水。盐和碱的溶解性:难溶记四盐:AgCl、BaSO4、CaCO3、BaCO3易溶记三碱:NaOH、KOH、Ba(OH)2微溶记三物:Ca(OH)2、CaSO4、Ag2SO4都溶记四类:钾、钠、铵盐、硝酸盐随堂演练 1.从海水中可以提取镁,其中的一个步骤是将卤水(含MgCl2、NaCl、KCl的混合液)转化为氯化镁晶体。实验室中模拟该转化的过程如下,回答有关问题。 (1)制备氢氧化镁:向卤水中加入适量生石灰(CaO),充分反应后过滤。 ①该过程中发生了多个反应,其中会大量放热的反应是(填化学方程式)_________________________________。CaO+H2O====Ca(OH)2 ②过滤操作需用到的玻璃仪器除烧杯外,还_________________________________________________________。 (2)制备氯化镁溶液:用盐酸溶解Mg(OH)2。为了便于后续操作,盐酸不宜过量。 ①反应的化学方程式是________________________。 ②通过计算,可准确知道所需盐酸的量。理论上溶解5.8 g Mg(OH)2需要36.5%HCl溶液________g。漏斗、玻璃棒2HCl+Mg(OH)2==MgCl2+2H2O20 ③由于准确称量Mg(OH)2的步骤繁琐,实验中并不常用,而是通过一定操作方法来达到控制盐酸用量的目的。操作是:将Mg(OH)2加入烧杯中,___________________________________,直到Mg(OH)2完全溶解为止。 (3)制备氯化镁晶体:蒸发浓缩MgCl2溶液,冷却结晶。用胶头滴管逐滴加入稀盐酸溶液 2. 如图为硝酸钾的溶解度曲线,下列说法中,正确的是( ) A. 硝酸钾的溶解度受温度影响不大 B. 100 g水最多能溶解30 g硝酸钾 C. 降温能使接近饱和的硝酸钾溶液变成饱和溶液 D. 20 ℃时硝酸钾的溶解度比40 ℃时硝酸钾的溶解度大C 3. 在无色溶液中,下列离子组能大量共存的是( )A. Ca2+ Na+ CO32- Cl-B. Na+ K+ OH- Cl-C. Cu2+ K+ Cl- NO3-D. H+ Na+ OH- SO42-B 4. 现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量的某物质X,溶液的pH随滴入X的量的变化关系如图所示,则X可能是( )A.水B. 纯碱C. 澄清石灰水D. 稀盐酸B1.从教材习题中选取,2.完成练习册本课时的习题.课后作业
相关资料
更多









