资料中包含下列文件,点击文件名可预览资料内容










还剩30页未读,
继续阅读
所属成套资源:鲁教版化学九年级下册教学课件
成套系列资料,整套一键下载
鲁教版化学九年级下册 第八单元 第三节 海水“制碱”课件
展开
这是一份鲁教版化学九年级下册 第八单元 第三节 海水“制碱”课件,文件包含第1课时氨碱法制纯碱纯碱的性质ppt、第2课时盐的化学性质及复分解反应的实质ppt、复分解反应wmv、碳酸钠碳酸氢钠分别与稀盐酸的反应wmv、碳酸钠溶液与澄清石灰水反应wmv等5份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
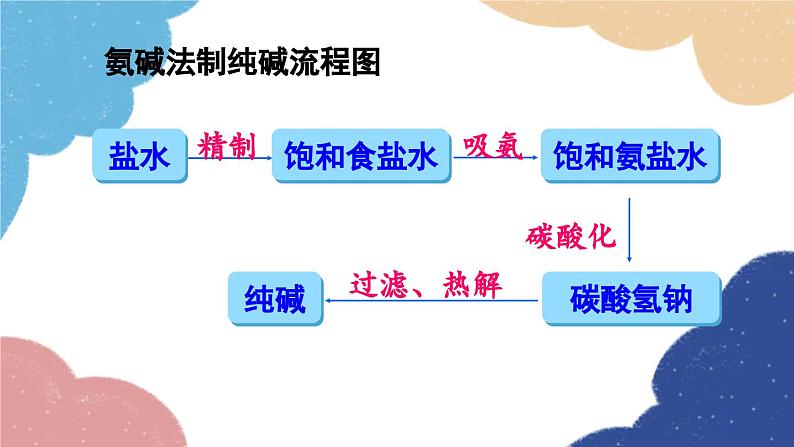
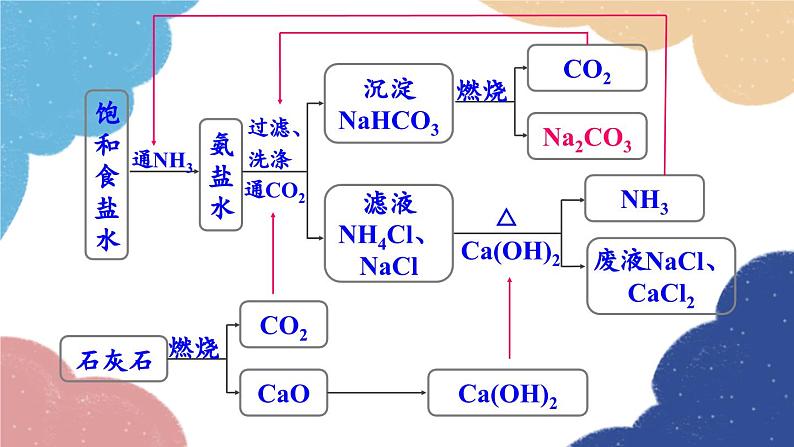
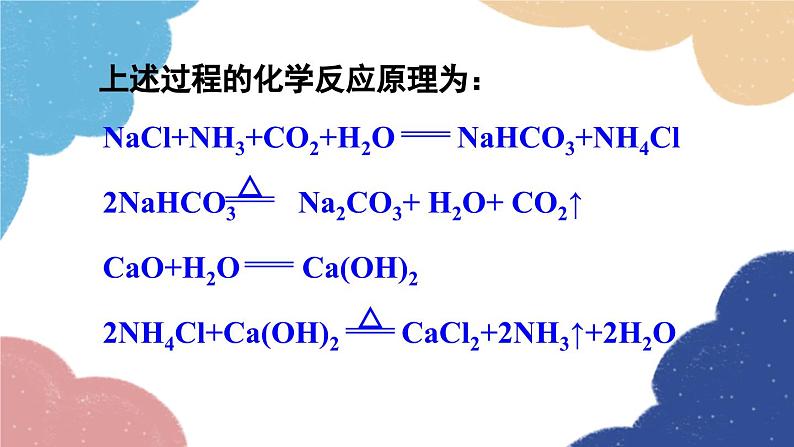
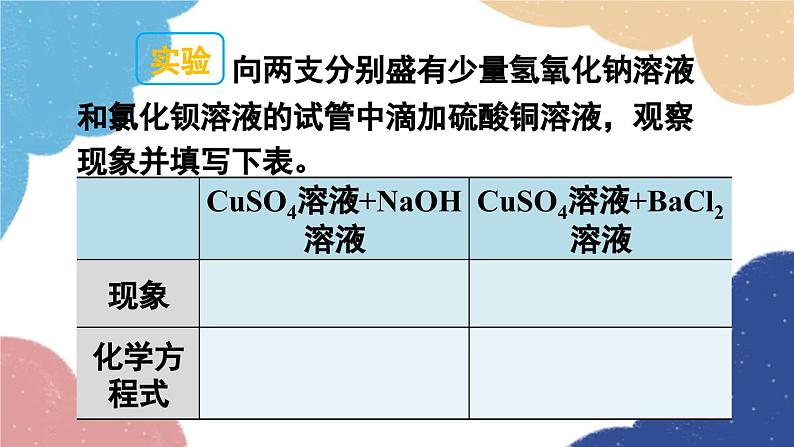
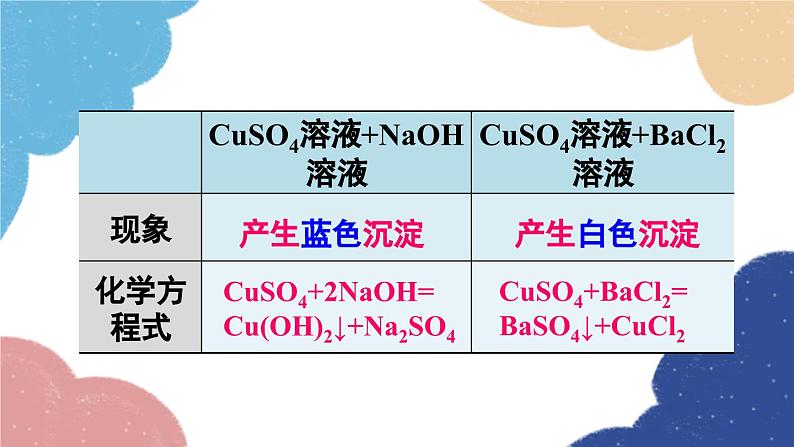
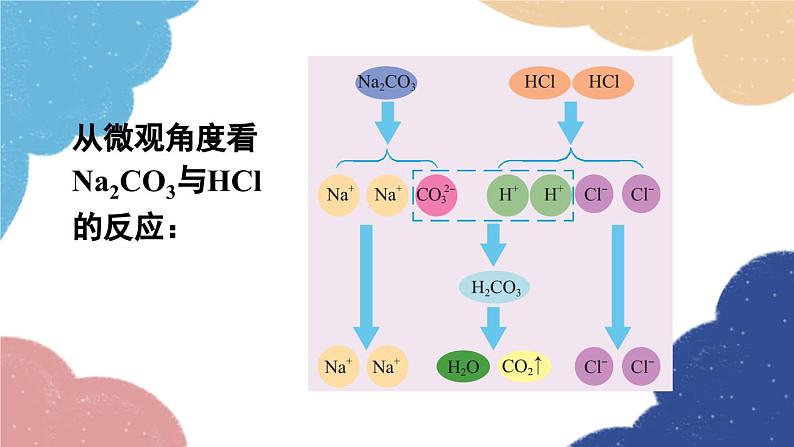
第1课时 氨碱法制纯碱 纯碱的性质第三节 海水制碱鲁教版·九年级化学下册新课导入 纯碱或苏打(主要成分为碳酸钠)是以食盐、石灰石为原料,以氨为媒介,采用氨碱法制得的。探索新知 由NaCl转变为Na2CO3,物质的元素组成发生了什么变化?用NaCl制Na2CO3,还需要什么原料?想一想制取物质时要遵循的几条原则 原料来源是否丰富、易得?价格是否低廉?工艺流程及设备是否简单?生产过程是否安全?是否会造成环境污染? 工业上采用氨碱法生产纯碱,是先向饱和食盐水中通入氨气,制成饱和氨盐水,在加压并不断通入二氧化碳的条件下使碳酸氢钠(NaHCO3)结晶析出,过滤后,将碳酸氢钠加热分解即得纯碱。 氨碱法制纯碱流程图饱和食盐水上述过程的化学反应原理为: 1.在用氨碱法生产纯碱的过程中,为什么要先向饱和食盐水中通入氨气,制成饱和氨盐水,再向其中通入二氧化碳?氨溶于水后生成氨水显碱性,促进CO2的吸收。 2. 氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,哪种物质首先结晶析出?为什么? 相同温度下NaHCO3比NH4Cl溶解度小,所以NaHCO3先析出。NaHCO3HH4Cl分析氨碱法的优点和不足之处优点:原料经济易得CO2和NH3可回收利用能连续生产缺点:回收氨时产生的大量CaCl2用处不大,且污染环境 1926年,我国化学家侯德榜在氨碱法的基础上,创立了更为先进的联合制碱法(侯氏制碱法)。 侯德榜(1890-1974) 向滤出NaHCO3晶体后的NH4Cl溶液中加入食盐,使其中的NH4Cl单独结晶析出,用作氮肥, NaCl溶液则可循环使用。 上述过程的化学反应原理为: 侯氏制碱法保留了氨碱法的优点,克服了其缺点,打破了当时西方国家对制碱技术的垄断,促进了世界制碱技术的发展。 纯碱在通常情况下为______粉末,____溶于水,水溶液显____性。 白色易碱 纯碱在工业生产中用途极广,如石油精炼、粗盐精制、硬水软化、人造纤维及玻璃生产等均需大量的纯碱。纯碱还广泛应用于冶金、造纸、纺织印染和洗涤剂生产等领域。纯碱纯碱的应用碳酸氢钠 碳酸氢钠俗称________,又称酸式碳酸钠,通常是______粉末状晶体,____溶于水,受热____分解。小苏打白色能易 在灭火器里,它是二氧化碳发生剂;在食品工业上,它是发酵粉的主要成分;在制造饮料时,它是一种常用原料;在医疗上,它是治疗胃酸过多的药剂之一 。碳酸氢钠的应用Na2CO3NaHCO3纯碱、苏打小苏打、酸式碳酸钠白色晶体白色粉末可溶显碱性灭火器、制饮料、发酵粉、治疗胃酸石油精炼、洗涤剂、制造玻璃等。易溶显弱碱性受热不易分解受热易分解实验 1与酸碱指示剂作用 取少量碳酸钠固体,加入试管中,加少量蒸馏水后振荡,观察其溶解情况。再滴入2~3滴酚酞试液,观察现象。现象:_____________________结论:碳酸钠______溶于水,溶液显______性。溶液变红色易碱实验 2与酸反应 取少量碳酸钠固体,加入试管中,然后滴加稀盐酸,观察现象。迅速将燃着的木条伸进试管口,观察现象 。现象:_____________________有气泡生成化学方程式:__________________________思考:若用稀硫酸代替稀盐酸进行实验,现象是否相同? 现象:_____________________有气泡生成化学方程式:__________________________碳酸钠、碳酸氢钠与稀盐酸的反应实验 3与氢氧化钙反应 向盛有少量碳酸钠溶液的试管中滴加澄清石灰水,观察现象。 现象:_____________________化学方程式:__________________________有白色沉淀生成碳酸钠与氢氧化钙的反应实验 4与氯化钡反应 向盛有少量碳酸钠溶液的试管中滴加氯化钡溶液,观察现象。 现象:_____________________化学方程式:__________________________有白色沉淀生成随堂演练 1.“侯氏制碱法”的生产过程涉及的主要化学反应如下:①②③请回答:(1)反应①中X的化学式为________。(2)NH4Cl中N元素的化合价为________。(3)除去混在Na2CO3粉末中少量的NaHCO3的方法是______________________________。H2O-3加热Na2CO3和NaHCO3的混合物 2.工业上采用氨碱法生产纯碱的工艺是先向饱和食盐水中通入较多NH3(溶液显碱性),再通入足量的CO2的原因是( ) A.使CO2更易被吸收 B.NH3比CO2更易制取 C.CO2的密度比NH3大 D.为了增大NaHCO3的溶解度A 3.下列说法正确的是( ) A.制纯碱需要的原料有食盐和石灰石 B.海水晒得的粗盐可以直接吸氨制成氨盐水 C.向氨盐水中通入CO2可得到纯碱,溶液经结晶后得到纯碱固体 D.因为氯化钠水溶液呈中性,所以氨盐水也呈中性A 4.图1是“△△牌发酵粉”的部分信息,课外化学兴趣小组的同学对其进行了如下探究(请你完成相应填空):△△牌发酵粉【主要成分】NaHCO3、酒石酸【用途】面粉发酵,焙制糕点【用法】取本品适量加水溶解与面团揉和或直接与面团揉和后加热图 1图 2【查阅资料】(1)酒石酸是一种易溶于水的固 体有机酸;(2)发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致;(3)Na2CO3受热不分解。【提出问题】NaHCO3在发酵粉加水或加热时如何产生CO2?【假设猜想】甲:…… 乙:酒石酸与NaHCO3在溶液中反应产生 CO2。 丙:NaHCO3加热产生CO2。【实验探究】(1)小明同学取少量NaHCO3粉末于试管中,加入适量水,无气体产生,从而否定了猜想甲,则猜想甲是________________________________。小明又将酒石酸溶液和NaHCO3溶液混合,产生了CO2,从而验证了猜想乙,说明了NaHCO3具有的性质之一是______________________。(2)小英同学为探究猜想丙设计了图2所示的实验装置:小英另取适量NaHCO3粉末加入a试管中,NaHCO3和水反应产生二氧化碳NaHCO3能与酸反应加热,观察到a试管口有水生成,b试管中澄清石灰水变浑浊。b试管中反应的化学方程式为___________________________________________。持续加热直至两支试管均不再发生变化时,发现a试管中仍残留有较多白色固体粉末,向该粉末中滴加稀盐酸,有CO2产生,说明该粉末是______。【实验小结】NaHCO3在发酵粉中产生CO2的条件是_______;NaHCO3受热发生变化的化学方程式为__________________________________。Ca(OH)2+CO2=CaCO3↓+H2ONa2CO3加热课堂小结1.从教材习题中选取,2.完成练习册本课时的习题.课后作业
第1课时 氨碱法制纯碱 纯碱的性质第三节 海水制碱鲁教版·九年级化学下册新课导入 纯碱或苏打(主要成分为碳酸钠)是以食盐、石灰石为原料,以氨为媒介,采用氨碱法制得的。探索新知 由NaCl转变为Na2CO3,物质的元素组成发生了什么变化?用NaCl制Na2CO3,还需要什么原料?想一想制取物质时要遵循的几条原则 原料来源是否丰富、易得?价格是否低廉?工艺流程及设备是否简单?生产过程是否安全?是否会造成环境污染? 工业上采用氨碱法生产纯碱,是先向饱和食盐水中通入氨气,制成饱和氨盐水,在加压并不断通入二氧化碳的条件下使碳酸氢钠(NaHCO3)结晶析出,过滤后,将碳酸氢钠加热分解即得纯碱。 氨碱法制纯碱流程图饱和食盐水上述过程的化学反应原理为: 1.在用氨碱法生产纯碱的过程中,为什么要先向饱和食盐水中通入氨气,制成饱和氨盐水,再向其中通入二氧化碳?氨溶于水后生成氨水显碱性,促进CO2的吸收。 2. 氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,哪种物质首先结晶析出?为什么? 相同温度下NaHCO3比NH4Cl溶解度小,所以NaHCO3先析出。NaHCO3HH4Cl分析氨碱法的优点和不足之处优点:原料经济易得CO2和NH3可回收利用能连续生产缺点:回收氨时产生的大量CaCl2用处不大,且污染环境 1926年,我国化学家侯德榜在氨碱法的基础上,创立了更为先进的联合制碱法(侯氏制碱法)。 侯德榜(1890-1974) 向滤出NaHCO3晶体后的NH4Cl溶液中加入食盐,使其中的NH4Cl单独结晶析出,用作氮肥, NaCl溶液则可循环使用。 上述过程的化学反应原理为: 侯氏制碱法保留了氨碱法的优点,克服了其缺点,打破了当时西方国家对制碱技术的垄断,促进了世界制碱技术的发展。 纯碱在通常情况下为______粉末,____溶于水,水溶液显____性。 白色易碱 纯碱在工业生产中用途极广,如石油精炼、粗盐精制、硬水软化、人造纤维及玻璃生产等均需大量的纯碱。纯碱还广泛应用于冶金、造纸、纺织印染和洗涤剂生产等领域。纯碱纯碱的应用碳酸氢钠 碳酸氢钠俗称________,又称酸式碳酸钠,通常是______粉末状晶体,____溶于水,受热____分解。小苏打白色能易 在灭火器里,它是二氧化碳发生剂;在食品工业上,它是发酵粉的主要成分;在制造饮料时,它是一种常用原料;在医疗上,它是治疗胃酸过多的药剂之一 。碳酸氢钠的应用Na2CO3NaHCO3纯碱、苏打小苏打、酸式碳酸钠白色晶体白色粉末可溶显碱性灭火器、制饮料、发酵粉、治疗胃酸石油精炼、洗涤剂、制造玻璃等。易溶显弱碱性受热不易分解受热易分解实验 1与酸碱指示剂作用 取少量碳酸钠固体,加入试管中,加少量蒸馏水后振荡,观察其溶解情况。再滴入2~3滴酚酞试液,观察现象。现象:_____________________结论:碳酸钠______溶于水,溶液显______性。溶液变红色易碱实验 2与酸反应 取少量碳酸钠固体,加入试管中,然后滴加稀盐酸,观察现象。迅速将燃着的木条伸进试管口,观察现象 。现象:_____________________有气泡生成化学方程式:__________________________思考:若用稀硫酸代替稀盐酸进行实验,现象是否相同? 现象:_____________________有气泡生成化学方程式:__________________________碳酸钠、碳酸氢钠与稀盐酸的反应实验 3与氢氧化钙反应 向盛有少量碳酸钠溶液的试管中滴加澄清石灰水,观察现象。 现象:_____________________化学方程式:__________________________有白色沉淀生成碳酸钠与氢氧化钙的反应实验 4与氯化钡反应 向盛有少量碳酸钠溶液的试管中滴加氯化钡溶液,观察现象。 现象:_____________________化学方程式:__________________________有白色沉淀生成随堂演练 1.“侯氏制碱法”的生产过程涉及的主要化学反应如下:①②③请回答:(1)反应①中X的化学式为________。(2)NH4Cl中N元素的化合价为________。(3)除去混在Na2CO3粉末中少量的NaHCO3的方法是______________________________。H2O-3加热Na2CO3和NaHCO3的混合物 2.工业上采用氨碱法生产纯碱的工艺是先向饱和食盐水中通入较多NH3(溶液显碱性),再通入足量的CO2的原因是( ) A.使CO2更易被吸收 B.NH3比CO2更易制取 C.CO2的密度比NH3大 D.为了增大NaHCO3的溶解度A 3.下列说法正确的是( ) A.制纯碱需要的原料有食盐和石灰石 B.海水晒得的粗盐可以直接吸氨制成氨盐水 C.向氨盐水中通入CO2可得到纯碱,溶液经结晶后得到纯碱固体 D.因为氯化钠水溶液呈中性,所以氨盐水也呈中性A 4.图1是“△△牌发酵粉”的部分信息,课外化学兴趣小组的同学对其进行了如下探究(请你完成相应填空):△△牌发酵粉【主要成分】NaHCO3、酒石酸【用途】面粉发酵,焙制糕点【用法】取本品适量加水溶解与面团揉和或直接与面团揉和后加热图 1图 2【查阅资料】(1)酒石酸是一种易溶于水的固 体有机酸;(2)发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致;(3)Na2CO3受热不分解。【提出问题】NaHCO3在发酵粉加水或加热时如何产生CO2?【假设猜想】甲:…… 乙:酒石酸与NaHCO3在溶液中反应产生 CO2。 丙:NaHCO3加热产生CO2。【实验探究】(1)小明同学取少量NaHCO3粉末于试管中,加入适量水,无气体产生,从而否定了猜想甲,则猜想甲是________________________________。小明又将酒石酸溶液和NaHCO3溶液混合,产生了CO2,从而验证了猜想乙,说明了NaHCO3具有的性质之一是______________________。(2)小英同学为探究猜想丙设计了图2所示的实验装置:小英另取适量NaHCO3粉末加入a试管中,NaHCO3和水反应产生二氧化碳NaHCO3能与酸反应加热,观察到a试管口有水生成,b试管中澄清石灰水变浑浊。b试管中反应的化学方程式为___________________________________________。持续加热直至两支试管均不再发生变化时,发现a试管中仍残留有较多白色固体粉末,向该粉末中滴加稀盐酸,有CO2产生,说明该粉末是______。【实验小结】NaHCO3在发酵粉中产生CO2的条件是_______;NaHCO3受热发生变化的化学方程式为__________________________________。Ca(OH)2+CO2=CaCO3↓+H2ONa2CO3加热课堂小结1.从教材习题中选取,2.完成练习册本课时的习题.课后作业
相关资料
更多









