

所属成套资源:2024常熟高二上学期期中考试及答案(九科)
- 2024常熟高二上学期期中考试政治含解析 试卷 0 次下载
- 2024常熟高二上学期期中考试地理含解析 试卷 0 次下载
- 2024常熟高二上学期期中考试历史含解析 试卷 1 次下载
- 2024常熟高二上学期期中考试生物含解析 试卷 1 次下载
- 2024常熟高二上学期期中考试物理含解析 试卷 0 次下载
2024常熟高二上学期期中考试化学含答案
展开
这是一份2024常熟高二上学期期中考试化学含答案,共12页。试卷主要包含了11,6g被含0,05ml与0等内容,欢迎下载使用。
2023.11
注意事项:
1.本试卷分为选择题和非选择题两部分,共100分.调研时间75分钟.
2.将选择题的答案填涂在答题卡的对应位置,非选择题的答案写在答题卡的指定栏目内.
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23
第I卷(选择题,共42分)
一、单项选择题:(共14题,每题3分,共42分.每题只有一个选项最符合题意.)
1.化学与生产、生活及社会发展密切相关,下列叙述正确的是( )
A.免洗洗手液的有效成分之一活性银离子能使病毒蛋白质变性
B.“酒曲”的酿酒工艺是利用催化剂使平衡正向移动的原理
C.华为5G手机麒麟9000芯片主要成分是二氧化硅
D.葛洪所著《抱朴子》中“丹砂(HgS)烧之成水银,积变(常温混合)又还原成丹砂”,二者为可逆反应
2.下列有关化学用语表示正确的是( )
A.潮湿空气中铁钉发生吸氧腐蚀时的负极反应为
B.电解精炼铜时,阴极的电极反应式为
C.在中完全燃烧,生成2ml,放出571.6kJ的热量,表示燃烧热的热化学方程式为
D.情性电极电解氯化镁溶液的离子方程式为
3.下列各装置能达到相应实验目的的是( )
A.图甲,中和热的测定B.图乙,该装置可持续供电
C.图丙,在铁制品表面镀锌D.图丁,测定稀硫酸的pH
4.已知: 在不同条件下反应进程的能量变化如图所示.下列说法正确的是( )
A.该反应低温下能自发进行
B.过程b使用了催化剂,降低了正反应的活化能,使反应的减小
C.恒温恒容条件下通入氦气,单位体积内反应物的活化分子数增多,反应速率加快
D.该反应中,反应物断键所吸收的总能量大于生成物成键所放出的总能量
5.1000K时,在密闭容器内发生反应: ,下列图像与该反应体系相符的是( )
图1图2图3图4
A.图1表示温度对反应的影响B.图2表示压强对物质平衡百分含量的影响
C.图3表示恒容再充入D.图4表示体积增大至原来的2倍
6.在潮湿的深层土壤中钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论认为厌氧细菌可促使与反应生成,加速钢管腐蚀,其反应原理如图所示.下列说法正确的是( )
A.正极反应式为
B.钢管腐蚀的产物中仅含有FeS
C.向钢中加入Cu制成合金可减缓钢管的腐蚀
D.与反应可表示为
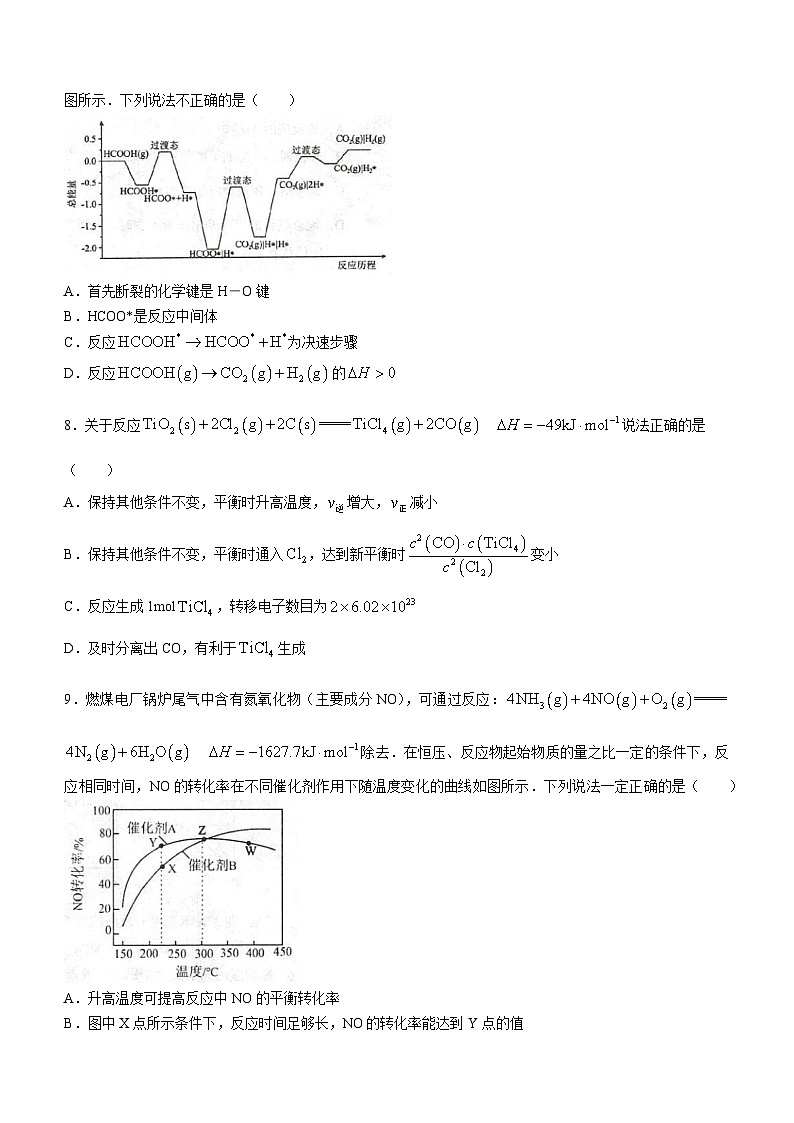
7.在某金()催化剂表面HCOOH分解的能量与反应历程(吸附在金催化剂表面上的物种用*标注)如图所示.下列说法不正确的是( )
A.首先断裂的化学键是H―O键
B.HCOO*是反应中间体
C.反应为决速步骤
D.反应的
8.关于反应 说法正确的是( )
A.保持其他条件不变,平衡时升高温度,增大,减小
B.保持其他条件不变,平衡时通入,达到新平衡时变小
C.反应生成1ml,转移电子数目为
D.及时分离出CO,有利于生成
9.燃煤电厂锅炉尾气中含有氮氧化物(主要成分NO),可通过反应: 除去.在恒压、反应物起始物质的量之比一定的条件下,反应相同时间,NO的转化率在不同催化剂作用下随温度变化的曲线如图所示.下列说法一定正确的是( )
A.升高温度可提高反应中NO的平衡转化率
B.图中X点所示条件下,反应时间足够长,NO的转化率能达到Y点的值
C.催化剂B的性能优于催化剂A
D.图中Z点到W点NO的转化率降低的原因是平衡逆向移动
10.下列有关有机物的叙述正确的是( )
①淀粉和纤维素水解的最终产物都是葡萄糖,两者互为同分异构体;
②油脂没有固定的熔沸点;
③用甘氨酸和丙氨酸缩合最多可形成4种二肽;
④糖类、油脂、蛋白质、天然橡胶都属于天然高分子化合物;
⑤蔗糖、麦芽糖、硬脂酸甘油酯在酸性条件下水解都能得到两种物质
A.②③B.①④C.③④D.②⑤
11.将一定量纯净的氨基甲酸铵固体置于密闭容器中,发生反应:
,该反应的平衡常数的负对数随温度(T)的变化如图所示,下列说法不正确的是( )
A.该反应的
B.A点对应状态的平衡常数K的值为
C.30℃时,B点对应状态的
D.混合气体的平均摩尔质量不变时,可以判断该反应已达到平衡状态
12.室温下,下列实验探究方案能达到探究目的的是( )
13.某钠离子电池结构如图所示,电极A为含钠过渡金属氧化物(),电极B为硬碳,充电时得电子成为Na嵌入硬碳中.下列说法不正确的是( )
A.充电时,电极B与外接直流电源的负极相连
B.放电时,外电路通过电子时,A极区电解质损失
C.放电时,电极A为正极,反应可表示为
D.电池总反应可表示为
14.催化加氢可合成二甲醚,发生的主要反应有:
反应Ⅰ:;
反应Ⅱ:;
在恒压、起始投料比时,若仅考虑上述反应,平衡时和CO的选择性及的转化率随温度的变化如图中实线所示.
的选择性,下列说法不正确的是( )
A.图中曲线③表示平衡时转化率随温度的变化
B.
C.平衡时转化率随温度的变化如图中虚线所示
D.200℃时,使用对反应Ⅰ选择性高的催化剂可提高的生产效率
第Ⅱ卷(非选择题,共58分)
二、非选择题:(共4题,共58分.)
15.(15分)工业合成氨是人类科技的一项重大突破,目前我国氨生产能力位居世界首位.
(1)传统合成氨原理为: .
①在恒温恒容密闭容器中充入2ml和6ml进行合成氨反应,下列能说明该反应已达平衡状态的是______.
a.断裂6ml H―H同时生成6ml N―Hb.容器内压强保持不变
c.混合气体密度保持不变d.容器内、、物质的量之比为1∶3∶2
e.的百分含量保持不变
②已知传统合成氨反应的速率方程为:,在合成氨过程中,需要不断分离出氨,可能的原因为______.
(2)常压电化学法合成氨电解装置如题15图所示.
题15图
已知熔融NaOH―KOH为电解液,纳米起催化作用,在电极上发生反应生成中间体Fe.
①该法在合成氨过程中能量的转化形式为______;惰性电极Ⅱ是电解池的______极.
②惰性电极Ⅰ上生成中间体Fe的电极反应方程式为______:由中间体Fe反应生成的化学方程式为______.
(3)基于载氮体的碳基化学链合成氨技术反应如下:
吸氮反应:
释氮反应:
T℃时,向体积为2L装有足量和C的恒容密闭容器中充入2ml进行吸氮反应,达到平衡时氮气转化率为50%,计算此条件下吸氮反应的平衡常数______.
16.(15分)空气中含量的控制和资源化利用具有重要意义.
Ⅰ.在金属催化剂作用下可转化为乙二醇和甲醇;若反应温度过高,乙二醇会深度加氢生成乙醇.
获取乙二醇的反应历程分为如下2步:
步骤1
步骤2
(1)步骤2反应的______.
(2)研究反应温度对步骤2加氢反应的影响(反应时间均为4h),实验数据见下表:
由上表可知,温度越高,的转化率越高,原因是______.温度升高到220℃时,乙二醇的产率反而降低,原因是______.
Ⅱ.利用“Na-”电池将变废为宝.我国科研人员研制出的可充电“Na-”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为.
放电时该电池“吸入”,生成和C全部沉积在电极表面.其工作原理如题16图-1所示:
(3)放电时,外电路中电流流入的一极为______(填“钠箔”或“MWCNT”).
(4)放电时,正极的电极反应式为______.-四甘醇二甲醚作电解液的优点是______(写出两点).
题16图-1题16图-2
Ⅲ.与反应如果用C/C作为催化剂,可以得到含有少量甲酸的甲醇.
(5)在相同条件下,将C/C催化剂循环使用,随着循环使用次数增加,甲醇产量如题16图2所示,试推测甲醇产量变化的原因:______(C的性质与Fe相似).
17.(12分)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
(1)甲醇制取甲醛时可获得氢气,其原理为.已知部分化学键的键能数据如下表:
则该反应的______.
(2)以甲烷和为原料制取氢气是工业上常用的制氢方法.
已知:
甲烷与制取氢气时,常向反应器中通入一定比例空气,其目的是______.
(3)的热分解也可得到,高温下水分解体系中各种微粒的体积分数与温度的关系如题17图-1所示.图中A、B表示的微粒依次是______.
题17图-1题17图-2
(4)一定条件下,利用题17图-2所示装置实现的电化学储氢(忽略其它有机物的反应).
①写出由生成的电极反应式:______.
②该装置的电流效率______.(×100%)
18.(16分)CO、的过度排放对环境和人体健康带来极大的危害,工业上可采取多种方法减少这些有害气体的排放.
Ⅰ.汽车尾气中的NO和CO在催化转化器中反应生成两种无毒无害的气体:
.
(1)已知该反应的,(、为速率常数,只与温度有关).若平衡后降低温度,则______(填“增大”“不变”或“减小”).
(2)将CO和NO按不同比例投入一密闭容器中,控制一定温度(或),发生反应达到平衡时,所得的混合气体中的体积分数随的变化曲线如题18图-1所示.
①______(填“>”或“<”或“=”).
②图中a、b、c、d对应NO转化率最大的是______.
题18图-1题18图-2
Ⅱ.催化还原NO.
(3)有氧条件下,在Fe基催化剂表面,还原NO的反应机理如题18图-2所示,该过程可描述为______.
Ⅲ.低温等离子体技术氧化NO.
(4)近年来,低温等离子体技术是在高压放电下,产生O*自由基,O*自由基将NO氧化为后,再用溶液吸收,达到消除NO的目的.实验室将模拟气(、、NO)以一定流速通入低温等离子体装置,实验装置如题18图-3所示.
题18图-3题18图-4
①若4.6g被含0.05ml的溶液充分吸收,转移电子数为0.05ml,则此反应的离子方程式为______.
②其他条件相同,等离子体的电功率与NO转化率的关系如题18图-4所示,当电功率大于30W时,NO转化率下降的原因可能是______.
选项
探究方案
探究目的
A
向溶液中滴入硫酸酸化的溶液,观察溶液颜色变化
探究与氧化性强弱
B
将0.05ml与0.1ml混合,在一定条件下充分反应后,将混合气体通入品红溶液,观察品红溶液颜色变化
探究该反应属于可逆反应
C
向20%蔗糖溶液中加入少量稀硫酸,加热一段时间后,再加入银氨溶液;观察是否有银镜出现
探究蔗糖水解程度
D
分别往甲:4mL、乙:4mL的酸性溶液中加入2mL溶液,记录褪色时间
探究反应物浓度对化学反应速率的影响
反应温度/℃
的转化率/%
乙二醇的产率/%
160
23.8
23.2
180
62.1
60.9
200
99.9
94.7
220
99.9
92.4
化学键
C―H
C―O
O―H
C=O
H―H
键能/
413.4
351.0
462.8
745.0
436.0
2023~2024学年第一学期期中试卷
高二化学参考答案
2023.11
一、选择题:本题包括14小题,每小题3分,共计42分.
第Ⅱ卷(选择题,共58分)
二、非选择题:本题包括4小题,共计58分.
15.(15分)
(1)①be(2分) ②加快合成氨反应速率:使反应正向进行程度增大,提高氨的产率.(2分)
(2)①电能转化为化学能(1分) 阳(1分)
②(3分)(3分)
(3)6.75(3分)
16.(15分)
(1)(2分)
(2)温度越高,反应速率越快,反应相同的时间,转化的的量越多,故的转化率越高.
温度升高到220℃时,乙二醇会深度加氢生成乙醇,的转化率保持不变,乙二醇的产率降低.(2分×2)
(3)钠箔(2分)
(4)(3分)导电性好,不与金属钠反应,难挥发(写出任意两点都可得分)(2分)
(5)反应产生的甲酸腐蚀催化剂,使催化剂活性降低(2分)
17.(12分)
(1)(3分) (2)部分甲烷燃烧,可为与的反应提供热量(2分)
(3)H、O(2分,各1分) (4)①(3分)②64.3%(2分)
18.(16分)(1)减小(2分) (2)①<(2分) ②c(2分)
(3)在Fe基催化剂表面,吸附在酸性配位点上形成,NO与吸附在配位点上形成,然后与结合生成,最后与NO反应生成、,并从催化剂表面逸出(4分)
(4)①(3分)1
2
3
4
5
6
7
8
9
10
11
12
13
14
A
B
C
A
C
D
C
D
B
A
D
B
B
C
相关试卷
这是一份江苏省常熟市2023-2024学年高二上学期期中考试化学试卷,共11页。试卷主要包含了11,6g被含0,75,05ml与0等内容,欢迎下载使用。
这是一份江苏省常熟市2023-2024学年高二上学期期中考试化学试卷(PDF版含答案),共9页。
这是一份2021常熟高一上学期期中考试化学含答案,共8页。试卷主要包含了11,可能用到的相对原子质量,下列有关化学实验操作正确的是,下列说法正确的的是等内容,欢迎下载使用。








