
所属成套资源:全套2024届高考化学一轮复习专题学案
2024届高考化学一轮复习专题10第56讲常见气体制备方法及装置的研究能力学案
展开
这是一份2024届高考化学一轮复习专题10第56讲常见气体制备方法及装置的研究能力学案,共24页。
常见气体的制备、净化、收集和尾气处理
1.气体制备实验的基本思路
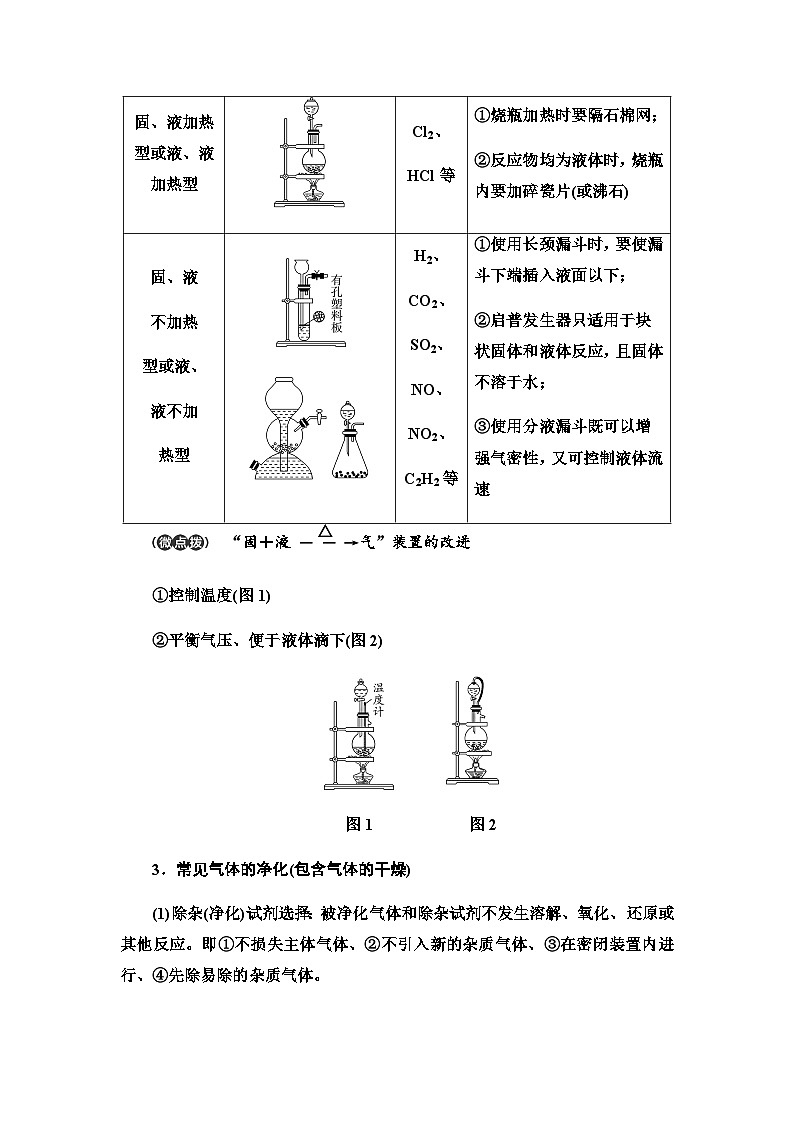
2.常见气体的发生装置
“固+液eq \(――→,\s\up9(△))气”装置的改进
①控制温度(图1)
②平衡气压、便于液体滴下(图2)
图1 图2
3.常见气体的净化(包含气体的干燥)
(1)除杂(净化)试剂选择:被净化气体和除杂试剂不发生溶解、氧化、还原或其他反应。即①不损失主体气体、②不引入新的杂质气体、③在密闭装置内进行、④先除易除的杂质气体。
(2)气体干燥净化装置
酸性干燥剂(浓硫酸、P2O5):不能干燥NH3等碱性气体;碱性干燥剂(碱石灰、NaOH、CaO):不能干燥SO2、Cl2等酸性气体;中性干燥剂(CaCl2):不能干燥NH3。
4.常见气体的收集方法
(1)排水法:收集难溶于水且不与水反应的气体,如O2、H2、N2、NO、CO、C2H4等。
(2)排液法:收集难溶于所选溶液的气体,如Cl2用排饱和食盐水法收集。
(3)向上排空气法:收集气体密度比空气大且相差较大又不与空气中成分反应的气体,如Cl2、CO2、NO2等。
(4)向下排空气法:收集气体密度比空气小且不与空气中成分反应的气体,如CH4、H2、NH3等。
①“万能收集瓶”的使用
②排液集气收集装置的创新
5.尾气处理的原因、方法及装置
(1)原因:有些气体有毒或有可燃性,任其逸散到空气中,会污染空气或者引发火灾、爆炸等灾害。
(2)处理方法:一般使其转化为非气态物质或无毒物质,如酸性有毒气体用碱溶液吸收,可燃性气体用点燃等措施处理。
(3)尾气处理装置(Cl2尾气—b,CO、H2尾气—ac)
尾气吸收防倒吸装置
1.下列实验方案最合理的是( )
A.制备并收集Cl2 B.制备氨气
C.制备并收集NO2气体 D.制备氧气
[答案] B
2.下列实验装置或原理能达到实验目的的是( )
A.制NH3B.干燥NH3
C.收集NH3D.测氨水的pH
C [A.氨气易溶于水,应用氯化铵固体和氢氧化钙固体加热制取氨气,故A错误;B.氨气能与浓硫酸反应,不能用浓硫酸干燥氨气,故B错误;C.氨气的密度比空气小,集气瓶中导气管应短口进长口出,氨气易溶于水,能用水吸收多余氨气,防止污染环境,故C正确;D.测定氨水pH时,不能用湿润的pH试纸,相当于把氨水稀释,故D错误。]
3.水合肼(N2H4·H2O)是重要的氢能源稳定剂,其制备的反应原理为NaClO+2NH3===N2H4·H2O+NaCl。下列装置和操作不能达到实验目的的是( )
A.在装置甲的圆底烧瓶中加入碱石灰制取NH3
B.用装置乙作为反应过程的安全瓶
C.制备水合肼时从装置丙的b口通入NH3
D.用装置丁吸收反应中过量的NH3
C [浓氨水遇碱放出氨气,在装置甲的圆底烧瓶中加入碱石灰可以制取NH3,故A正确;氨气极易溶于水,为防止倒吸,用装置乙作为反应过程的安全瓶,故B正确;氨气密度比空气小,为有利于氨气和NaClO溶液反应,制备水合肼时应从装置丙的a口通入NH3,故C错误;氨气会污染环境,用装置丁可以吸收反应中过量的NH3,并能防止倒吸,故D正确。]
4.实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )
A.①是氨气发生装置
B.②是氨气吸收装置
C.③是氨气发生装置
D.④是氨气收集、检验装置
C [A.①装置NH4Cl加热分解生成HCl和NH3,在试管口处NH3和HCl气体遇冷会再反应生成NH4Cl,收集不到NH3,A错误;B.NH3极易溶于水,NH3溶解导致导气管中气体压强减小而引发倒吸现象,因此②不能用于NH3的吸收,B错误;C.③装置用浓氨水加热可分解制得NH3,C正确;D.由于NH3的密度比空气小,因此收集NH3可以采用向下排空气法,为防止空气对流应在试管口塞一团棉花,D错误。]
5.无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL甲气体经过图中实验的处理结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )
A.NH3、NO2、N2 B.NO、CO2、N2
C.NH3、NO2、CO2 D.NH3、NO、CO2
D [无色气体一定不含NO2,可排除选项AC,最后几乎无气体剩余,则不含氮气,可排除选项B,则一定含NH3、NO、CO2。]
气体制备、性质探究综合实验的仪器连接
1.“仪器连接顺序”正确思维流程
2.接口连接三个细节
(1)净化装置应“长”进“短”出,如图1。
(2)量气装置应“短”进“长”出,如图2。
(3)干燥管应“粗”进“细”出,如图3。
图1 图2 图3
3.防堵塞安全装置
实验室制取次磷酸钠。将黄磷(P4)和过量烧碱溶液混合加热,生成NaH2PO2和PH3,PH3与NaClO溶液反应也可生成次磷酸钠。
(1)利用以下装置制取次磷酸钠,正确的连接顺序是________(用小写字母表示)。
A B
C D
(2)装置C的作用为_____________________________________________
_____________________________________________________________,
装置D的作用为_______________________________________________
_____________________________________________________________。
(3)装置B中发生反应的化学方程式为____________________________
_____________________________________________________________。
[思路点拨] ①明确实验原理与目的eq \b\lc\{\rc\ (\a\vs4\al\c1(P4+NaOH―→NaH2PO2+PH3,PH3+NaClO―→NaH2PO2))
②明确各装置的可能作用
A.利用PH3与NaClO制NaH2PO2
B.利用P4与NaOH反应制PH3和NaH2PO2
C.防止倒吸或收集瓶
D.吸收尾气且防止倒吸
[答案] (1)cdeabf (2)防止倒吸,作安全瓶 吸收PH3且防止倒吸
(3)P4+3NaOH+3H2Oeq \(=====,\s\up9(△))3NaH2PO2+PH3↑
根据实验原理和目的,进行仪器连接
1.学习小组根据下述各装置制备NaN3。
查阅资料:
Ⅰ.氨基钠(NaNH2)熔点为208 ℃,易潮解和氧化;N2O有强氧化性,不与酸、碱反应;叠氮酸(HN3)不稳定,易分解爆炸。
Ⅱ.2HNO3+8HCl+4SnCl2===4SnCl4+5H2O+N2O↑,2NaNH2+N2Oeq \(=====,\s\up9(△))NaN3+NaOH+NH3。
回答下列问题:
(1)按气流方向,上述装置合理的连接顺序为____________(填仪器接口字母)。
(2)实验时E中生成SnO2·xH2O沉淀,反应的化学方程式为____________________________________________________________________
__________________________________________________________________。
(3)C处充分反应后,停止加热,需继续进行的操作为________,其目的为____________________________________________________________________
___________________________________________________________________。
[解析] (1)由实验目的和原理知,A用于制备N2O,D用于吸收N2O中混有的HNO3和水蒸气,C用于制备NaN3,B用于防止E中水蒸气进入C中干扰实验,E用于尾气处理。则按气流方向,上述装置合理的连接顺序为afg(或gf)debch。
[答案] (1)afg(或gf)debch (2)SnCl2+N2O+(x+1)H2O===SnO2·xH2O↓+N2+2HCl
(3)继续通入N2O至三颈瓶冷却后,关闭分液漏斗活塞 防止E中液体倒吸入B中
对实验综合连接装置的分析与评价
2.AlCl3是有机反应的重要催化剂。用下列装置制备AlCl3。
已知:实验室在常温下用KMnO4和浓盐酸反应制备Cl2。AlCl3易潮解,升华温度为178 ℃。
(1)图中明显错误的有________(填字母标号),修改后,进行实验。
a.1处 b.2处
c.3处 d.4处
(2)装置A中发生反应的离子方程式为______________________________
______________________________________________________________。
(3)装置B的作用是_____________________________________________。
若装置F中没有气体逸出,可能生成________种盐(填数字)。
[解析] (1)氯化铝易凝华,导出氯化铝的导管太细,易堵塞导管;氯化铝易潮解,装置F中饱和纯碱溶液中水易挥发进入装置E,使产品变质,共2处错误。(2)高锰酸钾与浓盐酸反应生成氯化钾、二氯化锰、氯气和水。(3)饱和食盐水用于除去氯气中少量氯化氢,否则氯化氢与铝反应生成氢气,氢气与氯气混合受热易发生事故。没有气体逸出,说明氯气与碳酸钠溶液反应,没有二氧化碳产生,即发生反应为2Na2CO3+Cl2+H2O===NaCl+2NaHCO3+NaClO,生成3种盐。
[答案] (1)b
(2)2MnOeq \\al(-,4)+10Cl-+16H+===2Mn2++5Cl2↑+8H2O
(3)除去Cl2中的HCl 3
1.(2022·北京等级考,T10)利用如图所示装置(夹持装置略)进行实验,b中现象不能证明a中产物生成的是( )
A [浓硝酸具有挥发性,挥发出的硝酸也能与碘化钾溶液反应生成遇淀粉溶液变蓝色的碘,则淀粉碘化钾溶液变蓝色不能说明浓硝酸分解生成二氧化氮,故A符合题意。]
2.(2020·江苏高考,T5)实验室以CaCO3为原料,制备CO2并获得CaCl2·6H2O晶体。下列图示装置和原理不能达到实验目的的是( )
A.制备CO2 B.收集CO2
C.滤去CaCO3 D.制得CaCl2·6H2O
D [A对,碳酸钙与稀盐酸反应可制备CO2,且为固液常温型反应,装置也正确;B对,CO2密度比空气大,可以用向上排空气法收集;C对,分离固体与液体,可采用过滤的方法;D错,CaCl2·6H2O晶体可以通过蒸发浓缩、冷却结晶、过滤的方法制得,采用蒸发结晶法易导致CaCl2·6H2O失去结晶水。]
3.SO2和焦亚硫酸钠(Na2S2O5)可用作食品添加剂。回答下列问题:
(1)实验室用H2SO4和NaHSO3制取SO2的化学方程式为____________________________________________________________________
___________________________________________________________________。
欲净化与收集SO2,选择必要装置,按气流方向连接顺序为________(填仪器接口的字母编号)。
(2)焦亚硫酸钠易被氧化而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。
已知:2NaHSO3Na2S2O5+H2O。
试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
(3)某小组利用下列装置测定空气中SO2的含量。
已知该反应的化学方程式为:SO2+I2+2H2O===H2SO4+2HI。若空气流速为a m3·min-1,当观察到________时,结束计时,测定耗时t min。假定样品中的SO2可被溶液充分吸收,该空气样品中SO2的含量是________mg·m-3。
[解析] H2SO4和NaHSO3发生复分解反应制取SO2,装置连接顺序按照制取气体、净化、收集,尾气处理连接。在检验物质成分时,若样品已经变质,则溶液中含有SOeq \\al(2-,4),可根据BaSO4是白色既不溶于水也不溶于酸的性质检验;若样品为完全变质,则溶液中含有HSOeq \\al(-,3),该物质具有还原性,能够被酸性KMnO4溶液氧化而使溶液褪色,据此判断。在测定空气中SO2的含量时,可根据方程式SO2+I2+2H2O===H2SO4+2HI中物质转化关系,n(SO2)=n(I2),结合m=n·M计算SO2的质量,再结合空气的流速及通气时间计算该空气样品中SO2的含量。(1)实验室用H2SO4和NaHSO3发生复分解反应制取SO2,该反应的化学方程式为:H2SO4+2NaHSO3===Na2SO4+2H2O+2SO2↑;实验室用上述方法制取的SO2中含有水蒸气,可浓硫酸吸收,导气管长进短出。然后根据SO2气体的密度比空气大,用向上排空气的方法收集,多余气体用碱石灰吸收,故装置按气流方向连接顺序为baefgh;(2)Ⅱ.取少量实验Ⅰ的溶液,溶于足量稀盐酸,振荡、静置,滴加BaCl2溶液,若出现沉淀,则样品已氧化变质;Ⅲ.另取实验Ⅰ的溶液,向其中加入酸性KMnO4溶液,充分振荡,若观察到酸性KMnO4溶液褪色,说明溶液中含有焦亚硫酸钠,即样品未完全氧化变质;(3)在100 mL 0.1000 ml/L碘溶液中含有溶质I2的物质的量n(I2)=0.1000 ml/L×0.1 L=0.0100 ml,含有SO2的空气不断通入碘水中,发生反应:SO2+I2+2H2O===H2SO4+2HI,当碘水中I2恰好消耗完全时,含有淀粉的I2溶液蓝色消失,此时停止通入空气,达到滴定终点,根据物质转化关系可知:n(SO2)=n(I2)=0.0100 ml,m(SO2)=0.0100 ml×64 g/ml=0.6400 g=640 mg,通入空气的体积V=a m3·min-1×t min=at m3,故该空气样品中SO2的含量是:eq \f(640 mg,at m3)=eq \f(640,at) mg/m3。
[答案] (1)H2SO4+2NaHSO3===Na2SO4+2H2O+2SO2↑ baefgh
(2)向其中加入足量稀盐酸,振荡、静置,然后滴加BaCl2溶液 出现白色沉淀 酸性KMnO4溶液 溶液褪色
(3)蓝色变为无色 eq \f(640,at)
已知:①ClO2是一种易溶于水而难溶于有机溶剂的黄绿色气体,沸点为10.0 ℃,氧化性比氯气强;
②ClO2极易爆炸分解,若用空气、二氧化碳、氮气等气体稀释时,爆炸性降低;
③在干燥空气稀释条件下,可用干燥的氯气与亚氯酸钠(NaClO2)固体反应制备二氧化氯。
某化学课题小组在实验室用以下装置制备和收集ClO2。
(1)制备和收集ClO2时导管口的连接顺序为________________________。
(2)装置A中导管k的作用为________________________________________。
(3)装置B中盛装NaClO2固体的仪器名称为________;装置B中反应的化学方程式为___________________________________________________________
__________________________________________________________________。
(4)通入干燥空气的作用是________________________________________
___________________________________________________________________
__________________________________________________________________。
[解析] (1)由实验装置图可知,装置A中二氧化锰和浓盐酸共热制备氯气,氯气中混有挥发出的氯化氢气体,装置D中盛有的饱和食盐水能除去氯气中混有的氯化氢,装置C中盛有浓硫酸可用于干燥氯气,装置B中氯气与亚氯酸钠固体反应制备二氧化氯,装置E中碱石灰用于吸收尾气,防止污染环境,故导管口的连接顺序为a→d→e→c→b→m→n(或n→m)→g。
(2)装置A用于制取Cl2,为了防止因反应过于剧烈、烧瓶内压强增大使液体无法滴下,用导管k将分液漏斗与烧瓶连通,平衡体系的压强,确保浓盐酸能顺利滴下。
[答案] (1)a→d→e→c→b→m→n(或n→m)→g (2)平衡气压,使液体顺利滴下 (3)三颈烧瓶(三口烧瓶) Cl2+2NaClO2===2ClO2+2NaCl
(4)降低二氧化氯的浓度,减少其爆炸的可能性
课时分层作业(五十六) 常见气体制备方法及装置的研究
1.ClO2(熔点:-59.0 ℃,沸点:10.0 ℃)具有强氧化性,其在空气中的质量分数超过7%就有爆炸危险。实验室模拟ClO2的工业制法,将经干燥、稀释的氯气通入装有固体亚氯酸钠(NaClO2)的U形管内制备ClO2,用稳定剂EDTA吸收ClO2,实验装置如图所示。下列说法错误的是( )
A.通入空气可以减少安全隐患
B.B中盛放Na2CO3溶液,导管G用于平衡气压
C.可以通过C装置观察气泡产生速率,以便控制气体流速
D.U形管内制备ClO2的化学方程式为2NaClO2+Cl2===2NaCl+2ClO2
B [氯气在溶液中存在平衡Cl2+H2OHCl+HClO,Na2CO3溶液能与HCl反应,平衡不断右移,会造成氯气的损失,B中应盛放饱和食盐水,为了防止B装置中压强过大,导管G连通大气平衡气体压强,B项错误。]
2.碳酰氯(COCl2)俗名光气,熔点为-118 ℃,沸点为8.2 ℃,遇水迅速水解。生成氯化氢。光气可由氯仿(CHCl3)和氧气在光照条件下合成。下列说法错误的是( )
A.装置丁中发生反应的化学方程式为2CHCl3+O2eq \(=====,\s\up9(光照))2COCl2+ 2HCl
B.装置丙的主要作用是吸收尾气中的氯化氢
C.丁中冰水混合物的作用是降温,防止COCl2挥发
D.装置的连接顺序(装置可重复使用)应为c→a→b→e→f→a→b →d
D [光气可由氯仿(CHCl3)和氧气在光照条件下合成,且光气遇水迅速水解,由实验装置可知,乙装置制备氧气,然后经甲干燥氧气,在装置丁中合成光气,丁后面需连接干燥装置防止水进入丁中,最后连接丙装置吸收尾气。A.装置丁中氯仿和氧气在光照条件下合成光气,反应的化学方程式为2CHCl3+O2eq \(=====,\s\up9(光照))2COCl2+ 2HCl,故A正确;B.装置丁中生成氯化氢,氯化氢极易溶于水,倒扣的漏斗可防止倒吸,则装置丙的主要作用是吸收尾气中的氯化氢,故B正确;C.COCl2的沸点为8.2 ℃,沸点较低易挥发,则冰水混合物的作用是降温,防止COCl2挥发,故C正确;D.由上述分析可知,乙装置制备氧气,然后经甲干燥氧气,在装置丁中合成光气,丁后面需连接干燥装置防止水进入丁中,最后连接丙装置吸收尾气,则装置的连接顺序为c→b→a→e→f→b→a→d,故D错误。]
3.关于下列各实验装置及药品的叙述中,正确的是( )
A.装置①可用于实验室制取少量O2
B.可用从左侧加水的方法检验装置②的气密性
C.利用装置③验证铁的析氢腐蚀
D.装置④随关随停制氨气
A [A.二氧化锰催化过氧化氢制氧气为固液不加热反应,装置①可用于实验室制取少量O2,A正确;B.右侧为敞口体系,不能检验装置②的气密性,B错误;C.铁的析氢腐蚀需要较强的酸性环境,C错误。]
4.实验室通过如图所示装置制备Na2S2O3,反应原理:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2。下列有关说法错误的是( )
A.导管a的作用是有利于硫酸滴入
B.装置A中的反应体现硫酸的酸性
C.装置B、D作用完全相同
D.装置C中先有淡黄色浑浊产生,后又变澄清,说明过程中有硫单质生成
C [装置B的作用调速和恒压,而D作用是作安全瓶,防止倒吸,C错误。]
5.在实验室采用如图装置制备气体,合理的是( )
C [氨气的密度比空气小,不能用向上排空气法收集,故A错误;二氧化锰与浓盐酸共热制备氯气为固液加热反应,不能选用固固加热装置,故B错误;二氧化锰和氯酸钾共热制备氧气为固固加热的反应,氧气的密度大于空气,可选用向上排空气法收集,故C正确;氯化钠与浓硫酸共热制备氯化氢为固液加热反应,不能选用固固加热装置,故D错误。]
6.实验室制备SO2并探究其性质的方案如下,回答下列问题:
Ⅰ.制备SO2 (部分固定装置略)
(1)制备SO2可以选择的发生装置为________(填大写字母),其反应的化学方程式为______________________________________________________________
___________________________________________________________________。
(2)选用上图装置制备并收集一瓶干燥的SO2,其连接顺序为:发生装置→________(按气流方向,填小写字母)。
Ⅱ.探究SO2与悬浊液的反应
查阅资料:SO2在酸性条件下还原性较差,碱性条件下较强。
实验步骤:ⅰ.配制悬浊液:往NaOH溶液中加入CuSO4溶液可得到悬浊液。
ⅱ.将SO2通入悬浊液中(实验装置如F)。
实验现象:F中出现少量红色固体,稍后,溶液呈绿色,与CuSO4溶液、CuCl2溶液的颜色有明显不同。
(3)配制Cu(OH)2悬浊液时,要保证________(填“NaOH”或“CuSO4”)溶液过量。
(4)为确定红色固体成分,进行以下实验:
eq \x(\a\al(收集,红色,固体))eq \(――――――→,\s\up9(洗涤、干燥))eq \x(\a\al(红色固,体称重,1.6 g))eq \(――――――――→,\s\up9(氧气气流中),\s\d8(煅烧、冷却称重))eq \x(\a\al(黑色固,体称重,2.0 g))
①根据上述实验可得结论:该红色固体为________。
②产生红色固体的原因是__________________________________________
______________________________________________(用离子方程式表示)。
(5)为探究F中溶液呈绿色而不是蓝色的原因,实验如下:
ⅰ.向4 mL 1 ml·L-1的CuSO4溶液中通入过量SO2,未见溶液颜色发生变化。
ⅱ.取少量F中滤液,加入少量稀盐酸,产生无色刺激性气味的气体,得到澄清的蓝色溶液。再加入BaCl2溶液,出现白色沉淀。
①实验ⅰ的目的是_______________________________________________。
②溶液显绿色的原因可能是溶液中含有较多Cu(HSO3)2。小组同学通过进一步实验确认了这种可能性,在少量1 ml·L-1的CuSO4溶液中加入________(填化学式),得到绿色溶液。
[解析] (1)实验室用亚硫酸钠固体和浓硫酸(70%)反应制取二氧化硫,应选择固液不加热发生装置,因此应选择装置A,反应的化学方程式为Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O ;(2)利用装置A制备二氧化硫气体,经浓硫酸干燥后、用向上排空气法收集二氧化硫,因二氧化硫有毒,需要用碱石灰进行尾气吸收,则利用图中装置制备并收集一瓶干燥的SO2,其连接顺序为:发生装置→ghdce(f);(3)配制Cu(OH)2悬浊液时,要保证氢氧化钠溶液过量,使溶液呈碱性;(4)①根据题意可知,二氧化硫在碱性条件下有较强的还原性,可将氢氧化铜还原为红色的铜或氧化亚铜,而1.6 g红色物质在氧气气流中煅烧生成2.0 g黑色的氧化铜,其中铜的质量为2.0 g×eq \f(64,80)=1.6 g,则原来的红色物质中含铜元素1.6 g,即红色物质为单质铜;②二氧化硫与氢氧化铜发生氧化还原反应生成单质铜的离子方程式为SO2+Cueq \b\lc\(\rc\)(\a\vs4\al\c1(OH))2+2OH-===Cu+SOeq \\al(2-,4)+2H2O;(5)①实验ⅰ是空白对照实验,可排除溶解的二氧化硫、亚硫酸导致溶液显绿色的可能性;②实验结论为溶液显绿色的原因是溶液中含有较多的Cu(HSO3)2,即溶液显绿色是由于亚硫酸氢根离子的影响造成的,要进一步确认这种可能性,可向少量1 ml·L-1的硫酸铜溶液中加入少量的NaHSO3或KHSO3。
[答案] (1)A Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O
(2)ghdce(f) (3)NaOH
(4)Cu SO2+Cueq \b\lc\(\rc\)(\a\vs4\al\c1(OH))2+2OH-===Cu+SOeq \\al(2-,4)+2H2O
(5)排除溶解的SO2、H2SO3导致溶液显绿色的可能性 NaHSO3或KHSO3
7.氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其性质。
回答下列问题:
(1)盛放MnO2粉末的仪器名称是________,a中的试剂为________。
(2)b中采用的加热方式是________,c中化学反应的离子方程式是_____________________________________________________________________
____________________________________________________________________,
采用冰水浴冷却的目的是________。
(3)反应结束后,取出b中试管,经冷却结晶,________,________,干燥,得到KClO3晶体。
(4)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加KI淀粉溶液。1号试管溶液颜色不变,2号试管溶液变为蓝色。可知该条件下KClO3的氧化能力________(填“大于”或“小于”)NaClO。
[解析] (1)盛放MnO2粉末的仪器名称是圆底烧瓶,据分析,a中的试剂为饱和食盐水。(2)根据氯气与KOH溶液的反应可知,加热条件下氯气可以和强碱溶液反应生成氯酸盐,为防止温度过高导致氯酸钾分解,因此采用水浴加热方式;c中氯气在NaOH溶液中发生歧化反应生成水、氯化钠和次氯酸钠,结合得失电子守恒、元素守恒可得化学反应的离子方程式是Cl2+2OH-===ClO-+Cl-+H2O。根据氯气与KOH溶液的反应可知,加热条件下氯气可以和强碱溶液反应生成氯酸盐,所以采用冰水浴冷却的目的是避免生成NaClO3。(3)反应结束后,取出b中试管,经冷却结晶,过滤,洗涤,干燥,得到KClO3晶体。为减少KClO3晶体溶解损失,洗涤时应用冷水洗涤。(4)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加KI淀粉溶液。1号试管溶液颜色不变,2号试管溶液变为蓝色,说明1号试管中氯酸钾没有将碘离子氧化,2号试管中次氯酸钠将碘离子氧化成碘单质,可知该条件下KClO3的氧化能力小于NaClO。
[答案] (1)圆底烧瓶 饱和食盐水
(2)水浴加热 Cl2+2OH-===ClO-+Cl-+H2O 避免生成NaClO3
(3)过滤 少量(冷)水洗涤
(4)小于反应装
置类型
反应装置图
适用
气体
操作注意事项
固、固
加热型
O2、
NH3等
①试管要干燥;
②试管口略低于试管底;
③加热时先均匀加热再固定加强热
固、液加热型或液、液加热型
Cl2、
HCl等
①烧瓶加热时要隔石棉网;
②反应物均为液体时,烧瓶内要加碎瓷片(或沸石)
固、液
不加热
型或液、
液不加
热型
H2、
CO2、
SO2、
NO、
NO2、
C2H2等
①使用长颈漏斗时,要使漏斗下端插入液面以下;
②启普发生器只适用于块状固体和液体反应,且固体不溶于水;
③使用分液漏斗既可以增强气密性,又可控制液体流速
类型
液态
干燥剂
固态
干燥剂
固体、
加热
装置
(洗气瓶)
Ⅰ
(干燥管)
Ⅱ
(U形管)
Ⅲ
(硬质
玻璃管)
Ⅳ
常见干
燥剂
浓硫酸
(酸性、强
氧化性)
无水氯化
钙(中性)
碱石灰
(碱性)
除杂试剂Cu、CuO、Mg等
处理气体
干燥Cl2、CO2、CH4等;不宜干燥NH3、H2S等还原性气体
干燥H2、O2、Cl2、CO2等,不能干燥NH3
干燥NH3、CH4、H2、O2等;不能干燥CO2、Cl2、HCl等
除杂O2或转化H2、CO等
a中反应
b中检测试剂及现象
A
浓HNO3分解生成NO2
淀粉KI溶液变蓝
B
Cu与浓H2SO4生成SO2
品红溶液褪色
C
浓NaOH与NH4Cl溶液生成NH3
酚酞溶液变红
D
CH3CHBrCH3与NaOH乙醇溶液生成丙烯
溴水褪色
实验
编号
实验步骤
现象
结论
Ⅰ
取少量样品,加入除氧蒸馏水
固体完全溶解得到无色溶液
/
Ⅱ
取实验Ⅰ的溶液,________
________
样品已氧化变质
Ⅲ
另取实验Ⅰ的溶液,________
________
样品未完全氧化变质
选项
化学试剂
制备气体
A
Ca(OH)2+NH4Cl
NH3
B
MnO2+HCl(浓)
Cl2
C
MnO2+KClO3
O2
D
NaCl+H2SO4(浓)
HCl
相关学案
这是一份2024届高考化学一轮复习专题3第11讲纯碱的制备与实验测定能力学案,共13页。
这是一份鲁科版高考化学一轮复习第4章第23讲常见气体制备方法及装置的研究课时学案,共20页。
这是一份新高考化学一轮复习精品学案 第5章 第29讲 常见气体的实验室制备、净化和收集(含解析),共19页。