



人教版 (2019)选择性必修2第一节 共价键教课内容课件ppt
展开
这是一份人教版 (2019)选择性必修2第一节 共价键教课内容课件ppt,共19页。PPT课件主要包含了CH4,CH3CH2OH,CH3COOH,C6H6,测定条件,平均值,某些共价键的键能,请找出数据中的规律,NH3,H2O等内容,欢迎下载使用。
1.理解键能、键长、键角等键参数的概念。2.能应用键参数一键能、键长、键角说明简单分子的结构和性质。3.通过键参数解释物质的结构与性质。
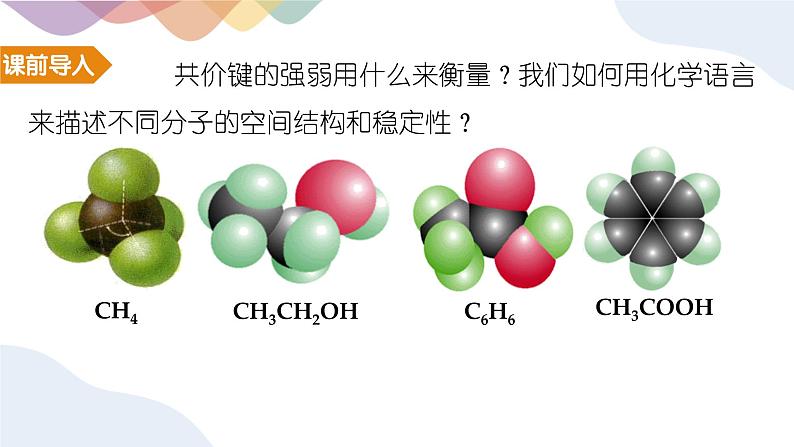
共价键的强弱用什么来衡量?我们如何用化学语言来描述不同分子的空间结构和稳定性?
指气态分子中断裂1ml化学键解离成气态原子所吸收的能量。或气态基态原子形成1ml化学键释放的最低能量。
kJ/ml,键能通常取正值
键能通常是298.15 K、101 kPa条件下的标准值。键能可以通过实验测定,更多的是推算获得的。
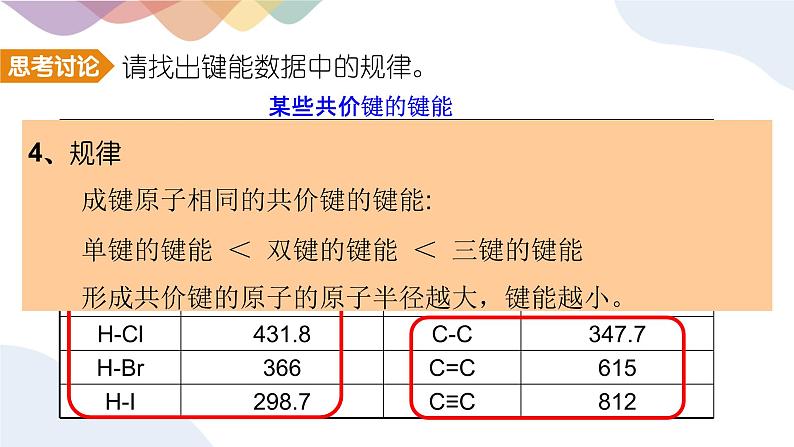
请找出键能数据中的规律。
4、规律 成键原子相同的共价键的键能: 单键的键能 < 双键的键能 < 三键的键能 形成共价键的原子的原子半径越大,键能越小。
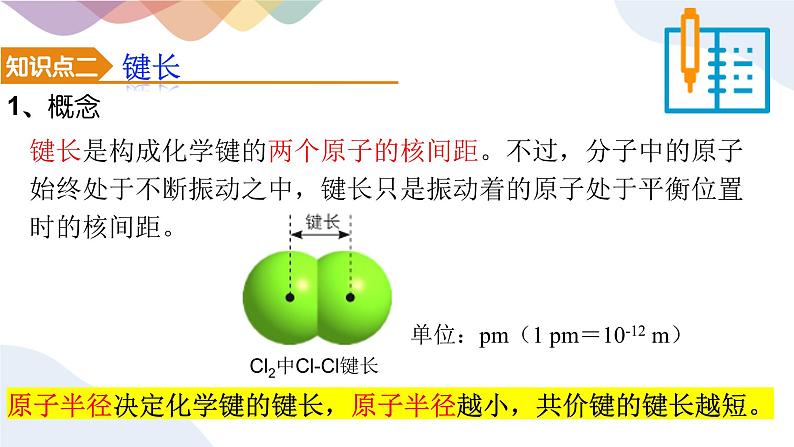
键长是构成化学键的两个原子的核间距。不过,分子中的原子始终处于不断振动之中,键长只是振动着的原子处于平衡位置时的核间距。
Cl2中Cl-Cl键长
单位:pm(1 pm=10-12 m)
原子半径决定化学键的键长,原子半径越小,共价键的键长越短。
某些共价键的键能和键长
2、规律: 同种类型的共价键,成键原子的原子半径越小,键长越小。成键原子相同的共价键的键长: 单键键长 > 双键键长 > 三键键长 一般地,键长越短, 键能越大,共价键越牢固,由此形成的分子越稳定。
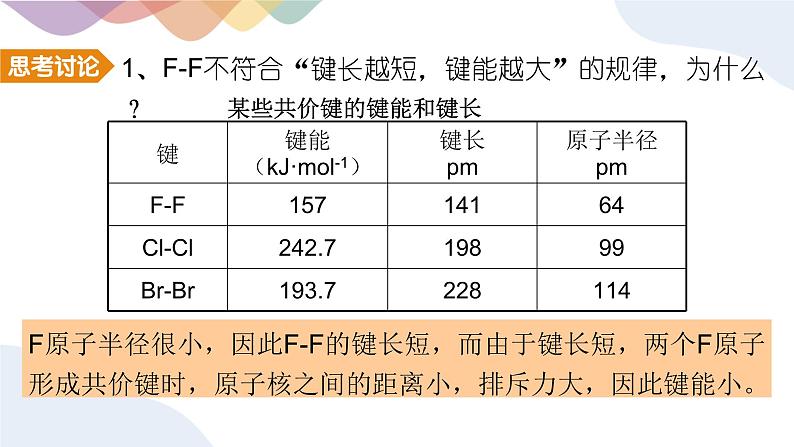
1、F-F不符合“键长越短,键能越大”的规律,为什么?
F原子半径很小,因此F-F的键长短,而由于键长短,两个F原子形成共价键时,原子核之间的距离小,排斥力大,因此键能小。
同为三原子分子,为什么CO2的空间结构是直线形,而H2O的空间结构是V形(角形)?
键角:在多原子分子中,两个相邻共价键之间的夹角
键长和键角的数值可通过晶体的X射线衍射实验获得
键角可反映分子的空间构型。键角是描述分子结构的重要参数。多原子分子的键角一定,表明共价键具有方向性。
(1)判断共价键的稳定性
键能越大,断开化学键需要吸收的能量越多,化学键越稳定。
(2)判断分子的稳定性
结构相似的分子中,共价键的键能越大,分子越稳定。
(3)估算化学反应的反应热
如分子的稳定性:HF>HCl>HBr>HI。
∆H=∑E(反应物键能)-∑E (生成物键能)
ΔH0时,吸热反应
N2 、O2 、F2分别与H2的能力依次增强,从键能的角度应如何理解这一化学事实?
N2、O2、F2与H2的反应能力依次增强,其原因是N≡N键、O=O键、F—F键的键能依次为946 kJ·ml-1、497.3kJ·ml-1、157 kJ·ml-1,键能越来越小,共价键越来越容易断裂。
相同的两个原子间形成共价键时,单键键长>双键键长>三键键长。如键长:C-C > C=C > C≡C
②根据共用电子对数目判断
其他条件相同时,成键原子的半径越小,键长越短。如键长:H—I > H—Cl>H—F;Br—Br>Cl—Cl>F—F;
(1)键长越短,一般键能越大,共价键越稳定,含该共价键的分子越稳定。
(1)键长和键角决定分子的空间结构。
(2)常见分子的键角与分子空间结构。
利用下表数据说明乙烯、乙炔为什么比乙烷活泼?
乙烯
写出乙烷、乙烯和乙炔的电子式:
虽然键长C≡C<C=C<C-C,键能C≡C>C=C>C-C,但乙烷、乙烯、乙炔中碳碳键的键能大小之比不是1:2:3。但乙烯、乙炔中π键不如σ键牢固,容易发生加成反应。乙烯、乙炔在发生加成反应时,只有π键断裂(π键的键能一般小于σ键的键能),即共价键部分断裂。
(1)通常情况下,分子中键长越短,共价键的键能越大,共价键越牢固,由该键形成的分子越稳定。( )(2)N—H键能是很多分子中的N—H键能的平均值。( )(3)O—H键能是指在298.15 K、101 kPa下,1 ml气态分子中1 ml O—H键解离成气态原子所放出的能量。( ) (4)在分子中,两个成键的原子间的距离叫键长。( )(5)C=C键能是C—C键能的两倍。( )(6)多原子分子的键角是一定的,表明共价键具有方向性。( )(7)水分子可表示为H—O—H,分子中的键角为180º。( )(8)CH4和CH3Cl分子的空间结构都是正四面体。( )
3、关于键长、键能和键角,下列说法不正确的是( )A.键角是描述分子空间结构的重要参数B.键长的大小与成键原子的半径和成键数目有关C.键能越大,键长越大,共价化合物越稳定D.键角的大小与键长、键能的大小无关
相关课件
这是一份高中化学人教版 (2019)选择性必修2第一节 共价键课前预习ppt课件,共60页。PPT课件主要包含了键参数,请判断以下键长的大小,常见卤化氢的稳定性,防晒霜的防晒原理,氢氧焰,化学反应的实质,H2O,吸热反应,放热反应,计算出反应的热效应等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修2第一节 共价键教课课件ppt,共21页。PPT课件主要包含了课前导入,目标一键能,kJ·mol-1,3计算反应热,目标二键长,单位pm,某些共价键的键长,你能发现哪些规律呢,同类型共价键,单键>双键>三键等内容,欢迎下载使用。
这是一份高中人教版 (2019)第二章 分子结构与性质第一节 共价键评课ppt课件,文件包含212共价键第2课时键参数键能键长与键角习题精练高二化学同步习题精练人教版2019选择性必修2含解析docx、212共价键第2课时+键参数键能键长与键角课件精讲高二化学同步课件精讲人教版2019选择性必修2pptx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。










