





所属成套资源:人教版(2019)高中化学选择性必修一 化学反应原理
人教版 (2019)选择性必修1第二节 化学平衡教课课件ppt
展开
这是一份人教版 (2019)选择性必修1第二节 化学平衡教课课件ppt,共36页。PPT课件主要包含了c2HI,结论2,结论1,结论3,查阅文献,化学平衡常数,影响因素,主要因素,后一节深入学习,平衡常数的计算等内容,欢迎下载使用。
1.知道化学平衡常数的含义,会根据化学反应书写化学平衡常数表达式。 2.应用化学平衡常数判断可逆反应进行的程度、方向以及反应的热效应。 3.能够利用化学平衡常数进行简单的计算。
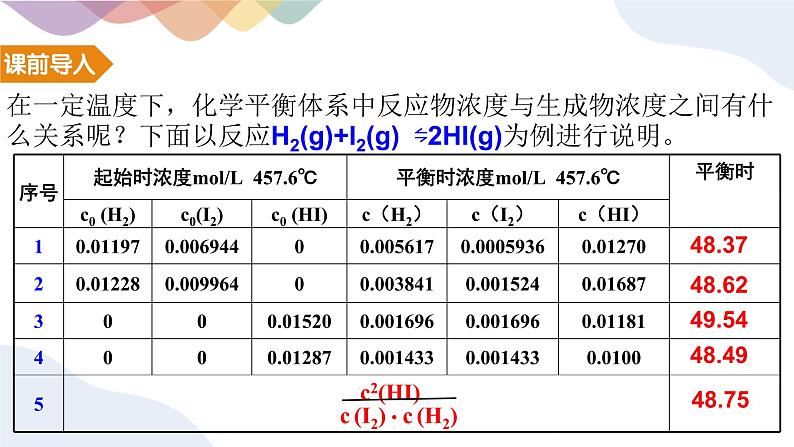
在一定温度下,化学平衡体系中反应物浓度与生成物浓度之间有什么关系呢?下面以反应H2(g)+I2(g) ⇋2HI(g)为例进行说明。
c (I2)·c (H2)
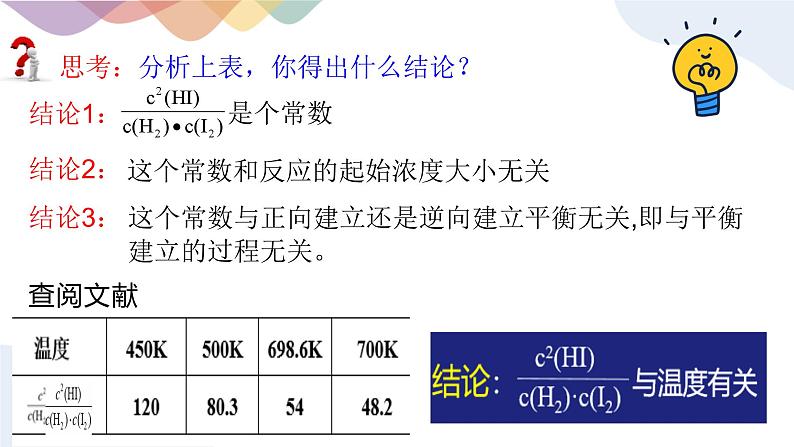
思考:分析上表,你得出什么结论?
这个常数和反应的起始浓度大小无关
这个常数与正向建立还是逆向建立平衡无关,即与平衡建立的过程无关。
对于一般的可逆反应: mA(g)+nB(g)⇌pC(g)+qD(g),在一定温度下的任意时刻,反应物浓度和生成物浓度可用浓度商来表示:
当该反应在一定温度下达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,用K表示,称为化学平衡常数。
写出下列反应的平衡常数K的表达式
① C(s) + H2O(g) ⇋CO(g) + H2(g)
② FeO(s) + CO(g) ⇋Fe(s) + CO2(g)
③ 2KClO3(s) ⇋KCl(s) + 3O2(g)
注意1:反应物或生成物中有固体和纯液体存在时,由于其浓度可看做常数不代入公式。
④ Cr2O72-+H2O ⇋2CrO42-+2H+
写出下列反应的平衡常数K的表达式。
① N2(g) + 3H2(g) ⇋2NH3(g)
③ 2NH3(g) ⇋N2(g) + 3H2(g)
注意1:观察三者之间的关系!
注意2:化学平衡常数是指某一具体反应的平衡常数。若反应方向改变,则平衡常数改变。若方程式中各物质的系数等倍扩大或缩小,尽管是同一个反应,平衡常数也会改变。
下列三个反应的平衡常数K之间有什么关系
2NO(g) + O2(g) ⇋ 2NO2(g) K1 2NO2(g) ⇋ N2O4 (g) K22NO(g) +O2(g) ⇋ N2O4 (g) K3
K3 = K1 K2
注意3:若干方程式相加(减),则总反应的平衡常数等于分步平衡常数之乘积(商)
对于同类型反应,平衡常数的大小反映了化学反应可能进行的 ;平衡常数的数值越 ,说明反应可以进行得越完全。若K>105,则说明反应完全。
①内因:不同的化学反应及化学方程式的书写形式是决定化学平衡常数的 。②外因:在化学方程式一定的情况下,K只受 影响。
注意:K与反应物或生成物的浓度无关,也与反应从正向开始或逆向开始无关。
(1)利用K可判断反应的热效应
①若升高温度,K↑,则正反应为吸热反应∆H>0
②若升高温度,K↓,则正反应为放热反应∆H
相关课件
这是一份高中人教版 (2019)第二章 化学反应速率与化学平衡第二节 化学平衡备课课件ppt,共36页。PPT课件主要包含了化学平衡常数,称为浓度商,c为平衡浓度,c为任一时刻浓度,一定温度下,某温度下,模块三速率常数,压强平衡常数,p分压,第三段等内容,欢迎下载使用。
这是一份人教版 (2019)第二章 化学反应速率与化学平衡第二节 化学平衡完美版课件ppt,文件包含新人教版化学选择性必修一222化学平衡常数课件pptx、新人教版化学选择性必修一222化学平衡常数针对练习含解析docx、新人教版化学选择性必修一222化学平衡常数教案doc等3份课件配套教学资源,其中PPT共29页, 欢迎下载使用。
这是一份化学选择性必修1第二节 化学平衡优秀ppt课件,共39页。PPT课件主要包含了第二节化学平衡,知识梳理,正误判断,问题导学,核心突破,试题调研,完成课时作业八,课后作业等内容,欢迎下载使用。











