
第24讲 电解原理的应用-备战2024年高考化学一轮复习精品课件(全国通用)
展开考点 1 电解原理在工业生产中的应用
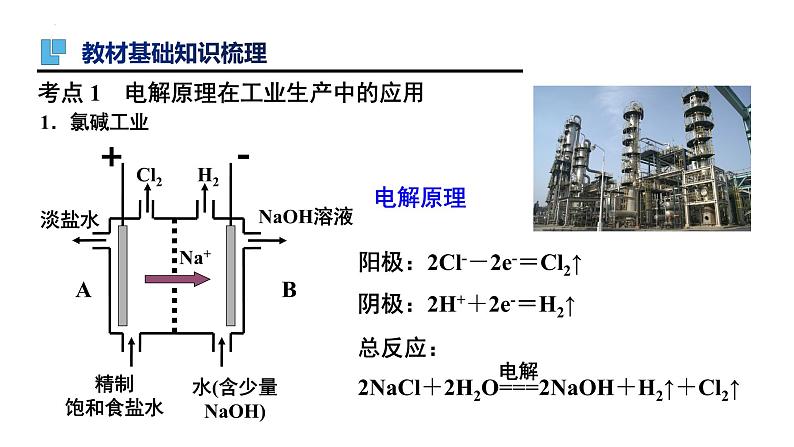
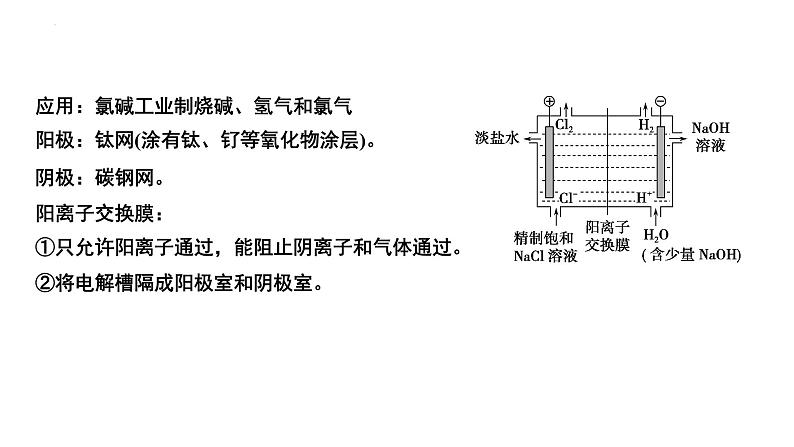
应用:氯碱工业制烧碱、氢气和氯气阳极:钛网(涂有钛、钌等氧化物涂层)。阴极:碳钢网。阳离子交换膜:①只允许阳离子通过,能阻止阴离子和气体通过。②将电解槽隔成阳极室和阴极室。
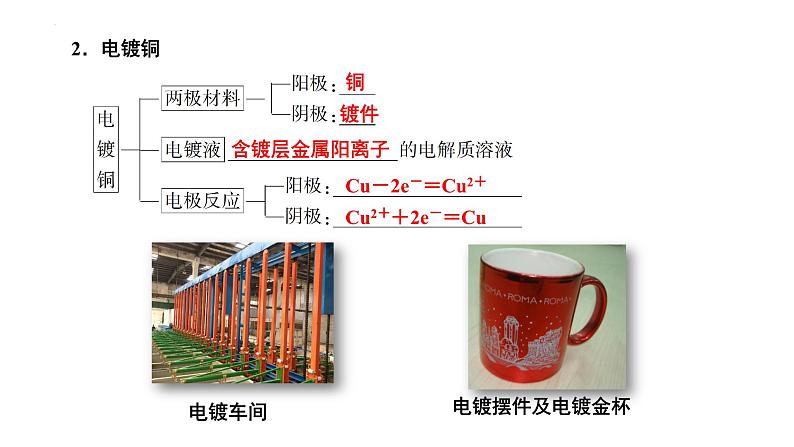
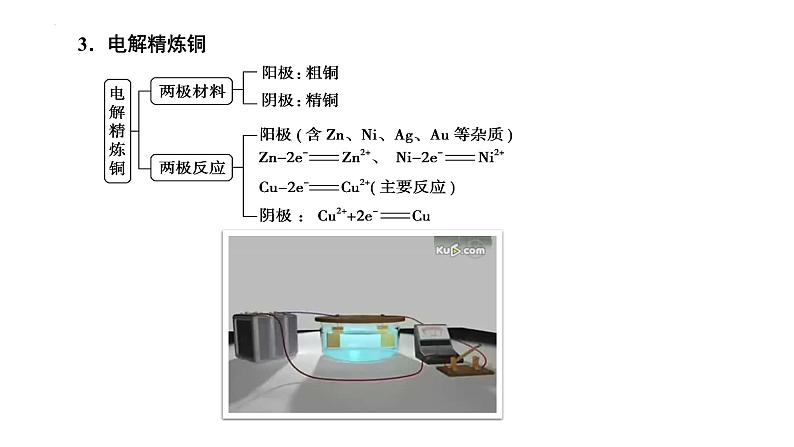
Cu-2e-=Cu2+
Cu2++2e-=Cu
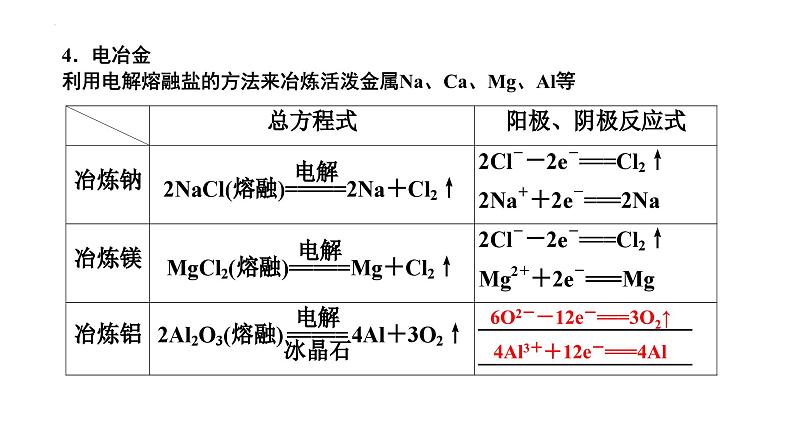
4.电冶金利用电解熔融盐的方法来冶炼活泼金属Na、Ca、Mg、Al等
6O2--12e-===3O2↑
4Al3++12e-===4Al
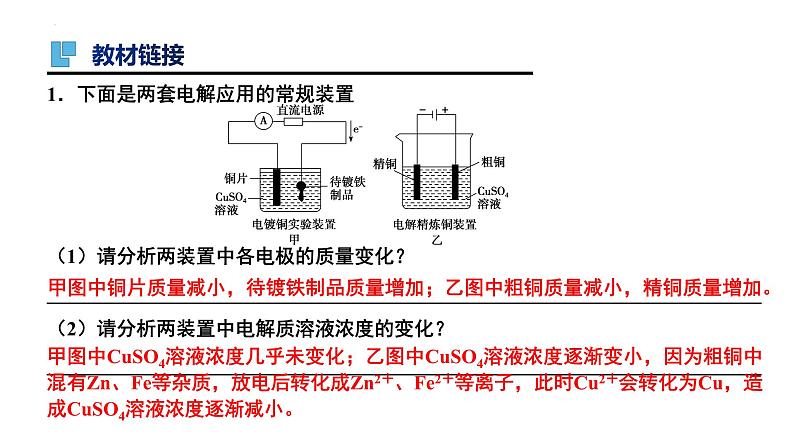
1.下面是两套电解应用的常规装置(1)请分析两装置中各电极的质量变化?________________________________________________________________________(2)请分析两装置中电解质溶液浓度的变化?________________________________________________________________________
甲图中铜片质量减小,待镀铁制品质量增加;乙图中粗铜质量减小,精铜质量增加。
甲图中CuSO4溶液浓度几乎未变化;乙图中CuSO4溶液浓度逐渐变小,因为粗铜中混有Zn、Fe等杂质,放电后转化成Zn2+、Fe2+等离子,此时Cu2+会转化为Cu,造成CuSO4溶液浓度逐渐减小。
1.判断正误(正确的打“√”,错误的打“×”)
(1)在镀件上电镀铜时,也可以用惰性材料作阳极,用硫酸铜溶液作电解液( )(2)电解饱和食盐水时,两个电极均不能用金属材料 ( )(3)电镀铜和电解精炼铜时,电解质溶液中c(Cu2+)均保持不变 ( )(4)电解冶炼镁、铝通常电解MgCl2和Al2O3,也可以电解MgO和AlCl3 ( )(5)电解精炼时,阳极泥可以作为提炼贵重金属的原料 ( )(6)用Zn作阳极,Fe作阴极,ZnCl2作电解质溶液,由于放电顺序H+>Zn2+,不可能在铁上镀锌 ( )
2.电解装置如图,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是( ) A.右侧发生的电极方程式:O2+4e-+2H2O=4OH- B.电解槽内发生反应的总化学方程式是: KI+3H2O=KIO3+3H2↑ C.电解结束后,右侧溶液中不可能含有IO3- D.如果用阳离子交换膜代替阴离子交换膜,电解槽内反应的总化学方程式不变
3.氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。如图是离子交换膜法电解饱和食盐水的示意图,图中的离子交换膜只允许阳离子通过。
完成下列填空: (1)写出电解饱和食盐水的离子方程式:_______________________________________________________。 (2)离子交换膜的作用为___________________、________________________________________________。 (3)精制饱和食盐水从图中_______(选填“a”“b”“c”或“d”)位置补充,氢氧化钠溶液从图中_____位置流出。
能得到纯度更高的氢氧化钠溶液
阻止阳极产生的Cl2和阴极产生的H2混合发生反应
考点 2 金属的腐蚀与防护
1.金属腐蚀的本质金属原子失去电子变为金属阳离子,金属发生氧化反应。
2.化学腐蚀和电化学腐蚀的比较
3.电化学腐蚀的分类(钢铁腐蚀)
Fe-2e-=Fe2+
2H++2e-=H2↑
2H2O+O2+4e-=4OH-
4.金属的防护(1)牺牲阳极的阴极保护法利用________原理。(2)外加电流的阴极保护法利用________原理。(3)改变金属内部结构→如制成不锈钢。(4)加保护层→如电镀、喷漆、覆膜等。
(1)纯银器表面变黑和钢铁表面生锈腐蚀原理一样 ( )(2)Al、Fe、Cu在潮湿的空气中腐蚀均生成氧化物 ( )(3)钢铁发生电化学腐蚀时,负极铁失去电子生成Fe3+ ( )(4)在金属表面覆盖保护层,若保护层破损后,就完全失去了对金属的保护作用。 ( )(5)若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 ( )(6)铁表面镀锌可增强其抗腐蚀性 ( )
2.(1)以下装置中(杯中均盛有海水)Zn片腐蚀由快到慢的顺序为____________。
(2)镀锌铁板(俗称白铁)和镀锡铁板(俗称马口铁),______铁板更耐腐蚀,原因为________________________________________________________________________________________________________________________________。
镀层破坏后,镀锌铁板中的铁为正极受到保护,镀锡铁板中的铁为负极加快腐蚀
【归纳整合】金属腐蚀快慢的规律 (1)对同一电解质溶液来说,腐蚀速率的快慢(由快到慢):电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。 (2)对同一金属来说,在不同溶液中腐蚀速率的快慢(由快到慢):强电解质溶液中>弱电解质溶液中>非电解质溶液中。 (3)活动性不同的两种金属,活动性差别越大,腐蚀速率越快。 (4)对同一种电解质溶液来说,电解质浓度越大,金属腐蚀越快。
1.[2021全国甲卷]乙醛酸是一种重要的化工中间体,可采用如下图所示的电化学装置合成,图中的双极膜中间层中的H2O解离为H+和OH-,并在直流电场作用下分别向两级迁移,下列说法中正确的是( )A.KBr在上述电化学合成过程中只起电解质的作用B.阳极上的反应式为:C.制得2ml乙醛酸,理论上外电路中迁移了1ml电子D.双极膜中间层中的H+在外电场作用下向铅电极方向迁移
2.验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3% NaCl溶液)。
下列说法不正确的是( )A.对比②③,可以判定Zn保护了FeB.对比①②,K3[Fe(CN)6]可能将Fe氧化C.验证Zn保护Fe时不能用①的方法D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼
第31讲 难溶电解质的溶解平衡-备战2024年高考化学一轮复习精品课件(全国通用): 这是一份第31讲 难溶电解质的溶解平衡-备战2024年高考化学一轮复习精品课件(全国通用),共19页。PPT课件主要包含了沉淀溶解平衡等内容,欢迎下载使用。
第28讲 弱电解质的电离平衡-备战2024年高考化学一轮复习精品课件(全国通用): 这是一份第28讲 弱电解质的电离平衡-备战2024年高考化学一轮复习精品课件(全国通用),共19页。PPT课件主要包含了表达式等内容,欢迎下载使用。
第23讲 电解原理-备战2024年高考化学一轮复习精品课件(全国通用): 这是一份第23讲 电解原理-备战2024年高考化学一轮复习精品课件(全国通用),共17页。PPT课件主要包含了考点1电解原理,还原反应,氧化反应,阳离子,阴离子,OH->SO42ˉ,H+<Cu2+,电极反应式的书写,2电解电解质型,加CuCl2固体等内容,欢迎下载使用。












