









2024届四川省成都市石室中学高三上学期一诊模拟考试理科综合试卷
展开【解析】
A.丝绸的主要成分是蛋白质,A正确;
B.Fe3O4为黑色固体,常用作红色颜料的是Fe2O3,B错误;
C.硅太阳能电池阵是利用硅半导体的性质将太阳能转化为电能,C错误;
D.固体浮力材料,由空心玻璃微球填充在高强度树脂中制成,其中树脂为有机高分子材料,故该浮力材料为复合材料,D错误。
8.【答案】D
【解析】
A.含有羟基和碳碳双键,能发生氧化、加聚、酯化和取代反应,A项正确;
B.1ml该物质中含有3ml碳碳双键,则1ml该醇最多消耗3mlBr2,其质量为, B项正确;
C.与羟基相连的碳原子通过单键与3个其他碳原子相连,该分子中的所有碳原子一定不共面,C项正确;
D.分子式正确,但不饱和度为3,不可能有属于芳香族化合物的同分异构体,D项错误。
9.【答案】C
【解析】
A.由图知,一个雄黄分子中含有10个共价键,所以1ml雄黄中含有的共价键为10NA,A正确;
B.根据图示的反应历程知,反应I的方程为:,氧化剂与还原剂物质的量之比为7∶1,B正确;
C.0.1ml/L的NaH2AsO3溶液中离子浓度存在关系: ,C错误;
D.由图知,雄黄分子和雌黄分子中S原子均有两个化学键,As均有3个化学键,均形成了最外层8电子稳定结构,D正确。
10.【答案】B
【解析】
A.饱和Na2CO3溶液中通入CO2反应过程中消耗了溶剂水,生成NaHCO3的质量比消耗Na2CO3的质量大,即使有晶体析出,也不能充分说明Na2CO3溶解度比NaHCO3大,A错误;
B.向分别放入盛有冷水和热水的两个烧杯中的盛有等浓度的硫代硫酸钠溶液中的试管中加入稀硫酸,振荡,放在热水中的试管优先变混浊,能用于探究温度对化学反应速率的影响,故B正确;
C. 蔗糖酸性条件下水解后,需加入NaOH调溶液至碱性后,才能加入新制氢氧化铜溶液检验水解产物葡萄糖,C项错误;
D.由题意可知,铜和铁在氯化钠溶液中构成的原电池中,活泼金属铁做负极被损耗,向铁电极区域取少量溶液中滴入铁氰化钾溶液,一定有蓝色沉淀生成,不能探究牺牲阳极的阴极保护法,D错误。
11.【答案】D
【解析】
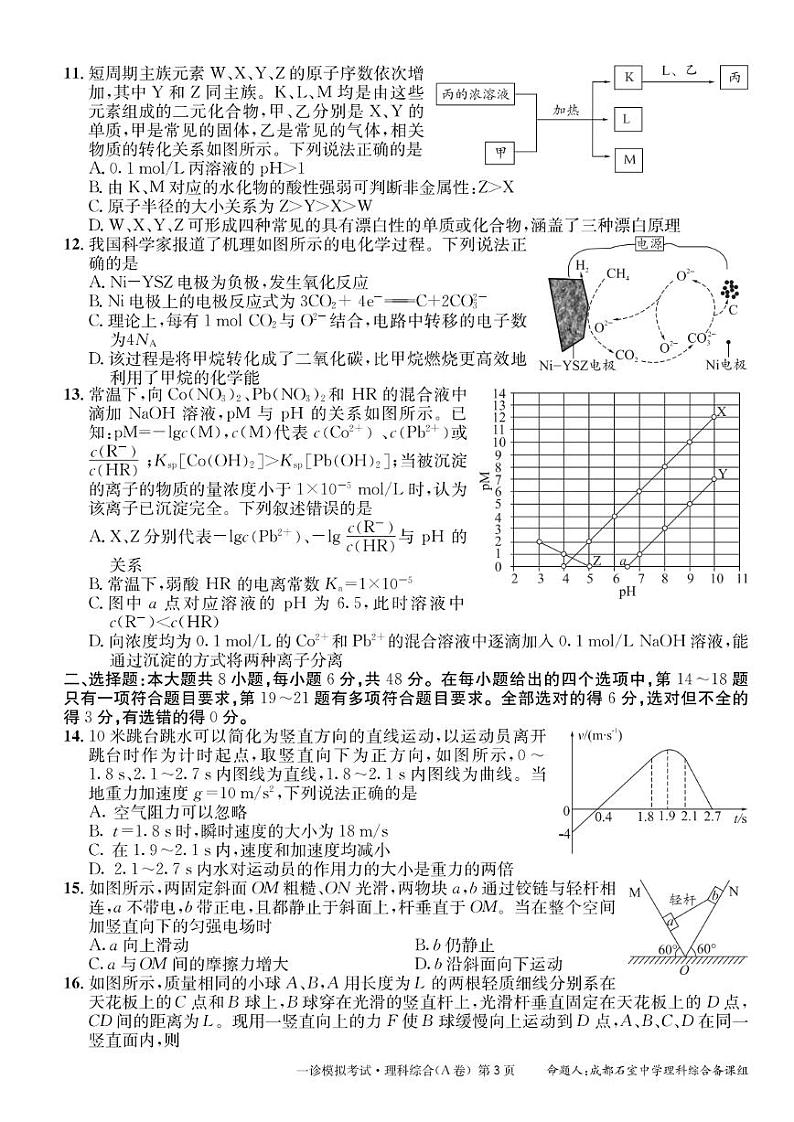
短周期主族元素W、X、Y、Z分别为H、C、O、S,甲、乙分别是单质碳和氧气,则丙为二元强酸H2SO4,0.1ml/L丙溶液的pH<1,A错误;K为SO2,其对应的水化物不是最高价氧化物对应的水化物,故不能由此比较元素的非金属性强弱,B错误;原子半径大小规律为S>C>O>H,应为Z>X>Y>W,C错误;W、X、Y、Z可形成四种常见的具有漂白性的单质或化合物分别为H2O2、活性炭、O3、SO2,其中H2O2和O3具有强氧化性能使有色物质褪色,活性炭利用吸附性使有色物质褪色,SO2与某些特定化学物质(如品红)化合后可生成不稳定化合物,达到褪色目的,D正确。
12.【答案】C
【解析】
A.由图可知,Ni-YSZ电极CH4→CO2,C元素化合价升高,电极反应式为CH4+2O2--4e-=CO2+2H2,为该电解池的阳极,发生氧化反应,A错误;
B.Ni电极C元素化合价降低得电子,故Ni电极为阴极,电极反应式为+4e-=C+3O2−;B错误;
C.Ni电极上每转移4ml电子会生成3mlO2−,其中2mlO2−用于参加阳极反应生成CO2,另1mlO2−与生成的CO2结合成,故理论上,每有1mlCO2与O2-结合,电路中转移电子数为4NA,C正确;
D.该过程是利用电解的条件,将甲烷分解成碳和氢气,是电能转化为化学能的过程,不是甲烷氧化提供能量的过程,D错误。
13.【答案】C
【解析】
由可知,pH相等时,溶液中>,故曲线X代表与 pH 的关系,Y代表与 pH 的关系,而与c(H+)的乘积为定值K(HR),故c(H+)越小(pH越大)时,也越小,Z代表与 pH 的关系,A正确;
B.,取Z点(5,0)带入得,,B正确;
C. 由图可知,=1×10-15,a点时,则pH为6.5,但此时为负值,说明c(R-)>c(HR),C错误;
D.由图可知,=1×10-15, =1×10-20,向浓度均为0.1ml/L的C2+和Pb2+混合溶液中逐滴加入0.1ml/L NaOH溶液,Pb2+会先沉淀,当c(Pb2+)=1×10-5ml/L时,此时c(OH-)=1×10-7.5ml/L,溶液中C2+还未开始沉淀,故能通过沉淀的方式将两种离子分离,D正确。
26.(14分)【答案】
(1)2MnO2+4KOH+O2 2K2MnO4+2H2O(2分)
(2)Al(OH)3和H2SiO3(2分)
(3)①MnO2(1分) ②酸性(1分) 溶液中存在平衡3+2H2O 2+MnO2+4OH-,加入冰醋酸,可中和OH-,降低c(OH-),促进平衡正向移动,促进KMnO4生成,提高KMnO4产率(2分) a(1分)
(4)溶液表面出现晶膜(1分)
(5)①63.2%(2分) ②偏大(2分)
【解析】
软锰矿,其主要成分为MnO2,还含有Al2O3、SiO2等杂质,与KOH在空气中熔融煅烧,主要的反应为:2MnO2+4KOH+O2 2K2MnO4+2H2O,Al2O3、SiO2得到KAlO2和K2SiO3,冷却浸取,向浸取液中通入CO2调节其pH,KAlO2和K2SiO3转化为Al(OH)3和H2SiO3,过滤,滤渣I主要为Al(OH)3和H2SiO3,墨绿色溶液主要含有K2MnO4,加入冰醋酸歧化,促进平衡3+2H2O2+MnO2+4OH-右移,过滤,滤渣II为MnO2,滤液为高锰酸钾溶液,结晶得到产品,据此分析。
(1)“熔融煅烧”时,MnO2参与反应的化学方程式为2MnO2+4KOH+O2 2K2MnO4+2H2O;
(2)根据分析,浸取液中含有KAlO2和K2SiO3,通入CO2调节其pH,KAlO2和K2SiO3转化为Al(OH)3和H2SiO3,过滤,滤渣I主要为Al(OH)3和H2SiO3;
(3)①在酸性溶液中Mn2+是锰的最稳定态,可知吉布斯自由能越小越稳定,则在碱性溶液中MnO2是锰的最稳定态,答案为:MnO2;
②由图可知,在酸性环境中明显位于它相邻两氧化态连线的上方,更易发生歧化反应,故答案为酸性;溶液中存在平衡3+2H2O 2+MnO2+4OH-,加入冰醋酸,可中和OH-,降低c(OH-),促进平衡正向移动,促进KMnO4生成,提高KMnO4产率;加入冰醋酸的目的是调节溶液pH,KMnO4具有强氧化性,所以不能用还原性酸,乙二酸、亚硫酸、氢溴酸均具有还原性,可以用稀硫酸替代醋酸,故答案选a;
(4)此操作为降温结晶,故当表面出现晶膜时,就应停止加热;
(5)①用酚酞做指示剂,草酸与NaOH发生反应:
结合题中数据得草酸溶液浓度=;
0.5g
63.2%
草酸与高锰酸钾发生反应:;样品中高锰酸钾的纯度为
②若不用水浴加热,反应太慢会使溶液颜色变化滞后,草酸溶液加入过多,体积偏大,则测得高锰酸钾物质的量偏大,故纯度偏大。
27.(14分)【答案】
(1)防倒吸;使NH3与CS2充分混合,加快反应速率(2分)
(2)(球形)干燥管(2分) 2Fe3++H2S===2Fe2++S↓+2H+(2分)
(3)①Fe3++3SCN-Fe(SCN)3(2分) ②滴加KSCN溶液,溶液变红(2分)
③(4分)
(t时刻时加入少量Fe2(SO4)2固体也可给分)
【解析】
A中制备氨气,在B中氨气与二硫化碳反应先生成硫氰化铵,然后与碳酸钾溶液反应生成硫氰化钾,装置C为尾气吸收装置。
(1)CS2是非极性试剂,极性分子NH3在其中的溶解度小,可以防倒吸;NH3(气体)通入CS2(液体)中,可以增大接触面积,加快反应速率。
(2)尾气处理装置中防倒吸的装置名称为(球形)干燥管,酸性溶液吸收NH3后,Fe2(SO4)3会氧化H2S气体,发生反应:2Fe3++H2S===2Fe2++S↓+2H+
(3)①Fe3+与SCN-发生反应生成Fe(SCN)3,使溶液显红色,其反应的离子方程式为Fe3++3SCN-Fe(SCN)3,
②检验Fe3+,常用KSCN溶液,若溶液变红,说明含有Fe3+,反之,则不含Fe3+,要证明反应后溶液中含有Fe3+,而几乎无SCN-,具体操作是取反应后的溶液少量于试管中,滴入KSCN溶液,溶液变红,则说明该溶液中有Fe3+,几乎无SCN-。
③根据题意,酸性溶液中H2O2能氧化SCN-,但反应很慢且无明显现象,滴加Fe2(SO4)3溶液后,溶液褪色相对较快;实验Ⅱ和实验Ⅲ应为对照实验,根据实验Ⅱ,推出实验Ⅲ:先加入0.5 mL pH=1的硫酸溶液,无明显现象,静置后,滴加数滴Fe2(SO4)3溶液,溶液立即变红。
28.(15分)【答案】
(1)BCD(2分)
(2)2N2+6H2O(g) 4NH3+3O2(2分)
(3)N2+6e-+ 6C2H5OH=2NH3+6C2H5O-(2分)
(4)①II(1分) ②T2(1分) ,温度升高,反应I平衡逆移,c( N2O2 )减小,浓度降低的影响大于温度对反应II速率的影响(2分)
(5)①b(1分) ② (2分) ③66.7%(1分)
(6)-447.3(1分)
【解析】
(1)A.催化剂能降低反应活化能,提高反应速率,但是不能改变平衡状态,对转化率没有影响,故A错误;
B.该反应为分子数减少的反应,即,又∆H<0,根据该反应自发进行,所以在相对较低的温度下,将有利于该反应的自发进行,故B正确;
C.对于该反应,移出产物相当于降低生成物浓度,都可以使反应正向进行,且温度不变,故平衡常数保持不变,C正确;
D.平衡时,容器中各物质的浓度保持不变,但是保持不变时,不一定能说明反应已经达到平衡状态,故D正确;
故选BCD。
(2)由图可知,该工艺合成氨的反应为氮气和水在催化剂Fe2O3作用下生成氨气和氧气,故反应方程式为:2N2+6H2O 4NH3+3O2。
(3)由阴极区的微观示意图可知,阴极上N2转化为NH3,C2H5OH转化为C2H5O-离子,说明N2在C2H5OH作用下,在阴极得到电子发生还原反应生成NH3,电极反应式为N2+6e-+ 6C2H5OH=2NH3+6C2H5O-。
(4)①由图3可知,反应I的活化能小于反应II的活化能,活化能越大,反应速率越慢,则反应I化学反应速率快于反应II,总反应的反应速率取决于反应速率较慢的一步,则决定NO氧化反应速率的步骤是反应II;
②由图4可知,转化相同量的NO,在温度T2下消耗的时间较长,结合图3分析可得原因是反应I的正反应为放热反应,温度升高,反应I平衡逆向移动,c(N2O2)减小,N2O2浓度减小对反应II速率的影响大于温度升高对反应II速率的影响。
(5)①反应为放热反应,升高温度,平衡逆向移动,二氧化氮含量增加,故代表NO2的曲线是b。
②设投入2ml二氧化氮气体;
平衡时二氧化氮体积分数为50%,则,a=,则NO2的平衡转化率=;由于平衡时二氧化氮体积分数为50%,则二氧化氮、四氧化二氮的分压相等,假设平衡时体系的总压为P0,则A点温度下的平衡常数Kp=;
(6)已知:3NO2(g)+H2O(l)=2HNO3(aq)+NO(g) ΔH2=-138.0kJ•ml-1
结合方程式:2NO(g)+O2(g) 2NO2(g) ΔH1=-57.1kJ•ml-1
由盖斯定律可知,2ΔH2+3ΔH1得:4NO(g)+3O2(g)+2H2O(1)=4HNO3(aq)
ΔH3=2×(-138.0kJ•ml-1)+3×(-57.1kJ•ml-1)=-447.3kJ•ml-1。
35.(15分)【答案】
(1)1s22s22p63s13p33d1(2分)
(2)d(1分) 2(2分)
(3)原子晶体(1分) 4(2分) BCl3价层电子对数为3,NH3价层电子对数为4,中心原子N上有一对孤电子对,会对三对成键电子对产生排斥力,使得三对成键电子对间的夹角变小,故BCl3的键角比NH3大(2分)
(4)4(2分)
(5)正八面体(1分) 1∶2∶1(2分)
【解析】
(1)基态P原子的核外电子排布式为1s22s22p63s23p3,将一个3s电子激发到3d能级后,核外电子排布为1s22s22p63s13p33d1;
(2)C元素位于第四周期Ⅷ族,属于d区;[C(NH3)6]3+为正八面体结构,[CCl2(NH3)4]+中有两个Cl-取代两个NH3分子的位置,有相邻和相对两种不同情况,所以[CCl2(NH3)4]+的空间构型有2种;
(3)由图1可知,立方氮化硼(BN)中N处于B原子构成的正四面体中心,故N的配位数为4,由图也可判断其为原子晶体,由共价键结合而成;BCl3价层电子对数为3,NH3价层电子对数为4,中心原子N上有一对孤电子对,会对三对成键电子对产生排斥力,使得三对成键电子对间的夹角变小,故BCl3的键角比NH3大;
(4)由题干和图2可知,Ni—N键为通过螯合作用形成的配位键,故为4 ml;
(5)由图3可知,氧离子在棱上和体心,所以Ni2+填充在由O2-构成的正八面体空隙中:依据晶胞结构,Ni2+数目为8×18+6×12=4,O2-数目为12×14+1=4,当出现晶体缺陷后,晶胞质量为4.0×10-22 g,4M(NixO)=4.0×10-22 g×NA ml-1≈241 g·ml-1,故此时晶体的化学式为Ni3O4,有一个Ni2+所在的空隙缺陷,依据化合价可知N(Ni2+)∶N(Ni3+)=1∶2,外加缺陷的空隙,填充Ni2+、Ni3+和未填充Ni离子的空隙个数之比为1∶2∶1。
36.(15分)【答案】
(1)BC(2分)
(2) (2分)
(3分)
(3) 由于硝基与甲基的差异(甲基推电子的能力强于硝基),丙醇中碳氧键的极性比2-硝基乙醇弱,故丙醇不易断键反应(2分)
(4) (3分)
(5) (3分)
【解析】
由合成路线,A的分子式为C7H8O,在Cu作催化剂的条件下发生催化氧化生成B,B的结构简式为,则A为,B与CH3CHO发生已知信息a的加成反应生成,再与Br2/CCl4发生加成反应得到,再在碱性条件下发生消去反应生成C;B与D发生反应生成E,则D为;
(1) A.B的结构简式为,化合物B在Br2的四氯化碳中发生加成反应,不可被氧化为苯甲酸,A错误;
B.化合物C中苯环、碳碳双键、醛基都是平面型结构,则至多所有原子共平面,B正确;
C.由结构简式可知化合物F的分子式为,C正确;
D.化合物G中含氧官能团有硝基和羰基、酯基,D错误;
(2) 由分析可知,化合物D的结构简式为;
B为,D为,反应③包含了三步反应,第一步为加成反应生成,第二步为醇的消去反应生成,第三步为碳碳双键与氢气发生还原反应。第二步反应的化学方程式+H2O;
(3) 根据已知信息化学键极性越强,发生化学反应时越容易断裂,化合物E与丙醇无法发生类似反应④的化学变化,其原因可能为:由于硝基与甲基的差异(甲基推电子的能力强于硝基),丙醇中碳氧键的极性比2-硝基乙醇弱,故丙醇不易断键反应;
(4) 有机物F同时符合下列条件:①分子中共有4种氢原子;②分子中存在两个苯环;③不存在—O—O—键,同分异构体的结构简式为:
(5) B为,B与CH3CHO发生已知信息a的加成反应生成,再与Br2/CCl4发生加成反应得到,再在碱性条件下发生消去反应生成C;以乙烯、化合物B为原料,乙烯与氧气发生氧化反应生成乙醛,设计B→C的转化路线为:。
2024届四川省成都市石室中学高三上学期一诊模拟考试理科综合试卷: 这是一份2024届四川省成都市石室中学高三上学期一诊模拟考试理科综合试卷,共12页。
2024届四川省成都市石室中学高三上学期一诊模拟考试理科综合试卷(1): 这是一份2024届四川省成都市石室中学高三上学期一诊模拟考试理科综合试卷(1),共12页。
2024届四川省成都市第七中学高三上学期一诊模拟考试理科综合试卷: 这是一份2024届四川省成都市第七中学高三上学期一诊模拟考试理科综合试卷,文件包含24届高三理科综合一诊模拟考试试卷pdf、24届高三理科综合一诊模拟考试试卷答案pdf等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。












