



四川省遂宁市第二名校2023-2024学年高三上学期第二次诊断性考试化学试题 Word版含解析
展开本试卷分第I卷(选择题)和第II卷(非选择题)两部分。全卷满分300分,考试时间150分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号等填写在本试卷和答题卡相应位置上。
2.作答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案。答案不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答。答案必须写在答题卡各题目指定区域内相应位置上;如需改动,先划掉原来的答案,然后再写上新答案;不准使用铅笔和涂改液。不按以上要求作答无效。
4.考生必须保证答题卡的整洁。考试结束后,将试卷和答题卡一并交回。
可能用到的相对原子质量:H1 C12 O16 Na23 P31 S32 C135.5 Ni59 I127
第I卷(选择题,共126分)
一、选择题(本题共13小题,每小题6分。在每小题给出的四个选项中,只有一项符合题目要求)
1. 化学与科技、生活有密切关系。下列叙述不正确的是
A. 小苏打、纯碱均可用于面食制作
B. 第三代核电“华龙一号”落户福建,核反应属于化学反应
C. 含钠、铜、钙金属元素的化合物均可使火焰呈现出不同的颜色
D. 天宫空间站所使用的太阳能帆板主要成分是硅单质
2. 下列反应的离子方程式正确的是
A. 通入中制
B. 向碳酸氢钠溶液中滴加少量石灰水:
C. 少量硫化钠溶液与氯化铁溶液反应:
D. 氨水中滴入少量
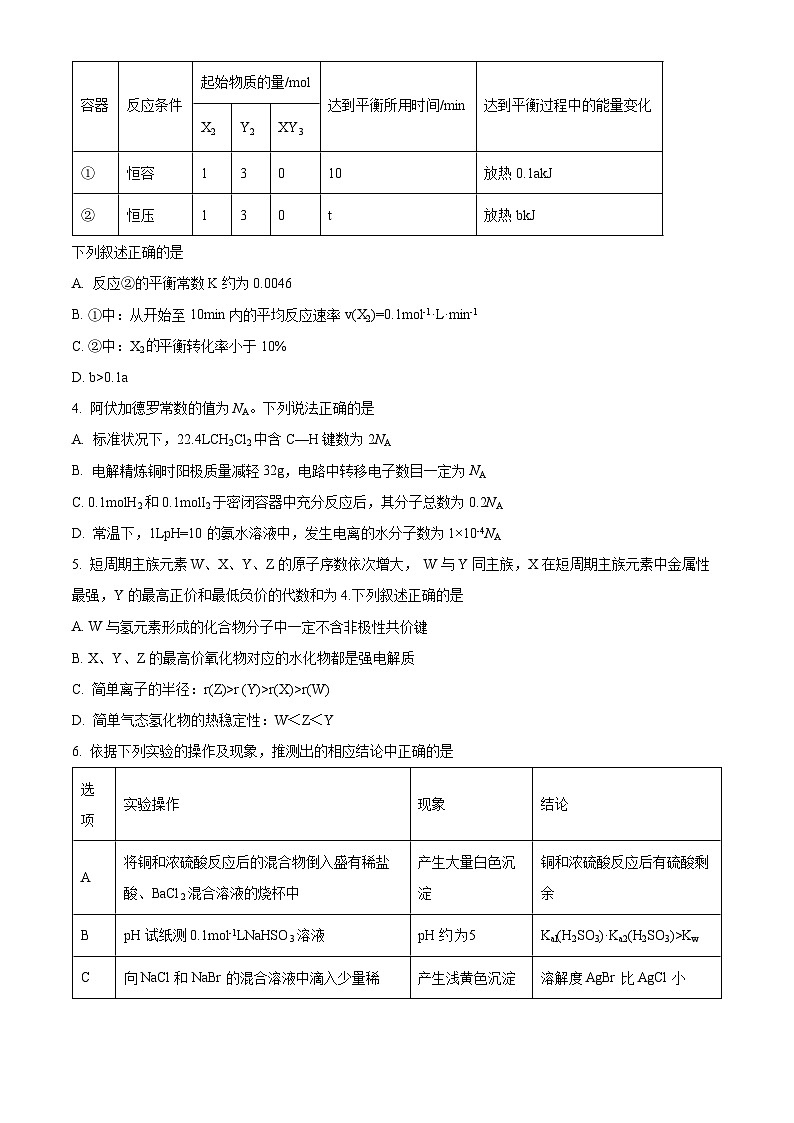
3. 相同温度下,分别在起始体积均为的两个密闭容器中发生反应: ,实验测得反应的有关数据如下表。
下列叙述正确的是
A. 反应②的平衡常数K约为0.0046
B. ①中:从开始至10min内的平均反应速率v(X2)=0.1ml-1·L·min-1
C. ②中:X2平衡转化率小于10%
D. b>0.1a
4. 阿伏加德罗常数的值为NA。下列说法正确的是
A. 标准状况下,22.4LCH2Cl2中含C—H键数为2NA
B. 电解精炼铜时阳极质量减轻32g,电路中转移电子数目一定为NA
C. 0.1mlH2和0.1mlI2于密闭容器中充分反应后,其分子总数为0.2NA
D. 常温下,1LpH=10的氨水溶液中,发生电离的水分子数为1×10-4NA
5. 短周期主族元素W、X、Y、Z的原子序数依次增大, W与Y同主族,X在短周期主族元素中金属性最强,Y的最高正价和最低负价的代数和为4.下列叙述正确的是
A. W与氢元素形成的化合物分子中一定不含非极性共价键
B. X、Y、Z的最高价氧化物对应的水化物都是强电解质
C. 简单离子的半径:r(Z)>r (Y)>r(X)>r(W)
D. 简单气态氢化物的热稳定性:W<Z<Y
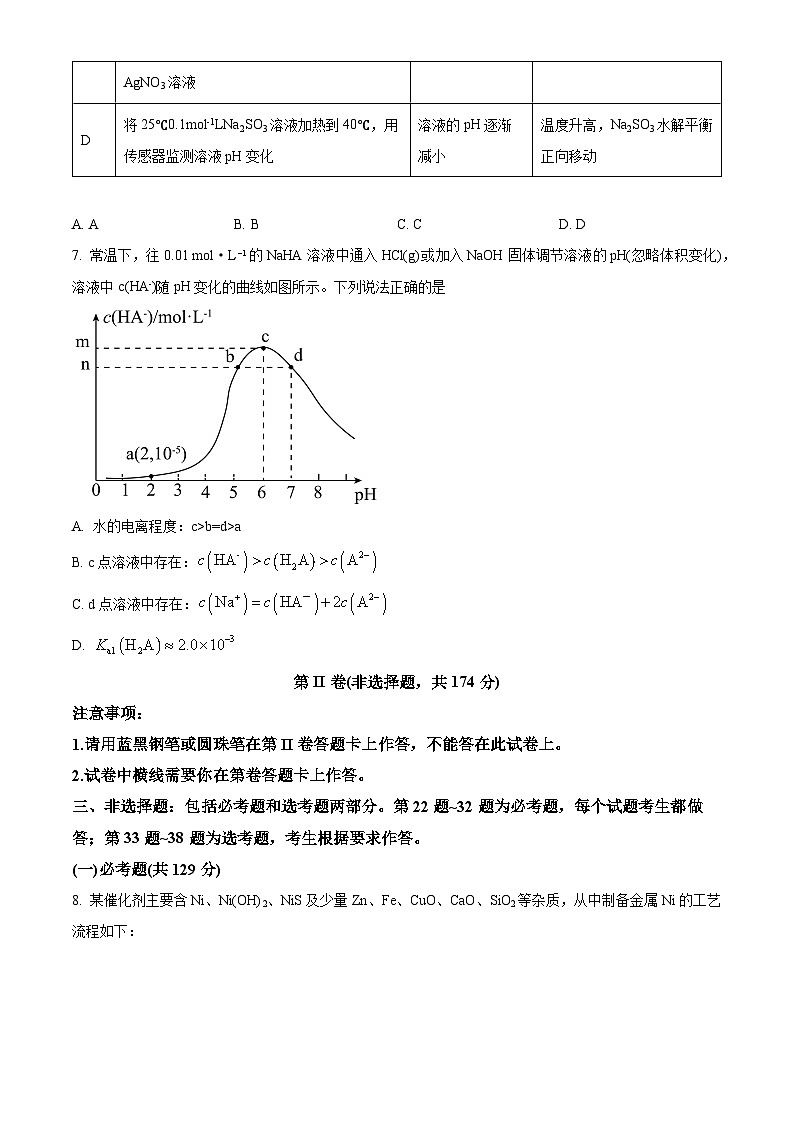
6. 依据下列实验的操作及现象,推测出的相应结论中正确的是
A. AB. BC. CD. D
7. 常温下,往0.01 ml·L的NaHA溶液中通入HCl(g)或加入NaOH固体调节溶液的pH(忽略体积变化),溶液中c(HA-)随pH变化的曲线如图所示。下列说法正确的是
A. 水的电离程度:c>b=d>a
B. c点溶液中存在:
C. d点溶液中存在:
D.
第II卷(非选择题,共174分)
注意事项:
1.请用蓝黑钢笔或圆珠笔在第II卷答题卡上作答,不能答在此试卷上。
2.试卷中横线需要你在第卷答题卡上作答。
三、非选择题:包括必考题和选考题两部分。第22题~32题为必考题,每个试题考生都做答;第33题~38题为选考题,考生根据要求作答。
(一)必考题(共129分)
8. 某催化剂主要含Ni、Ni(OH)2、NiS及少量Zn、Fe、CuO、CaO、SiO2等杂质,从中制备金属Ni的工艺流程如下:
回答下列问题:
(1)为提高废镍催化剂的浸出速率,可采取的措施有_____(答一条即可)。
(2)反应的平衡常数K=_____。滤渣1的成分除CuS外还有_____。
(3)NaClO氧化为的离子方程式为_____。
(4)室温下用有机萃取剂HDEHP萃取金属离子的萃取率随溶液pH的变化如下左图。“萃取”时应调节溶液pH的最佳范围是_____。
(5)若用Na2CO3溶液“沉镍”会产生。为测定其组成,进行下列实验:称取干燥沉淀样品3.41g,隔绝空气加热,剩余固体质量随温度变化的曲线如上图所示(300~480℃、500~750℃条件下加热,收集到的气体产物均各只有一种,750℃以上残留固体为NiO)。则样品的化学式为_____。
(6)“分解”时通N2的作用是_____。
9. 三氯氧磷(POCl3)是一种工业化工原料,某化学小组采用PCl3氧化法制备POCl3。已知:PCl3的熔点为-112℃,沸点为75.5℃。在潮湿空气中二者均极易水解而剧烈“发烟”。回答下列问题:
Ⅰ.制备PCl3
(1)氯气的发生装置可以选择上图中的_____(填字母代号),反应的离子方程式为___________。
(2)检查装置气密性并装入药品后,先关闭K1,打开K2通入干燥的CO2,一段时间后,关闭K2,加热曲颈瓶同时打开K1通入干燥氯气,反应立即进行。通干燥CO2的作用是______________。
Ⅱ.制备POCl3
(3)盛放碱石灰的仪器的名称是_____。装置G中发生的化学方程式为_____。
(4)装置F的作用除观察O2的流速之外,还有__________________。
Ⅲ.测定POCl3含量
实验制得POCl3中常含有PCl3杂质,通过下面方法可测定产品的纯度:
①快速称取5.000g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000ml/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000ml/LNa2S2O3溶液8.00mL。
已知:H3PO3+I2+H2O=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6。
(5)滴定终点的现象为__________________。该产品的纯度为______。
(6)若滴定管在滴定前无气泡,滴定后有气泡,则测定结果________(填“偏高”“偏低”或“不变”)。
10. 以甲醇、甲酸为原料制取高纯度的H2是清洁能源的重要研究方向。回答下列问题:
(1)甲醇水蒸气重整制氢主要发生以下两个反应。
主反应: CH3OH( g ) + H2O( g ) CO2 ( g ) + 3H2 ( g ) △H= +49kJ·ml -1
副反应: H2( g ) + CO2( g ) CO( g ) + H2O( g ) △H= +41kJ·ml -1
①甲醇在催化剂作用下裂解可得到H2和CO,反应的热化学方程式为___________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是___________。
②某温度下,将n(H2O):n(CH3OH)=1:1的原料气分别充入密闭容器中(忽略副反应),设恒压下甲醇的平衡时转化率为a1,恒容条件下甲醇的平衡时转化率为a2,则a1 ___________a2 (填“>”、“<”或“=”)。
(2) 工业上常用 CH4与水蒸气在一定条件下来制取 H2 ,其反应原理为:CH4(g) + H2O(g) CO(g) + 3H2 (g) △H= +203kJ·ml -1,在容积为 3L的密闭容器中通入物质的量均为3ml的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示。
压强为p1时,在N点:v正 ___________ v逆 (填“>”、“<”或“=”),N点对应温度下该反应的平衡常数K=___________ml2 ·L-2。
比较: p1___________ p2 (填“>”、“<”或“=”)
(3)HCOOH催化释氢。在催化剂作用下, HCOOH分解生成CO2和H2可能的反应机理如图所示。
①HCOOD催化释氢反应除生成HD外,还生成___________(填化学式)。
②研究发现:其他条件不变时, HCOOK 替代一部分HCOOH,催化释氢的速率增大,根据图示反应机理解释其可能的原因是___________。
(二)选考题(共45分)
【化学选修3:物质结构与性质】
11. 完成下列小题
(1)LiCO2、LiFePO4常用作锂离子电池的正极材料。
基态C原子简化电子排布式为_____,第四电离能I4(C)_____I4(Fe)(填“>”或“<”),的空间构型为_____。
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基配合物。在CO分子中,键与键数目之比为_____。
(3)铁与K2O、(环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,碳原子杂化方式有_____。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;它是典型的_____晶体。
(4)Fe催化芳香烃硝化反应时会产生亚硝酰正离子。试比较亚硝酰正离子与亚硝酸根的键角大小:_____(选填“>”、“<”或“=”),并利用价层电子对互斥理论(VSEPR)简要解释原因:_____。
(5)铁单质的堆积方式有两种,其剖面图分别如图a、b所示。
容器
反应条件
起始物质的量/ml
达到平衡所用时间/min
达到平衡过程中的能量变化
X2
Y2
XY3
①
恒容
1
3
0
10
放热0.1akJ
②
恒压
1
3
0
t
放热bkJ
选项
实验操作
现象
结论
A
将铜和浓硫酸反应后的混合物倒入盛有稀盐酸、BaCl2混合溶液的烧杯中
产生大量白色沉淀
铜和浓硫酸反应后有硫酸剩余
B
pH试纸测0.1ml-1LNaHSO3溶液
pH约5
Kal(H2SO3)·Ka2(H2SO3)>Kw
C
向NaCl和NaBr的混合溶液中滴入少量稀AgNO3溶液
产生浅黄色沉淀
溶解度AgBr比AgCl小
D
将25℃0.1ml-1LNa2SO3溶液加热到40℃,用传感器监测溶液pH变化
溶液的pH逐渐减小
温度升高,Na2SO3水解平衡正向移动
物质
NiS
ZnS
CuS
FeS
CaF2
(20℃)
四川省遂宁市第二中学2023-2024学年高三上学期第二次诊断性考试化学试题含答案: 这是一份四川省遂宁市第二中学2023-2024学年高三上学期第二次诊断性考试化学试题含答案,共17页。试卷主要包含了考生必须保证答题卡的整洁,5 Ni59 I127,0046, 常温下,往0等内容,欢迎下载使用。
四川省遂宁市第二中学2023-2024学年高三上学期第二次诊断性考试化学试题(Word版附解析): 这是一份四川省遂宁市第二中学2023-2024学年高三上学期第二次诊断性考试化学试题(Word版附解析),共14页。试卷主要包含了考生必须保证答题卡的整洁,5 Ni59 I127,0046, 常温下,往0等内容,欢迎下载使用。
四川省泸县第四名校2023-2024学年高三上学期第二次月考理综化学试题 Word版含解析: 这是一份四川省泸县第四名校2023-2024学年高三上学期第二次月考理综化学试题 Word版含解析,文件包含四川省泸县第四中学2023-2024学年高三上学期第二次月考理综化学试题Word版含解析docx、四川省泸县第四中学2023-2024学年高三上学期第二次月考理综化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。












