
鲁科版高中化学选择性必修3期末基础练
展开
这是一份鲁科版高中化学选择性必修3期末基础练,共21页。试卷主要包含了填空题,未知,实验探究题等内容,欢迎下载使用。
一、填空题
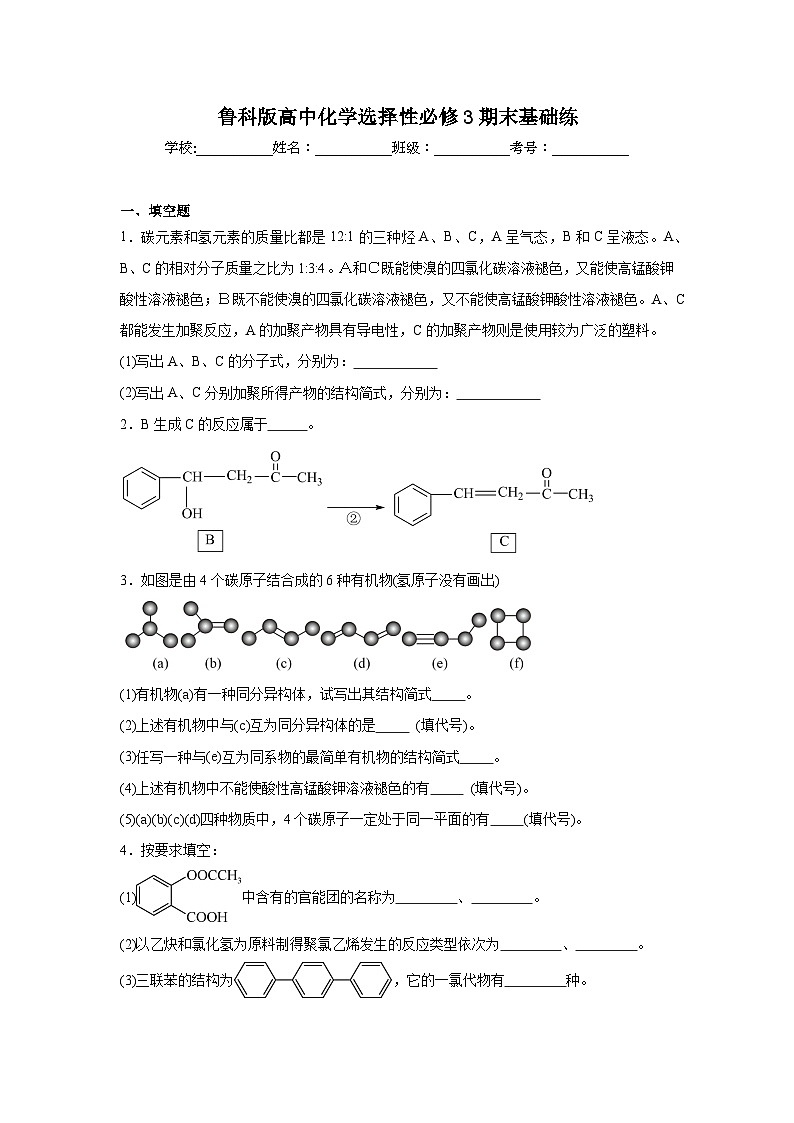
1.碳元素和氢元素的质量比都是12:1的三种烃A、B、C,A呈气态,B和C呈液态。A、B、C的相对分子质量之比为1:3:4。A和C既能使溴的四氯化碳溶液褪色,又能使高锰酸钾酸性溶液褪色;B既不能使溴的四氯化碳溶液褪色,又不能使高锰酸钾酸性溶液褪色。A、C都能发生加聚反应,A的加聚产物具有导电性,C的加聚产物则是使用较为广泛的塑料。
(1)写出A、B、C的分子式,分别为:
(2)写出A、C分别加聚所得产物的结构简式,分别为:
2.B生成C的反应属于 。
3.如图是由4个碳原子结合成的6种有机物(氢原子没有画出)
(1)有机物(a)有一种同分异构体,试写出其结构简式 。
(2)上述有机物中与(c)互为同分异构体的是 (填代号)。
(3)任写一种与(e)互为同系物的最简单有机物的结构简式 。
(4)上述有机物中不能使酸性高锰酸钾溶液褪色的有 (填代号)。
(5)(a)(b)(c)(d)四种物质中,4个碳原子一定处于同一平面的有 (填代号)。
4.按要求填空:
(1)中含有的官能团的名称为 、 。
(2)以乙炔和氯化氢为原料制得聚氯乙烯发生的反应类型依次为 、 。
(3)三联苯的结构为,它的一氯代物有 种。
(4)分子式为的某烃的所有碳原子都在同一平面上,则该烃的结构简式为 。
(5)烷烃A的蒸气密度是同条件下氢气密度的64倍,若A中含有6个甲基,但不可能是烯烃与氢气的加成产物,则A的结构简式为 。
(6)乳酸发生下列变化:,所用的试剂是a. ,b (写化学式)。
5.I.以下常见物质:①CH3OH②CH2OH-CH2OH③④⑤
(1)能发生催化氧化反应的有 (填序号)。写出其中任意一种物质发生催化氧化反应的化学方程式 。
(2)能发生消去反应的有 (填序号)。写出任意一种物质发生消去反应的化学方程式 。
II.异戊二烯是重要的有机化工原料,其键线式为()。完成下列填空:
(3)化合物X与异戊二烯具有相同的分子式,与Br2/CCl4反应后得到3-甲基-1,1,2,2-四溴丁烷。X的结构简式为 。
(4)杜仲胶是由异戊二烯发生加聚反应制得的具有反式结构的高分子物质,请写出由异戊二烯生成杜仲胶的化学方程式 。
(5)卤素互化物与卤素单质性质相似。已知(1,3-丁二烯)与氯气发生加成产物有三种:①(1,2-加成)②(1,4-加成)③(完全加成)。据此推测异戊二烯与卤素互化物的加成产物有 种(不考虑立体异构)
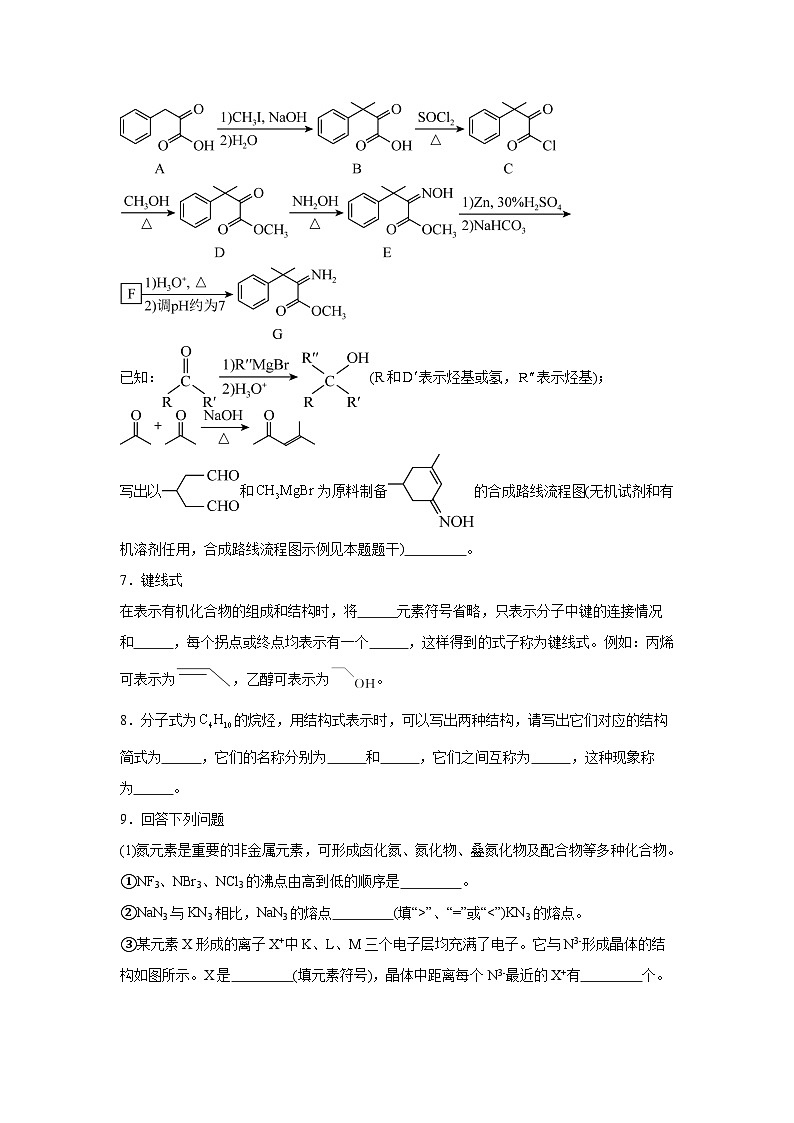
6.化合物G可用于药用多肽的结构修饰,其人工合成路线如下:
已知:(R和表示烃基或氢,表示烃基);
写出以和为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干) 。
7.键线式
在表示有机化合物的组成和结构时,将 元素符号省略,只表示分子中键的连接情况和 ,每个拐点或终点均表示有一个 ,这样得到的式子称为键线式。例如:丙烯可表示为,乙醇可表示为。
8.分子式为的烷烃,用结构式表示时,可以写出两种结构,请写出它们对应的结构简式为 ,它们的名称分别为 和 ,它们之间互称为 ,这种现象称为 。
9.回答下列问题
(1)氮元素是重要的非金属元素,可形成卤化氮、氮化物、叠氮化物及配合物等多种化合物。
①NF3、NBr3、NCl3的沸点由高到低的顺序是 。
②NaN3与KN3相比,NaN3的熔点 (填“>”、“=”或“NCl3>NF3 > Cu 6
(2) ③⑤ ② ① ⑥
【解析】(1)
①NF3、NBr3、NCl3均为分子晶体,且结构相似,相对分子质量越大则分子间作用力越大,沸点越高,故沸点由高到低的顺序是NBr3 >NCl3>NF3。
②NaN3与KN3结构相似,均为离子晶体,钠离子半径小于钾离子半径,NaN3中离子键键能更大,故NaN3的熔点>KN3的熔点。
③X失去1个电子形成X+,且离子X+中K、L、M三个电子层均充满了电子,则X为Cu元素;由图可知,晶体中XYZ轴每个方向距离每个N3-最近的X+各有2个,故共6个。
(2)
甲烷为四面体形结构,则其二氟取代物⑤和属于同一物质;③CH3OCH2CH3和CH3CH2OCH3结构相同也属于同一种物质;
具有相同质子数,不同中子数的同一元素的不同核素互为同位素;互为同位素的是②12C和14C;
同系物是指结构相似、分子组成相差若干个“CH2”原子团的有机化合物;互为同系物的是①环戊烷和环丁烷;
同分异构体是分子式相同、结构不同的化合物;互为同分异构体的是⑥CH3CH2CHO和CH3COCH3。
10.(1)2,3-二甲基戊烷
(2)1,4-二甲苯 或1,4-二甲基苯
(3)2-甲基-2,4-己二烯
(4)CH3C(CH3)2C(CH3)(CH2CH3)CH2CH2CH3
(5)CH≡CCH(CH3)C(CH3)3
【详解】(1)属于链状烷烃,选取红框中碳链作为主链、并给主链碳原子编号如图:,则名称为2,3-二甲基戊烷;答案为:2,3-二甲基戊烷。
(2)属于苯的同系物,以苯环作为母体,给苯环碳原子编号如图: ,则名称为1,4-二甲苯 或1,4-二甲基苯;答案为:1,4-二甲苯 或1,4-二甲基苯。
(3)属于二烯烃,选取含碳碳双键的最长碳链作主链,使碳碳双键的位置最小,选取红框中碳链作为主链、并给主链碳原子编号如图:,则名称为2-甲基-2,4-己二烯;答案为:2-甲基-2,4-己二烯。
(4)2,2,3-三甲基-3-乙基己烷属于链状烷烃,主链含有6个碳原子,其中2号碳上有两个甲基,3号碳上有1个甲基和1个乙基,结构简式为CH3C(CH3)2C(CH3)(CH2CH3)CH2CH2CH3;答案为:CH3C(CH3)2C(CH3)(CH2CH3)CH2CH2CH3。
(5)3,4,4-三甲基-1-戊炔属于炔烃,主链含有5个碳原子,其中1号碳原子和2号碳原子间形成碳碳三键,3号碳上有1个甲基,4号碳上有两个甲基,结构简式为CH≡CCH(CH3)C(CH3)3;答案为:CH≡CCH(CH3)C(CH3)3。
11.B
【详解】从丙和甲的结构简式上可以判断,丙比甲多了两个羟基,甲经两步转化为丙,根据官能团的转化,步骤(1)为甲与卤素单质加成生成二卤代烃,步骤(2)为二卤代烃水解得到二元醇丙;
A.丙中不含碳碳双键,步骤(2)产物中若含有未反应的甲,可用溴水检验是否含甲,甲能使溴水褪色,丙不能使溴水褪色,A正确;
B.反应(1)是加成反应,无机试剂可以是溴水或溴的四氯化碳溶液即可,B错误;
C.甲中含有碳碳双键,丙中含有醇羟基,都能与酸性KMnO4溶液发生反应,C正确;
D.根据以上分析可知乙属于烃的衍生物,其所含官能团可能为溴原子,D正确;
答案选B。
12.D
【分析】
【详解】A.糖类不一定有甜味如多糖,A错误;
B.淀粉和纤维素属于多糖,属于糖类,B错误;
C.二糖和多糖能水解,单糖不能水解,C错误;
D.糖类含有C、H、O三种元素,D正确;
答案选D。
【点睛】本题考查有机物的结构与性质,把握常见有机物的组成、官能团与性质的关系等为解答的关键,注意糖类的含义、结构和性质特点的归纳与总结。
13.B
【详解】有机物X的蒸气相对氢气的密度为51,则该有机物的相对分子质量为102,X中碳、氢、氧的质量之比为30∶5∶16,则分子中含有C、H、O三种原子的个数之比是,因此结合相对分子质量可知,该有机物的分子式为C5H10O2。如果其属于酯类,可能为甲酸和丁醇酯化,丁醇有4种,可形成4种酯;可能为乙酸和丙醇酯化,丙醇有2种,可形成2种酯;可能为丙酸和乙醇酯化,丙酸有1种,可形成1种酯;可能为丁酸和甲醇酯化,丁酸有2种,可形成2种酯,所以有9种酯;如果属于饱和一元酸,其同分异构体等于丁基的种类,共有4种,答案选B。
14.D
【分析】同系物是指结构相似,在分子组成上相差一个或若干个CH2原子团的有机物互为同系物;
【详解】A.和的不饱和度均为2,可能为二烯烃或炔烃,不一定为同系物,A错误;
B.可能为乙醇也可能为甲醚,而为甲醇,二者不一定是同系物,B错误;
C.符合通式的烃,为烯烃或环烷烃,不一定为同系物,C错误;
D.和均为烷烃,结构相似、分子组成相差16个CH2原子团,互为同系物,D正确;
故答案为D。
15.D
【详解】A.谷氨酸单钠盐,还有1个羧基,与NaOH可发生中和反应,故A错误;
B.谷氨酸与氨基乙酸中羧基的个数不同,二者不属于同系物,故B错误;
C.X与谷氨酸的结构不同,物理性质不同,故C错误;
D.X与谷氨酸具有相同的官能团种类和数目,说明X中含有2个羧基、1个氨基,符合条件的结构简式有、、、、、、、,共有8种,故D正确;
故选D。
16.B
【详解】A.不是所有的有机高分子聚合物都是良好的电绝缘体,如聚乙炔为导电塑料,故A错误;
B.红外光谱可以获得分子中所含有化学键或官能团的信息,因此红外光谱的分子可以区分苯酚与乙醇,故B正确;
C.福马尔林溶液为甲醛的水溶液,甲醛有毒且致癌,不能用于海鲜的浸泡,故C错误;
D.碳纤维属于单质,不属于新型有机高分子材料,故D错误;
答案为B。
17.B
【详解】A.卤代烃不能电离出卤素离子,卤代烃中直接加入AgNO3溶液不反应,故A错误;
B.加入NaOH的水溶液,加热后发生水解反应,在加入稀硝酸中和剩余氢氧化钠,然后加入AgNO3溶液生成卤化银,故B正确;
C.卤代烃不能电离出卤素离子,故C错误;
D.加入NaOH的乙醇溶液,加热后加入AgNO3溶液,氢氧化钠与AgNO3溶液反应生成沉淀,故D错误。
【点睛】鉴定卤代烃中卤元素,加入NaOH的水溶液加热后,需要加入硝酸中和剩余氢氧化钠,否则能生成氢氧化银。
18.B
【详解】①蔗糖、②淀粉、③纤维素、④蛋白质、⑤油脂,在硫酸存在下分别进行水解,生成物分别是葡萄糖和果糖、葡萄糖、葡萄糖、各种氨基酸、高级脂肪酸和甘油,B满足题意;
答案选B。
19.B
【分析】
【详解】2,3-二甲基-2-氯丁烷由某烯烃加成得到,则该烯烃的结构简式为:(CH3)2C=C(CH3)2,名称为: 2,3-二甲基-2-丁烯,答案选B。
20.A
【详解】A.手性碳原子为饱和碳原子,连有4个不同的基团,故Z分子中只含有1个手性碳原子,如图 ,A错误;
B.根据Z的结构简式,1mlZ分子含有2ml酚羟基、1ml酯基、1ml羧基和1ml—CONH—,均能与NaOH反应,同时分子中酯基与NaOH反应后会生成酚羟基,因此多消耗1mlNaOH,故1mlZ最多能与6mlNaOH反应,B正确;
C.由X、Y、Z的结构简式可知,三种分子均存在碳碳双键,且双键碳原子一端连有不同的原子或原子团,因此均存在顺反异构体,C正确;
D.由X的结构简式可知,X分子中含有O—H、N—H、N、O,因此X分子间可形成的氢键有:O—H…O、N—H…N、O—H…N、N—H…O,D正确;
故选A。
21.(1) f e h i c d a
(2)氧化没有燃烧完全的CO
(3) C3H6N6
(4)空气中的水蒸气和CO2进入A装置,影响CO2的测定值
【详解】(1)在过量的氧气流中将2.52g三聚氰胺样品氧化成CO2、H2O和N2,制取的氧气必须要用浓硫酸来干燥,所以开始连接顺序是e、f、h、i,一氧化碳含量测定用氧化铜,但是一氧化碳的检验必须在前,在测定一氧化碳的含量之前要用无水氯化钙对气体进行干燥,可以用A装置测定二氧化碳的量,并且放在最后来检测,所以连接顺序是:f、e、h、i、c、d、j、k、a。答案为f;e;h;i;c;d;a;
(2)有机物燃烧产物含有一氧化碳,用氧化铜可以氧化没有燃烧完全的CO。答案为氧化没有燃烧完全的CO;
(3)三聚氰胺中含有碳、氢、氮三种元素,其相对分子质量为126,2.52g即0.02ml三聚氰胺样品氧化成CO2、H2O和N2,A、B两装置分别测定的是二氧化碳、水的质量,所以二氧化碳质量是2.64g,即0.06ml,所以碳原子数目是3。水的质量是1.08g,即0.06ml,所以氢原子个数是6,则三聚氰胺的分子式为C3H6N6,又知三聚氰胺分子中有3个氨基(-NH2),且有类似苯环的对称结构,则三聚氰胺的结构简式为。答案为C3H6N6;;
(4)为了保证测得二氧化碳中的碳元素全部来自有机物,所以要避开空气中二氧化碳的干扰,还缺少尾部缺少一个干燥装置。答案为空气中的水蒸气和CO2进入A装置,影响CO2测定值。
22.(1) 球形冷凝管 冷凝回流有机物(或乙醚、环戊二烯和二甲亚砜)
(2)将装置中的空气排尽(或排尽。除去氧气),防止(避免、不让)实验过程中Fe2+被氧化
(3) ② 检漏或检查是否漏水
(4) 2KOH+FeCl2+2C5H6=Fe(C5H5)2+2KCl+2H2O 升华
(5)测定所得固体的熔点
(6)50%
【详解】(1)根据装置图,仪器b为冷凝管,可以冷凝回流有机物(或乙醚、环戊二烯和二甲亚砜),故答案为:冷凝管;冷凝回流有机物;
(2)二茂铁中铁是+2价,易被空气中氧气氧化,步骤①中通入氮气排尽装置中空气,防止实验过程中亚铁离子被氧化,故答案为:排尽装置中空气,防止实验过程中亚铁离子被氧化;
(3)由题意可知三颈烧瓶中共加入液体110mL,三颈烧瓶中盛放液体的体积不超过容积的,所以选择250mL,故选②,仪器a为恒压漏斗,使用前需要检查是否滤液,故答案为:②;检漏;
(4)KOH、FeCl2、C5H6反应生成二茂铁[Fe(C5H5)2]和KCl的化学方程式为2KOH+FeCl2+2C5H6=Fe(C5H5)2+2KCl+2H2O;二茂铁有固体直接变成气体,然后冷凝收集,其操作名称为升华,故答案为:2KOH+FeCl2+2C5H6=Fe(C5H5)2+2KCl+2H2O;升华;
(5)为了确证得到的是二茂铁,还需要进行的一项简单实验是测定所得固体的熔点;故答案为:测定所得固体的熔点;
(6)二茂铁的理论产量为××186g/ml=7.4g,则产率=×100%=50%;故答案为50%。
23. 在试管中加入3 mL乙醇,然后边摇动边加入2 mL浓硫酸和2 mL乙酸; CH3COOH+CH3CH218OHCH3CO18OC2H5+H2O 防止温度过高,乙酸乙醇挥发溢出 2CH3COOH+CO32﹣→2CH3COO﹣+H2O+CO2↑ 防止倒吸 分液漏斗 乙
【分析】(1)制备乙酸乙酯过程中,浓硫酸起到催化剂和吸水剂的作用;乙酸乙酯的制备反应是可逆反应,为提高反应物的转化率和提高产率,通常采取增大某反应物的浓度或减小生产物的浓度的方法;(2)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;(3)乙酸、乙醇的沸点低,易挥发;(4)乙酸的酸性强于碳酸;(5)根据粗产品乙酸乙酯、乙酸和乙醇的混合物中各自的性质,选择实验方法和仪器进行解答;(6)根据图中甲、乙两个装置的不同点和制取乙酸乙酯的反应原理进行解答;
【详解】(1)乙酸乙酯的制备反应,该反应为可逆反应,浓硫酸的作用为催化剂、吸水剂,吸水利于平衡向生成乙酸乙酯方向移动;因该反应为可逆反应,反应中加入过量的乙醇,平衡向正反应方向移动,CH3COOH的转化率增大;浓硫酸的密度比乙醇大,所以后加,溶于水放热,须边加边摇放热混合。步骤①中,配制这一比例的混合液的正确操作是:在试管中加入3 mL乙醇,然后边摇动边加入2 mL浓硫酸和2 mL乙酸;(2)实验中用含18O的乙醇与乙酸作用,酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应,所以乙酸脱羟基,乙醇脱氢离子,18O在产物乙酸乙酯中,故答案为CH3COOH+CH3CH218OHCH3CO18OC2H5+H2O;(3)乙醇沸点78.0℃、乙酸的沸点117.9℃,它们的沸点较低,为防止乙醇、乙酸挥发,应小火加热,否则易造成原料的损失,步骤③中,要用小火加热,其原因是:防止温度过高,乙酸乙醇挥发溢出;(4)步骤④中可观察到b试管中有细小的气泡冒出,那是生成了二氧化碳,因乙酸的酸性比碳酸强,所以乙酸能和碳酸钠反应生成二氧化碳气体,故2CH3COOH+CO32﹣→2CH3COO﹣+H2O+CO2↑ ;(5)乙酸乙酯中混有乙醇和乙酸,二者易溶于水而产生倒吸,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用分液的方法即可,所以用到的仪器为分液漏斗;(6)图中甲、乙两个装置的不同点,乙装置能将易挥发的反应物乙酸和乙醇冷凝回流到反应容器中,继续反应,而甲不可。
相关试卷
这是一份鲁科版高中化学选择性必修1期末基础练,共25页。试卷主要包含了填空题,未知,实验探究题等内容,欢迎下载使用。
这是一份鲁科版高中化学选择性必修3期末达标练,共19页。试卷主要包含了填空题,未知,实验探究题等内容,欢迎下载使用。
这是一份鲁科版高中化学选择性必修3期末巩固练,共20页。试卷主要包含了填空题,未知,实验探究题等内容,欢迎下载使用。










