





所属成套资源:2024届高考化学二轮专题复习与测试课件
2024届高考化学二轮专题复习与测试第一部分专题六物质结构与性质课件
展开
这是一份2024届高考化学二轮专题复习与测试第一部分专题六物质结构与性质课件,共60页。PPT课件主要包含了高考调研明晰考向,答案D,答案B,答案A,核心整合热点突破,答案C,常见等电子体,答案1,续上表,②体心立方堆积等内容,欢迎下载使用。
专题六 物质结构与性质
2.(2023·新课标卷)“肼合成酶”以其中的Fe2+配合物为催化中心,可将NH2OH与NH3转化为肼(NH2NH2),其反应历程如下所示。
下列说法错误的是( ) A.NH2OH、NH3和H2O均为极性分子B.反应涉及N—H、N—O键断裂和N—N键生成C.催化中心的Fe2+被氧化为Fe3+,后又被还原为Fe2+D.将NH2OH替换为ND2OD,反应可得ND2ND2
解析:NH2OH,NH3,H2O的电荷分布都不均匀,不对称,为极性分子,A项正确;由反应历程可知,有N—H,N—O键断裂,还有N—H键生成,B项正确;由反应历程可知,反应过程中,Fe2+先失去电子发生氧化反应生成Fe3+,后面又得到电子生成Fe2+,C项正确;由反应历程可知,反应过程中,生成的NH2NH2有两个氢来源于NH3,所以将NH2OH替换为ND2OD,不可能得到ND2ND2,得到ND2NH2和HDO,D项错误。故选D。
3.(2023·全国乙卷)中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物(MgxFe2-xSiO4)。回答下列问题:(1)基态Fe原子的价电子排布式为______________。橄榄石中,各元素电负性大小顺序为__________,铁的化合价为__________。(2)已知一些物质的熔点数据如下表:
Na与Si均为第三周期元素,NaCl熔点明显高于SiCl4,原因是__________________________________________________________________________________。
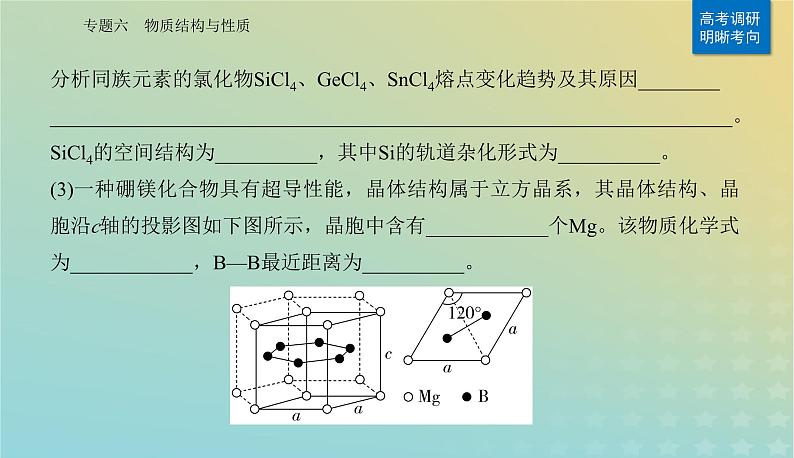
分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因___________________________________________________________________________。SiCl4的空间结构为__________,其中Si的轨道杂化形式为__________。(3)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下图所示,晶胞中含有____________个Mg。该物质化学式为____________,B—B最近距离为__________。
物质结构是高中化学的重要组成部分,是学习其他化学知识的基础,就是人们常说的“结构决定性质”,在高考中也占有相当的比重。物质结构题型包括填空、简答,常涉及原子结构与元素的性质(如微粒的电子排布、电离能及电负性的比较)、元素周期律、分子结构与性质(如化学键类型、原子的杂化方式、分子空间构型的分析与判断)、晶体结构与性质(如晶体类型、性质及粒子间作用的关系、以晶胞为单位的密度和微粒间距离与微粒质量的关系计算及化学式分析)等考点。侧重考查分析能力和计算能力,需要熟练晶胞结构,具备一定的数学计算能力,综合性较强。
1.2021年,我国发布了《医用同位素中长期发展规划》,对提升医用同位素相关产业能力水平、保障健康中国战略实施具有重要意义。医用同位素有14C、18F、131I等。下列说法正确的是( )A.14C位于元素周期表的第二周期第ⅥA族B.18F和131I具有相同的最外层电子数C.14C与12C的性质完全相同D.化合物23Na131I的中子总数为奇数
解析:C原子序数为6,位于元素周期表的第二周期第ⅣA族,故A项错误;F和I属于第ⅦA族,最外层电子数相同,故B项正确;14C与12C的化学性质几乎完全相同,但物理性质有差异,故C项错误;23Na131I的中子总数为(23-11)+(131-53),不为奇数,故D项错误。故选B。
2.一种电池电解质溶液中盐的结构如图所示。R、W、X、Y、Z为原子序数递增的短周期元素,其中X、Z位于同一主族,R和Y的原子核外电子层数相同。下列说法正确的是( )A.单质熔点:Z>XB.简单离子半径:R>W>X>YC.实验室中少量R单质通常保存在煤油中D.最高价氧化物对应水化物的酸性强弱:Y>W
解析:X、Z位于同一主族,则一定不是同一周期,而R可以形成+1价阳离子,应为第ⅠA族元素,其原子序数在几种元素中最小,所以R不能位于第三周期,则R为Li元素;R和Y的原子核外电子层数相同,即有2层电子,且Y形成1个共
价键,所以Y为F元素;X、W均可以形成2个共价键,且位于Li和F之间,X的原子序数较大,所以X为O元素,整个阴离子带1个单位负电荷,则W原子核外应有3个电子,2个用于形成共价键,1个和所得的电子形成电子对,所以W为B元素;X与Z同主族,则Z为S元素。据此分析解答。Z和X的单质分别为S和O2(或O3),O2(或O3)常温下为气体,S单质为固体,所以单质熔点:Z>X,A项正确;电子层数越多离子半径越大,电子层数相同时,核电荷数越小离子半径越大,所以离子半径B3->O2->F->Li+,即W>X>Y>R,B项错误;Li单质的密度比煤油小,不能保存在煤油中,应保存在石蜡中,C项错误;Y为F元素,没有正价,则没有最高价氧化物对应的水化物,D项错误。故选A。
5.很多含巯基(—SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。
(1)基态硫原子价电子排布式为________________________________________。(2)H2S、CH4、H2O的沸点由高到低顺序为______________________。(3)汞的原子序数为80,位于元素周期表第______周期第ⅡB族。(4)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有__________(填字母)。A.在Ⅰ中S原子采取sp3杂化B.在Ⅱ中S元素的电负性最大C.在Ⅲ中C—C—C键角是180°D.在Ⅲ中存在离子键与共价键E.在Ⅳ中硫氧键的键能均相等(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比,水溶性较好的是________________________。
考点一 原子结构和元素周期律1.原子结构与性质(1)核外电子排布规律。①能量最低原理:在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低。如Ge:1s22s22p63s23p63d104s24p2。②泡利原理:在每个原子轨道里,最多只能容纳2个电子,它们的自旋相反。③洪特规则:基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行。
(2)核外电子排布的表达式。
2.元素周期律(1)原子核外电子排布的周期性。随着原子序数的增加,主族元素原子的外围电子排布呈现周期性的变化:每隔一定数目的元素,主族元素原子的外围电子排布重复出现从ns1到ns2np6的周期性变化(第一周期除外)。(2)主要化合价的周期性变化。元素的主要化合价随着原子序数的递增而呈现周期性的变化规律,最高正价等于主族的族序数(F无正价,O无最高正价)。(3)原子半径的周期性变化。同周期元素原子半径从左向右依次减小;同主族元素原子半径从上往下依次增大。
3.第一电离能(1)第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。常用符号I1表示,单位为kJ·ml-1。(2)元素第一电离能的周期性变化。随着原子序数的递增,元素的第一电离能呈周期性变化:同周期从左到右,第一电离能有逐渐增大的趋势,稀有气体的第一电离能最大,碱金属的第一电离能最小。(3)元素电离能的应用。①判断元素金属性的强弱:电离能越小,金属越容易失去电子,金属性越强;反之,则越弱。②判断元素的化合价:如果某元素的In+1≫In,则该元素的常见化合价为+n价,如钠元素I2≫I1,所以钠元素的化合价为+1价。
10e-微粒和18e-微粒
(2023·广州统考二模)X、Y、Z、N是原子序数依次增大的4种短周期元素,其元素性质或原子结构如下表。下列说法正确的是( )
1.(2023·全国甲卷)W、X、Y、Z为短周期主族元素,原子序数依次增大,最外层电子数之和为19。Y的最外层电子数与其K层电子数相等,WX2是形成酸雨的物质之一。下列说法正确的是( ) A.原子半径:X>WB.简单氢化物的沸点:XX>WC.YX的水合物具有两性D.W单质只有4种同素异形体
解析:W、X、Y为短周期元素,原子序数依次增大,简单离子X2-与Y2+具有相同的电子结构,则它们均为10电子微粒,X为O,Y为Mg,W、X、Y组成的物质溶于稀盐酸有无色无味的气体产生,则W为C,产生的气体为二氧化碳,
据此分析解答。X为O,氧的常见价态有-1价和-2价,如H2O2和H2O,A项正确;W为C,X为O,Y为Mg,同主族时电子层数越多,原子半径越大,电子层数相同时,原子序数越小,原子半径越大,所以原子半径大小为Y>W>X,B项错误;Y为Mg,X为O,他们可形成MgO,水合物为Mg(OH)2,Mg(OH)2只能与酸反应生成盐和水,不能与碱反应,所以YX的水合物没有两性,C项错误;W为C,碳的同素异形体有金刚石、石墨、石墨烯、富勒烯、碳纳米管等,种类不止4种,D项错误。故选A。
3.(2023·湖南卷)日光灯中用到的某种荧光粉的主要成分为3W3(ZX4)2·WY2。已知:X、Y、Z和W为原子序数依次增大的前20号元素,W为金属元素。基态X原子s轨道上的电子数和p轨道上的电子数相等,基态X、Y、Z原子的未成对电子数之比为2∶1∶3。下列说法正确的是( ) A.电负性:X>Y>Z>WB.原子半径:XW,A项错误;同一周期
原子半径从左到右依次减小,同一主族原子半径从上到下依次增大,故四种原子的原子半径大小为YY>X>WC.Z、W原子形成稀有气体电子构型的简单离子的半径:WY>X,故A项错误;根据同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,则电负性:Z>Y>X>W,故B项正确;根据同电子层结构“核多径小”,则Z、W原子形成稀有气体电子构型的简单离子的半径:WHCl。(3)氢键与物质的熔、沸点:H2O的熔、沸点高于H2S,因水分子间存在氢键,H2S分子间只存在范德华力。常见的非金属性较强的元素(如N、O、F)的氢化物分子间可形成氢键。
2.理清化学键类型与物质类型的对应关系
3.氢键(1)作用粒子:氢、氟、氧、氮原子(分子内、分子间)等。(2)特征:有方向性和饱和性。(3)强度:共价键>氢键>范德华力。(4)影响强度的因素:对于A—H…B—,A、B的电负性越大,B原子的半径越小,氢键键能越大。(5)对物质性质的影响:分子间氢键的存在,使物质的熔、沸点升高,在水中的溶解度增大,如熔、沸点:H2O>H2S,HF>HCl,NH3>PH3。
(3)Na3N____________,Mg(OH)2_______________________________________,Na2S________________,NaH_________________________________________,NH4H______________,NaCN_________________________________________,NaSCN______________,NaBH4_______________________________________。
2.(2023·北京卷)下列事实不能通过比较氟元素和氯元素的电负性进行解释的是( )A.F—F键的键能小于Cl—Cl键的键能B.三氟乙酸的Ka大于三氯乙酸的KaC.氟化氢分子的极性强于氯化氢分子的极性D.气态氟化氢中存在(HF)2,而气态氯化氢中是HCl分子
解析:F原子半径小,两个原子间的斥力较强,F—F键不稳定,因此F—F键的键能小于Cl—Cl键的键能,与电负性无关,A项符合题意;氟的电负性大于氯的电负性,F—C键的极性大于Cl—C键的极性,使F3C—的极性大于Cl3C—的极性,导致三氟乙酸的羧基中的羟基极性更大,更容易电离出氢离子,酸性
更强,B项不符合题意;氟的电负性大于氯的电负性,F—H键的极性大于Cl—H键的极性,导致HF分子的极性强于HCl分子的极性,C项不符合题意;氟的电负性大于氯的电负性,与氟原子相连的氢原子可以与另外的氟原子形成分子间氢键,因此气态氟化氢中存在(HF)2,D项不符合题意。故选A。
3.(2023·北京卷)中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。下列关于金刚石、石墨、石墨炔的说法正确的是( )
A.三种物质中均有碳碳原子间的σ键B.三种物质中的碳原子都是sp3杂化C.三种物质的晶体类型相同D.三种物质均能导电
解析:原子间优先形成σ键,三种物质中均存在σ键,A项正确;金刚石中所有碳原子均采用sp3杂化,石墨中所有碳原子均采用sp2杂化,石墨炔中苯环上的碳原子采用sp2杂化,碳碳三键上的碳原子采用sp杂化,B项错误;金刚石为共价晶体,石墨炔为分子晶体,石墨为混合晶体,C项错误;金刚石中没有自由移动电子,不能导电,D项错误。故选A。
4.(2023·新课标卷)一种可吸附甲醇的材料,其化学式为[C(NH2)3]4[B(OCH3)4]3Cl,部分晶体结构如下图所示,其中[C(NH2)3]+为平面结构。下列说法正确的是( )
A.该晶体中存在N—H…O氢键B.基态原子的第一电离能:C碳化硅>晶体硅。
(2)离子晶体。①衡量离子晶体稳定性的物理量是晶格能。晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大。②一般地说,阴、阳离子的电荷数越多,离子半径越小,晶格能越大,离子间的作用力就越强,离子晶体的熔、沸点就越高,如熔点:MgO>NaCl>CsCl。
(3)分子晶体。①分子间作用力越大,物质的熔、沸点越高;但具有分子间氢键的分子晶体熔、沸点反常得高。如H2O>H2Te>H2Se>H2S。②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如SnH4>GeH4>SiH4>CH4。③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如CO>N2。④在同分异构体中,一般支链越多,熔、沸点越低,如正戊烷>异戊烷。(4)金属晶体。金属离子半径越小,所带电荷数越多,其金属键越强,熔、沸点就越高,如熔、沸点:Na
相关课件
这是一份高考化学二轮复习专题5物质结构与性质课件,共60页。PPT课件主要包含了高考命题分析,核素和同位素,d64s2,s23p4,s22p3,s24p4,d54s2,练预测·押考向,GeSe,电子云等内容,欢迎下载使用。
这是一份2024届高考化学二轮专题复习与测试第二部分题型解读六物质结构与性质题型突破课件,共31页。
这是一份2023高考化学二轮专题复习与测试第一部分专题十物质结构与性质课件,共60页。PPT课件主要包含了高考调研明晰考向,答案C,答案D,答案B,答案A,核心整合热点突破,常见等电子体,续上表,②体心立方堆积,③六方最密堆积等内容,欢迎下载使用。








