




还剩17页未读,
继续阅读
课题2第1课时 酸和碱的中和反应(1)-【本原课堂】2022-2023学年九年级下册化学同步课件(人教版)
展开
这是一份课题2第1课时 酸和碱的中和反应(1)-【本原课堂】2022-2023学年九年级下册化学同步课件(人教版),共25页。
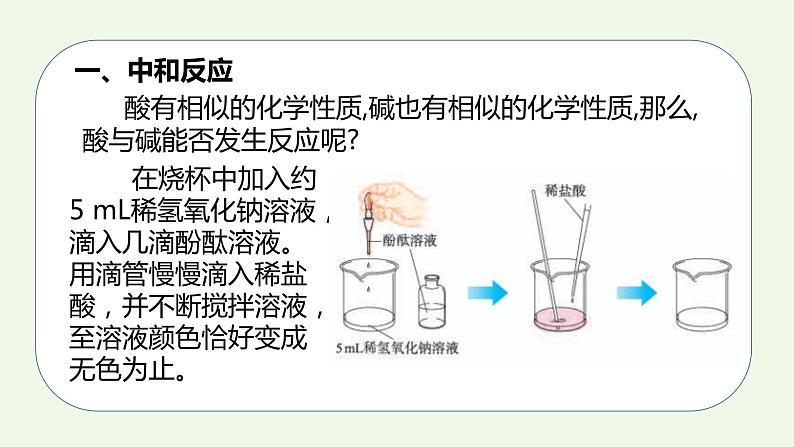
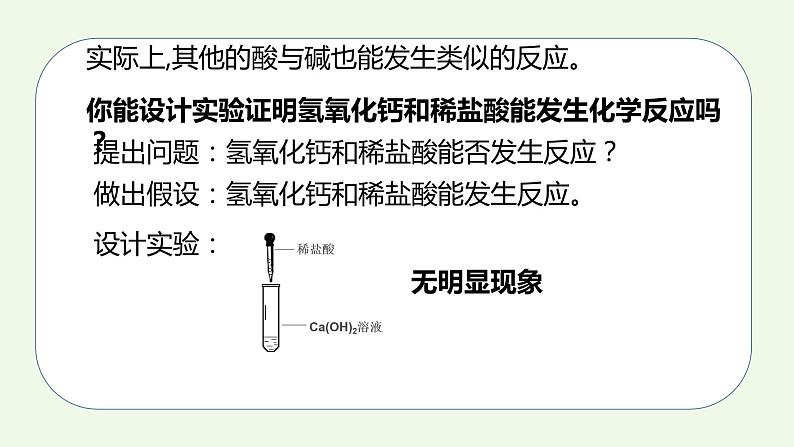
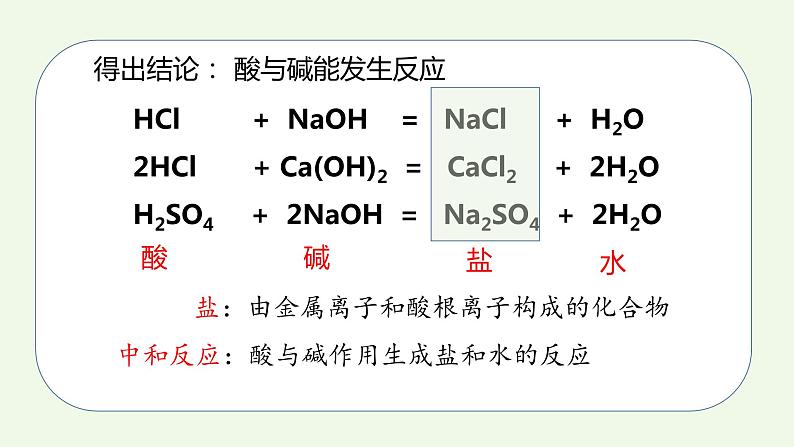
第十单元课题2 酸和碱的中和反应课时11.实验验证酸和碱能发生化学反应3.能从微观粒子的角度说出中和反应的实质4.知道中和反应在实际生活中的运用2.知道中和反应并能书写方程式一、中和反应 酸有相似的化学性质,碱也有相似的化学性质,那么,酸与碱能否发生反应呢? 在烧杯中加入约5 mL稀氢氧化钠溶液,滴入几滴酚酞溶液。用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止。 能,溶液颜色由红色变成无色,说明原先有的氢氧化钠消失了,反应物消失说明酸和碱发生了化学反应。 该实验现象能否证明酸与碱发生了化学反应?你的理由是?在上面的实验中,发生了如下的反应,生成了氯化钠和水:实际上,其他的酸与碱也能发生类似的反应。你能设计实验证明氢氧化钙和稀盐酸能发生化学反应吗?提出问题:氢氧化钙和稀盐酸能否发生反应?做出假设:氢氧化钙和稀盐酸能发生反应。设计实验:无明显现象思路分析:证明无明显现象的化学反应的发生?Ca(OH)2+HCl ——1、证明反应物的减少或消失; 2、证明有新物质生成。+锌粒、氧化铜、大理石酚酞、二氧化碳酸与碱能发生反应得出结论: HCl + NaOH = NaCl + H2O 2HCl + Ca(OH)2 = CaCl2 + 2H2O H2SO4 + 2NaOH = Na2SO4 + 2H2O盐盐:由金属离子和酸根离子构成的化合物酸碱水中和反应:酸与碱作用生成盐和水的反应中和反应的实质HCl + NaOH = NaCl + H2OHCl = H+ + Cl-NaOH = Na+ + OH-HCl和NaOH在水中解离出离子不变的粒子: 减少的粒子:生成的粒子:观察反应前后溶液中粒子的变化,回答下列问题:Na+、Cl- H+、OH- H2O+中和反应的实质:=练一练写出下列酸和碱反应的方程式,并画出微观图氢氧化钙溶液稀盐酸2HCl+Ca(OH)2=CaCl2+2H2OCl-Cl-Cl-Cl-Ca2+Ca2+二、中和反应在实际中的应用 在农业生产中,农作物生长对于土壤的酸碱性有一定的要求。根据土壤情况,可以利用中和反应,在土壤中加入酸性或碱性物质,调节土壤的酸碱性,以利于农作物生长。 中和反应在日常生活和工农业生产中有广泛的应用。 例如,近年来由于空气污染形成酸雨,导致一些地方的土壤酸性增强,不利于农作物生长,于是人们将适量的熟石灰加入土壤,以中和其酸性。 工厂生产过程中的污水,需进行一系列的处理。例如,硫酸厂的污水中含有硫酸等物质,可以用熟石灰进行中和处理;印染厂的废水呈碱性,可加人硫酸进行中和。 人的胃液里含有适量盐酸,可以帮助消化。但是如果饮食过量时,胃会分泌大量胃酸,造成胃部不适以致消化不良。在这种情况下,可以遵医嘱服用某些含有碱性物质的药物,以中和过多的胃酸。 人被有些蚊虫叮咬后,蚊虫在人的皮肤内分泌出蚁酸,使叮咬处很快肿成大包而痛痒。如果涂一些含有碱性物质的溶液,就可减轻痛痒。讨论: 根据你的生活经验或查阅资料,举出利用中和反应的实例。1.食用松花蛋时加入食醋可以将其中的碱性物质中和,从而消除其涩味,使松花蛋变得可口。2.洗发时先用弱碱性的洗发剂,再用弱酸性的护发素,可以保护头发。小结酸和碱反应中和反应定义:酸+碱=盐+水实质:应用改良土壤酸碱性处理工厂废水用于医学H+ + OH- = H2O用于食品口味调剂练一练1.下列反应中属于中和反应的是( )A. CuO + 2HCl = CuCl2+ H2O B. 2KOH+ H2SO4 =K2SO4 + 2H2O C. CO2+2NaOH = Na2CO3 + 2H2O D. Zn + 2HCl = ZnCl2 +H2↑B 2.能和稀盐酸发生中和反应的是( ) A、铁锈 B、大理石 C、石灰水 D、锌粒C3.判断下列化合物属于盐的是( ) A、Na2O B、Mg(OH)2 C、H2SO4 D、Na2CO3 D4.下列物质中按酸、碱、盐顺序排列的是( ) A.碳酸钾 硝酸 氢氧化镁 B.硫酸亚铁 氢氧化钙 硫酸 C.盐酸 氢氧化钡 硫酸铜 D.氯化钙 碳酸钙 氧化钙C5.中和反应在生产、生活中应用广泛。下列应用的主要原理不涉及中和反应的是( )A. 生石灰用于加热即热食品 B. 氢氧化铝用于治疗胃酸过多 C. 熟石灰用于改良酸性土壤 D. 硼酸用于处理皮肤上沾有的碱A6.中和反应在生活生产中有广泛的应用,下列做法不是利用中和反应原理的是( )A.洗发后使用护发素,使头发更柔顺B.用肥皂水缓解蚊虫叮咬的痛痒C.用盐酸除去铁锈D.用熟石灰处理工厂的废硫酸C7. 根据如图实验,判断下列说法错误的是( ) A.浓盐酸有挥发性B.分子在不断运动C.B烧杯溶液的颜色会改变D.B烧杯内发生了置换反应D8. 氢氧化钠溶液与盐酸反应的化学方程式为: 。如图是该反应的微观示意图,则该反应前后没有发生变化的离子有 ;从微观角度看,该化学反应的实质是 。 Na+、Cl- 9. 向NaOH溶液中滴入HCl溶液至恰好完全反应。 (1)如图表示该反应前后溶液中存在的主要离子,在下面横线上写出每种图形表示的离子(填离子符号)。(2)下列物质中只有一种能与KOH溶液发生类似上述的反应,该物质是 (填序号)。 ①HNO3 ②CuSO4 ③CaCl2OH- Na+①
第十单元课题2 酸和碱的中和反应课时11.实验验证酸和碱能发生化学反应3.能从微观粒子的角度说出中和反应的实质4.知道中和反应在实际生活中的运用2.知道中和反应并能书写方程式一、中和反应 酸有相似的化学性质,碱也有相似的化学性质,那么,酸与碱能否发生反应呢? 在烧杯中加入约5 mL稀氢氧化钠溶液,滴入几滴酚酞溶液。用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止。 能,溶液颜色由红色变成无色,说明原先有的氢氧化钠消失了,反应物消失说明酸和碱发生了化学反应。 该实验现象能否证明酸与碱发生了化学反应?你的理由是?在上面的实验中,发生了如下的反应,生成了氯化钠和水:实际上,其他的酸与碱也能发生类似的反应。你能设计实验证明氢氧化钙和稀盐酸能发生化学反应吗?提出问题:氢氧化钙和稀盐酸能否发生反应?做出假设:氢氧化钙和稀盐酸能发生反应。设计实验:无明显现象思路分析:证明无明显现象的化学反应的发生?Ca(OH)2+HCl ——1、证明反应物的减少或消失; 2、证明有新物质生成。+锌粒、氧化铜、大理石酚酞、二氧化碳酸与碱能发生反应得出结论: HCl + NaOH = NaCl + H2O 2HCl + Ca(OH)2 = CaCl2 + 2H2O H2SO4 + 2NaOH = Na2SO4 + 2H2O盐盐:由金属离子和酸根离子构成的化合物酸碱水中和反应:酸与碱作用生成盐和水的反应中和反应的实质HCl + NaOH = NaCl + H2OHCl = H+ + Cl-NaOH = Na+ + OH-HCl和NaOH在水中解离出离子不变的粒子: 减少的粒子:生成的粒子:观察反应前后溶液中粒子的变化,回答下列问题:Na+、Cl- H+、OH- H2O+中和反应的实质:=练一练写出下列酸和碱反应的方程式,并画出微观图氢氧化钙溶液稀盐酸2HCl+Ca(OH)2=CaCl2+2H2OCl-Cl-Cl-Cl-Ca2+Ca2+二、中和反应在实际中的应用 在农业生产中,农作物生长对于土壤的酸碱性有一定的要求。根据土壤情况,可以利用中和反应,在土壤中加入酸性或碱性物质,调节土壤的酸碱性,以利于农作物生长。 中和反应在日常生活和工农业生产中有广泛的应用。 例如,近年来由于空气污染形成酸雨,导致一些地方的土壤酸性增强,不利于农作物生长,于是人们将适量的熟石灰加入土壤,以中和其酸性。 工厂生产过程中的污水,需进行一系列的处理。例如,硫酸厂的污水中含有硫酸等物质,可以用熟石灰进行中和处理;印染厂的废水呈碱性,可加人硫酸进行中和。 人的胃液里含有适量盐酸,可以帮助消化。但是如果饮食过量时,胃会分泌大量胃酸,造成胃部不适以致消化不良。在这种情况下,可以遵医嘱服用某些含有碱性物质的药物,以中和过多的胃酸。 人被有些蚊虫叮咬后,蚊虫在人的皮肤内分泌出蚁酸,使叮咬处很快肿成大包而痛痒。如果涂一些含有碱性物质的溶液,就可减轻痛痒。讨论: 根据你的生活经验或查阅资料,举出利用中和反应的实例。1.食用松花蛋时加入食醋可以将其中的碱性物质中和,从而消除其涩味,使松花蛋变得可口。2.洗发时先用弱碱性的洗发剂,再用弱酸性的护发素,可以保护头发。小结酸和碱反应中和反应定义:酸+碱=盐+水实质:应用改良土壤酸碱性处理工厂废水用于医学H+ + OH- = H2O用于食品口味调剂练一练1.下列反应中属于中和反应的是( )A. CuO + 2HCl = CuCl2+ H2O B. 2KOH+ H2SO4 =K2SO4 + 2H2O C. CO2+2NaOH = Na2CO3 + 2H2O D. Zn + 2HCl = ZnCl2 +H2↑B 2.能和稀盐酸发生中和反应的是( ) A、铁锈 B、大理石 C、石灰水 D、锌粒C3.判断下列化合物属于盐的是( ) A、Na2O B、Mg(OH)2 C、H2SO4 D、Na2CO3 D4.下列物质中按酸、碱、盐顺序排列的是( ) A.碳酸钾 硝酸 氢氧化镁 B.硫酸亚铁 氢氧化钙 硫酸 C.盐酸 氢氧化钡 硫酸铜 D.氯化钙 碳酸钙 氧化钙C5.中和反应在生产、生活中应用广泛。下列应用的主要原理不涉及中和反应的是( )A. 生石灰用于加热即热食品 B. 氢氧化铝用于治疗胃酸过多 C. 熟石灰用于改良酸性土壤 D. 硼酸用于处理皮肤上沾有的碱A6.中和反应在生活生产中有广泛的应用,下列做法不是利用中和反应原理的是( )A.洗发后使用护发素,使头发更柔顺B.用肥皂水缓解蚊虫叮咬的痛痒C.用盐酸除去铁锈D.用熟石灰处理工厂的废硫酸C7. 根据如图实验,判断下列说法错误的是( ) A.浓盐酸有挥发性B.分子在不断运动C.B烧杯溶液的颜色会改变D.B烧杯内发生了置换反应D8. 氢氧化钠溶液与盐酸反应的化学方程式为: 。如图是该反应的微观示意图,则该反应前后没有发生变化的离子有 ;从微观角度看,该化学反应的实质是 。 Na+、Cl- 9. 向NaOH溶液中滴入HCl溶液至恰好完全反应。 (1)如图表示该反应前后溶液中存在的主要离子,在下面横线上写出每种图形表示的离子(填离子符号)。(2)下列物质中只有一种能与KOH溶液发生类似上述的反应,该物质是 (填序号)。 ①HNO3 ②CuSO4 ③CaCl2OH- Na+①
相关资料
更多









