所属成套资源:新教材2024届高考化学二轮专项分层特训卷多份(附解析)
新教材2024届高考化学二轮专项分层特训卷第二部分常考热点特训4化学反应机理循环图分析(附解析)
展开
这是一份新教材2024届高考化学二轮专项分层特训卷第二部分常考热点特训4化学反应机理循环图分析(附解析),共18页。
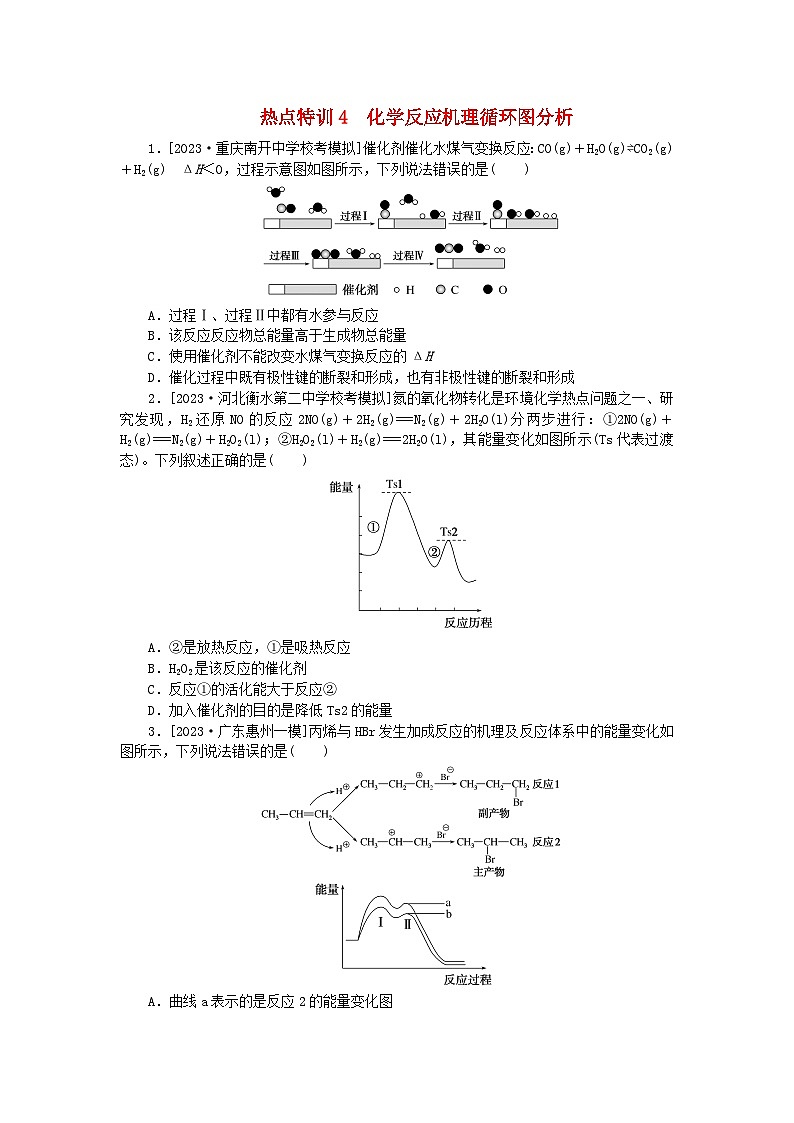
A.过程Ⅰ、过程Ⅱ中都有水参与反应
B.该反应反应物总能量高于生成物总能量
C.使用催化剂不能改变水煤气变换反应的ΔH
D.催化过程中既有极性键的断裂和形成,也有非极性键的断裂和形成
2.[2023·河北衡水第二中学校考模拟]氮的氧化物转化是环境化学热点问题之一、研究发现,H2还原NO的反应2NO(g)+2H2(g)===N2(g)+2H2O(l)分两步进行:①2NO(g)+H2(g)===N2(g)+H2O2(l);②H2O2(l)+H2(g)===2H2O(l),其能量变化如图所示(Ts代表过渡态)。下列叙述正确的是( )
A.②是放热反应,①是吸热反应
B.H2O2是该反应的催化剂
C.反应①的活化能大于反应②
D.加入催化剂的目的是降低Ts2的能量
3.[2023·广东惠州一模]丙烯与HBr发生加成反应的机理及反应体系中的能量变化如图所示,下列说法错误的是( )
A.曲线a表示的是反应2的能量变化图
B.反应2放出热量更多
C.对于反应1和反应2,第Ⅰ步都是反应的决速步骤
D.相同条件下反应2的速率比反应1大
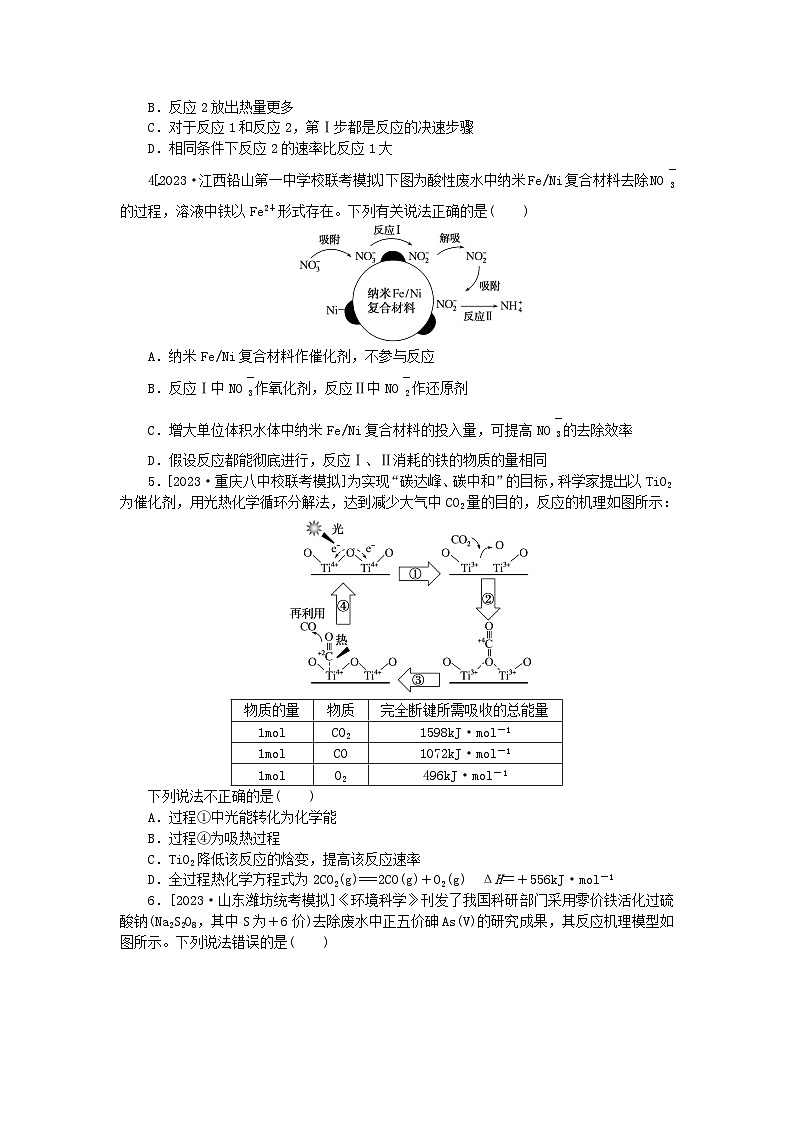
4.[2023·江西铅山第一中学校联考模拟]下图为酸性废水中纳米Fe/Ni复合材料去除NO eq \\al(\s\up1(-),\s\d1(3)) 的过程,溶液中铁以Fe2+形式存在。下列有关说法正确的是( )
A.纳米Fe/Ni复合材料作催化剂,不参与反应
B.反应Ⅰ中NO eq \\al(\s\up1(-),\s\d1(3)) 作氧化剂,反应Ⅱ中NO eq \\al(\s\up1(-),\s\d1(2)) 作还原剂
C.增大单位体积水体中纳米Fe/Ni复合材料的投入量,可提高NO eq \\al(\s\up1(-),\s\d1(3)) 的去除效率
D.假设反应都能彻底进行,反应Ⅰ、Ⅱ消耗的铁的物质的量相同
5.[2023·重庆八中校联考模拟]为实现“碳达峰、碳中和”的目标,科学家提出以TiO2为催化剂,用光热化学循环分解法,达到减少大气中CO2量的目的,反应的机理如图所示:
下列说法不正确的是( )
A.过程①中光能转化为化学能
B.过程④为吸热过程
C.TiO2降低该反应的焓变,提高该反应速率
D.全过程热化学方程式为2CO2(g)===2CO(g)+O2(g) ΔH=+556kJ·ml-1
6.[2023·山东潍坊统考模拟]《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中正五价砷As(V)的研究成果,其反应机理模型如图所示。下列说法错误的是( )
A.反应过程中有非极性键的断裂
B.溶液的pH越小,越有利于去除废水中的正五价砷
C.碱性条件下,硫酸根自由基发生的反应方程式为SO eq \\al(\s\up1(-),\s\d1(4)) ·+OH-===SO eq \\al(\s\up1(2-),\s\d1(4)) +·OH
D.反应过程中,存在反应S2O eq \\al(\s\up1(2-),\s\d1(8)) +Fe===Fe2++2SO eq \\al(\s\up1(2-),\s\d1(4))
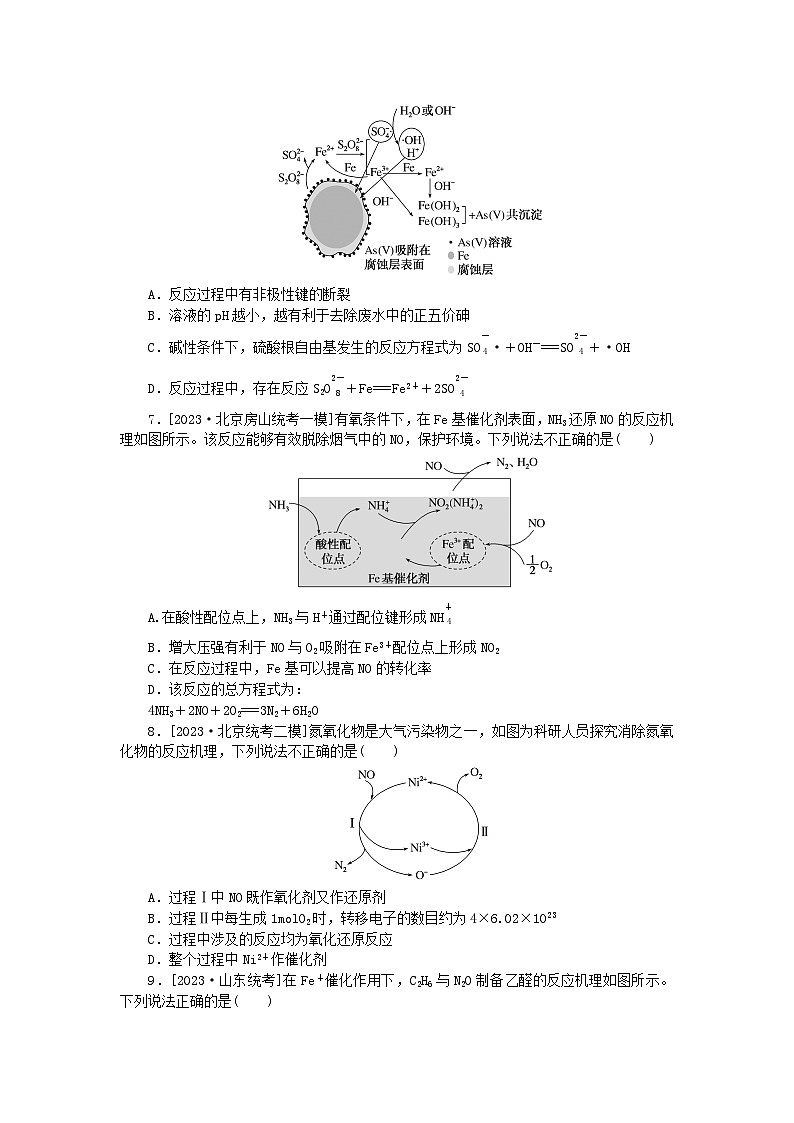
7.[2023·北京房山统考一模]有氧条件下,在Fe基催化剂表面,NH3还原NO的反应机理如图所示。该反应能够有效脱除烟气中的NO,保护环境。下列说法不正确的是( )
A.在酸性配位点上,NH3与H+通过配位键形成NH eq \\al(\s\up1(+),\s\d1(4))
B.增大压强有利于NO与O2吸附在Fe3+配位点上形成NO2
C.在反应过程中,Fe基可以提高NO的转化率
D.该反应的总方程式为:
4NH3+2NO+2O2===3N2+6H2O
8.[2023·北京统考二模]氮氧化物是大气污染物之一,如图为科研人员探究消除氮氧化物的反应机理,下列说法不正确的是( )
A.过程Ⅰ中NO既作氧化剂又作还原剂
B.过程Ⅱ中每生成1mlO2时,转移电子的数目约为4×6.02×1023
C.过程中涉及的反应均为氧化还原反应
D.整个过程中Ni2+作催化剂
9.[2023·山东统考]在Fe+催化作用下,C2H6与N2O制备乙醛的反应机理如图所示。下列说法正确的是( )
A.X为C2H5OH,是中间产物之一
B.过程①~⑥,Fe元素的化合价均发生了变化
C.增加Fe+的量,C2H6平衡转化率不变
D.每消耗1mlN2O,可制备0.5mlCH3CHO
10.[2023·河南统考模拟]在溶液中用光照射CuPHI催化剂产生光电子和空穴h+,可以在常温常压下使甲烷转化为甲醇和氢气,其部分反应机理如图所示。下列说法错误的是( )
A.空穴h+参与发生的反应为
2H2O+2h+===H2O2+2H+
B.光电子参与发生的反应为2H++2e-===H2
C.反应过程中水作还原剂
D.该反应的化学方程式为
CH4+H2Oeq \(=====,\s\up7(催化剂))CH3OH+H2
11.[2023·河北邢台统考一模]Fe氧簇MOF催化CH4与N2O反应的机理如图所示。下列说法错误的是( )
A.总反应方程式为CH4+N2Oeq \(=====,\s\up7(催化剂))CH3OH+N2
B.为该反应的催化剂
C.该反应中存在极性键的断裂和非极性键的形成
D.根据N2O分子的结构推测其电子式为:
∶eq \(N,\s\up6(··),\s\d4(··))∶∶eq \(N,\s\up6(··),\s\d4(··))∶∶eq \(O,\s\up6(··),\s\d4(··))∶
12.[2023·浙江宁波统考二模]一定条件下,CH3CH===CH2与HCl发生加成反应有①、②两种可能,反应进程中能量变化如图所示。下列说法中不正确的是( )
A.反应①、②焓变不同,与产物稳定性有关,与反应的中间状态无关
B.反应①、②均经过两步反应完成,对应的分步反应过程中均放出能量
C.其他条件不变,适当提高反应温度,可以提高产物中CH3CH2CH2Cl(g)的比例
D.相同条件下,CH3CHClCH3(g)的生成速率大于CH3CH2CH2Cl(g)
13.[2023·湖南衡阳校联考二模]中科院兰州化学物理研究所用Fe3(CO)12/ZSM5催化CO2加氢合成低碳烯烃反应,具有重要的意义。反应过程如图所示:
下列说法错误的是( )
A.第Ⅰ步的活化能高于第Ⅱ步的活化能
B.CO2加氢合成低碳烯烃反应中每一步均为氧化还原反应
C.工业上选择适合的催化剂,有利于提高C2H4的单位时间产率
D.该研究的应用有利于“碳中和”
14.[2023·湖南岳阳统考二模]催化丙烯制醛的反应机理如图所示。下列说法错误的是( )
A.该反应的催化剂为HC(CO)3
B.上述循环过程中,C的化学键数目发生了变化
C.若反应物为乙烯,产物一定为OHCCH2CH2CHO
D.总反应式为CH3CH===CH2+H2+COeq \(――→,\s\up7(催化剂))CH3CH2CH2CHO
15.[2023·吉林延边统考二模]铁的某种络合物离子(用[L-Fe-H]+表示)催化甲酸分解的反应机理及相对能量变化如图所示。下列说法正确的是( )
A.反应过程中铁元素价态没有改变
B.反应的决速步骤为Ⅱ转化为Ⅲ的过程
C.由到过程中形成了离子键
D.由图可知该反应的总反应式为:
HCOOHeq \(=====,\s\up7(催化剂))CO2+H2
[答题区]
1.[2023·浙江湖州、衢州、丽水三地市质检]甲烷与氯气在光照条件下发生取代反应的部分机理与能量变化如下:
链引发:Cl2(g)―→2Cl·(g) ΔH1=+242.7kJ·ml-1
链增长:部分反应进程与势能变化关系如图(所有物质状态为气态)……
链终止:Cl·(g)+CH3·(g)―→CH3Cl(g) ΔH2=-371kJ·ml-1
下列说法不正确的是( )
A.Cl2的键能为242.7kJ·ml-1
B.链增长中反应速率较快的一步的热化学方程式为:CH4(g)+Cl·(g)―→CH3·(g)+HCl(g) ΔH=+7.5kJ·ml-1
C.链增长过程中可能产生·CH2Cl,·CHCl2,·CCl3
D.链终止反应的过程中,还可能会生成少量的乙烷
2.[2023·辽宁葫芦二模]金属Ni可活化C2H6放出CH4,其反应历程如图所示:
下列关于活化历程的说法错误的是( )
A.中间体1→中间体2的过程是放热过程
B.加入催化剂可降低该反应的反应热,加快反应速率
C.Ni和C2H6的总键能小于NiCH2和CH4的总键能
D.中间体2→中间体3的过程是决定整个历程反应速率的关键步骤
3.[2023·辽宁部分学校模拟]我国某科研团队开发催化剂用于光热催化CO2加氢制CH4。其反应历程如图所示(*表示吸附在催化剂表面)。CH4的选择性等于CH4的物质的量与CO2转化的物质的量之比。下列叙述正确的是( )
A.在CO2→CH4历程中能垒最大为0.69eV
B.该反应历程中,CH4的选择性为100%
C.催化剂表面上CH4、CO脱附都会放出能量
D.反应历程中有极性键的断裂与形成
4.[2023·河北衡水部分重点高中二模]某研究团队提出了以氧化石墨烯(GO)为催化剂设计的简易膜反应,其反应为,反应过程中能量变化如图所示,下列说法中正确的是( )
A.反应中(除GO外)既有极性键和非极性键的断裂,又有极性键和非极性键的形成
B.分子中的碳原子均采用sp3杂化
C.催化剂可降低反应的活化能,从而改变反应的焓变
D.氧化石墨烯的作用之一可能是吸附反应物形成更稳定的反应中间体
5.[2023·湖北武汉武昌实验中学模拟]二氧化碳选择性加氢制甲醇是解决温室效应、发展绿色能源和实现经济可持续发展的重要途径之一。常温常压下利用铜基催化剂实现二氧化碳选择性加氢制甲醇的反应机理和能量变化图如下(其中吸附在催化剂表面上的粒子用*标注),下列说法错误的是( )
A.催化剂能改变反应机理,加快反应速率,降低反应热
B.二氧化碳选择性加氢制甲醇是放热反应
C.该历程的决速步为HCOO*+4H*===CH3O*+H2O
D.总反应为CO2(g)+3H2(g)===CH3OH(g)+H2O(g)
6.[2023·广东韶关一模]CO2的资源化利用有利于缓解温室效应并解决能源转化问题,一种以Fe3(CO)12/ZSM5催化CO2加氢(H2)合成低碳烯烃的反应过程如下图所示:
下列说法正确的是( )
A.决定整个反应快慢的是第ⅱ步
B.第ⅱ步反应过程中形成了非极性键
C.该反应总过程即CO2加氢合成低碳烯烃的原子利用率为100%
D.催化剂Fe3(CO)12/ZSM5的使用可以提高低碳烯烃的产率
7.[2023·辽宁抚顺重点高中六校协作体二模]某研究小组对CO2甲烷化的反应路径和机理进行了研究。经过研究发现ZrO2负载金属Rh催化CO2甲烷化可能存在的两种反应机理如图所示。下列说法中错误的是( )
A.机理①和机理②的不同点在于CO2的吸附、活化位置的不同
B.吸附在活性金属Rh表面的中间体CO,可能是由吸附在其表面的CO2直接解离产生的
C.同种催化剂,化学反应的途径不同,反应物的转化率也不同,反应的热效应也不同
D.反应中既有极性键的断裂和形成,又有非极性键的断裂
8.[2023·湖北部分市州统考一模]羟醛缩合反应是一种常用的增长碳链的方法。一种合成目标产物 (图中⑦)的反应机理如图所示。下列说法正确的是( )
A.③是该反应的催化剂
B.③到④的过程中有极性键的断裂和非极性键的生成
C.⑥中有1个手性碳原子
D.合成⑦的总反应为2
9.[2023·河北衡水二中三调检测]某科研团队制备高效催化剂Cu@C/SiO2并催化碳酸乙烯酯连续加氢反应的机理,如图所示。(已知:图片中Cu指铜元素,包括Cu2+、Cu+)
下列叙述错误的是( )
A.图1CO转化过程中既作氧化剂又作还原剂
B.图1中山梨醇中碳元素转化成C、CO、CO2
C.图2中1ml碳酸乙烯酯和2mlH2恰好完全反应生成HOCH2CH2OH和CH3OH
D.图2中Cu@C/SiO2能提高碳酸乙烯酯和H2反应的活化分子百分率
10.[2023·河北沧州统考二模]环氧丙烷(C3H6O,PO)是一种重要的有机化工产品,对Cu2O催化剂表面催化空气氧化丙烯反应机理的DFT计算表明,可能有通过分子氧(甲图)和晶格氧(乙图)两种反应机理(Ts代表中间态)。已知吸附能指在吸附过程中释放的能量,下列说法错误的是( )
A.C3H6在催化剂上的吸附能低于C3H6与O2共吸附在表面的吸附能
B.空气氧化丙烯生成环氧丙烷是放热反应
C.通过对图像的分析得出,该反应更易按照甲图路径进行
D.总反应方程式为2C3H6+O2eq \(=====,\s\up7(Cu2O))2C3H6O
11.[2023·福建福州统考二模]Ni活化C2H6的反应历程如下图所示:
下列说法错误的是( )
A.反应历程的决速步骤:中间体2→中间体3
B.反应历程涉及非极性键的断裂和极性键的形成
C.三种中间体比较,中间体2最稳定
D.升高温度,Ni+C2H6⇌NiCH2+CH4的化学平衡常数K增大
12.[2023·辽宁鞍山统考二模]L脯氨酸催化有机反应的机理如图所示(、分别表示向纸面内、向外伸展的共价键)。下列叙述错误的是( )
A.L脯氨酸的化学式为:C5H9NO2
B.过渡态中存在分子内氢键
C.若R≠H,则内盐中含有3个手性原子
13.[2023·安徽蚌埠统考二模]已知复杂反应的速率由反应历程中活化能最大的一步基元反应决定。卤代烃的取代反应有以下两种反应历程,其反应过程中的能量变化如图所示:
下列说法中错误的是( )
A.卤代烃的取代为放热反应
B.SN1反应速率与c(Nu:-)和c(R3CX)相关
C.SN2反应速率与c(RX)和c(Nu:-)相关
D.SN1机理为两步反应,SN2机理为一步反应
14.[2023·湖南校联考二模]2022年诺贝尔化学奖授予在“点击化学和生物正交化学”领域做出贡献的三位科学家。点击化学经典反应之一是一价铜[Cu]催化的叠氮化物-端炔烃环加成反应,反应机理示意如图:
下列说法正确的是( )
A.反应③过程中,不涉及极性键的断裂和形成
B.转化过程中N的杂化方式发生改变
C.该反应的总反应是取代反应,反应历程是离子反应历程
D.一价铜[Cu]催化剂能有效降低总反应的焓变,加快反应速率
15.[2023·江西上饶鄱阳一中校考一模]某反应可有效降低汽车尾气污染物的排放,一定条件下该反应经历三个基元反应阶段,反应历程如图所示(Ts表示过渡态)。下列说法正确的是( )
A.提高反应温度,反应物转化率增加
B.使用催化剂可以降低反应的活化能,提高活化分子百分数,提高反应物的转化率
C.该化学反应的速率主要由反应③决定
D.N2(g)+2CO2(g)===2CO(g)+2NO(g)
ΔH=+620.9kJ·ml-1
[答题区]
热点特训4 化学反应机理 循环图分析
1.答案:D
解析:根据反应过程示意图,过程Ⅰ、过程Ⅱ中都有水分子中O—H键的断裂,A正确;据题给热化学方程式可知该反应为放热反应,故该反应反应物总能量高于生成物总能量,B正确;催化剂能改变反应的活化能,但不能改变反应的ΔH,C正确;该催化过程中有极性键O—H键的断裂,极性键C===O键、非极性键H—H键的形成,没有非极性键的断裂,D错误。
2.答案:C
解析:Ts1与Ts2最终能量都低于起始能量,故两个过程均为放热反应,A错误;H2O2为第①步反应的产物,第②步反应的反应物参与反应,故H2O2不是催化剂,B错误;反应①为慢反应步骤,第一步反应需要更大的能量,第一步反应也比第二步反应慢得多,反应①的活化能大于反应②,C正确;加入催化剂的目的是降低Ts1的能量,因为①所需活化能高,整体反应速率由反应①决定,D错误。
3.答案:A
解析:反应2为该加成反应的主反应,可知反应2较易发生,则反应2的活化能应低于反应1,因此曲线b表示反应2的能量变化图,A错误;由图可知两反应的反应物能量相同,反应2即曲线b对应的产物能量更低,则放出的热量更多,B正确;由图可知第Ⅰ步反应的活化能大于第Ⅱ步反应活化能,活化能越大反应速率越慢,慢反应决定总反应速率,则第Ⅰ步都是反应的决速步骤,C正确;由图可知反应2的活化能低于反应1,因此相同条件下反应2的速率比反应1大,D正确。
4.答案:C
解析:因为NO eq \\al(\s\up1(-),\s\d1(3)) 被还原为NO eq \\al(\s\up1(-),\s\d1(2)) 、NH eq \\al(\s\up1(+),\s\d1(4)) ,所以纳米Fe作还原剂,参与反应,A错误;反应Ⅰ中NO eq \\al(\s\up1(-),\s\d1(3)) 作氧化剂,反应Ⅱ中NO eq \\al(\s\up1(-),\s\d1(2)) 被Fe还原为NH eq \\al(\s\up1(+),\s\d1(4)) ,作氧化剂,B错误;增大单位体积水体中纳米Fe/Ni复合材料的投入量,即增大其浓度,同时也增大反应物间的接触面积,可提高NO eq \\al(\s\up1(-),\s\d1(3)) 的去除效率,C正确;反应Ⅰ是硝酸根离子和铁反应生成亚硝酸根离子和亚铁离子,离子方程式为NO eq \\al(\s\up1(-),\s\d1(3)) +Fe+2H+===Fe2++NO eq \\al(\s\up1(-),\s\d1(2)) +H2O,反应Ⅱ的离子方程式为NO eq \\al(\s\up1(-),\s\d1(2)) +3Fe+8H+===3Fe2++NH eq \\al(\s\up1(+),\s\d1(4)) +2H2O,要使反应都能彻底进行,反应Ⅰ、Ⅱ消耗的铁的物质的量之比为1∶3,D错误。
5.答案:C
解析:以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,能量的变化形式是由光能转化为化学能,A正确;过程④需要从外界吸收热量,因此为吸热过程,B正确;TiO2作为催化剂可以降低该反应的活化能,无法降低焓变,提高该反应速率,C错误;CO2分解为CO和O2化学式为2CO2===2CO+O2,根据分子化学键完全断裂时的能量变化图可知,1mlCO2完全断裂应该吸收1598kJ,1mlCO完全断裂应该吸收1072kJ,1mlO2完全断裂应该吸收496kJ;所以1mlCO2分解产生1mlCO和0.5mlO2,所以需吸收1598-1072-496×0.5=278kJ能量,则全过程热化学方程式为2CO2(g)===2CO(g)+O2(g) ΔH=+556kJ·ml-1,D正确。
6.答案:B
解析:反应过程中存在过硫酸钠中的—O—O—的断裂,故有非极性键的断裂,A正确;H3AsO4为弱酸,溶液的pH越小,导致As以分子形式存在,反而不利于去除废水中的正五价砷,B错误;由图可知,碱性条件下,硫酸根自由基和氢氧根离子生成硫酸根离子和氢氧根自由基,发生的反应方程式为SO eq \\al(\s\up1(-),\s\d1(4)) ·+OH-===SO eq \\al(\s\up1(2-),\s\d1(4)) +·OH,C正确;反应过程中,在腐蚀层表面存在反应S2O eq \\al(\s\up1(2-),\s\d1(8)) +Fe===Fe2++2SO eq \\al(\s\up1(2-),\s\d1(4)) ,D正确。
7.答案:C
解析:NH3分子中的N原子还含有一对孤对电子,所以能和H+通过配位键形成NH eq \\al(\s\up1(+),\s\d1(4)) ,A正确;由图可知,NO与O2吸附在Fe3+配位点上形成NO2,该过程中气体体积减小,增大压强平衡正向移动,有利于NO与O2吸附在Fe3+配位点上形成NO2,B正确;在反应过程中,Fe基作为催化剂,催化剂不能改变反应的转化率,C错误;由图可知,在Fe基催化剂表面,NH3还原NO生成N2和H2O,总方程式为:4NH3+2NO+2O2===3N2+6H2O,D正确。
8.答案:B
解析:由图可知,过程Ⅰ发生的反应为2Ni2++2NO===2Ni3++2O-+N2,过程Ⅱ发生的反应为2Ni3++2O-===2Ni2++O2↑,总反应为2NOeq \(=====,\s\up7(Ni2+))O2+N2。由分析可知,过程Ⅰ发生的反应为2Ni2++2NO===2Ni3++2O-+N2,反应中氮元素的化合价降低被还原,氧元素的化合价升高被氧化,则一氧化氮既作反应的氧化剂又作反应的还原剂,A正确;由分析可知,过程Ⅱ发生的反应为2Ni3++2O-===2Ni2++O2↑,则过程Ⅱ中每生成1mlO2时,转移电子的数目约为2×6.02×1023,B错误;由分析可知,过程Ⅰ和过程Ⅱ涉及的反应均有元素发生化合价变化,均为氧化还原反应,C正确;由分析可知,消除氮氧化物的总反应为2NOeq \(=====,\s\up7(Ni2+))O2+N2,整个过程中镍离子作反应的催化剂,D正确。
9.答案:C
解析:根据反应机理图示,C2H6、N2O是反应物,N2、H2O、CH3CHO、X是生成物,其余为中间产物。根据反应③,X为CH3CH2OH,是生成物,A错误;根据反应③④,涉及的中间产物中Fe元素化合价相同,B错误;Fe+是催化剂,增加Fe+的量时,实质是增加催化剂的量,催化剂只改变反应速率,不改变反应物的平衡转化率,C正确;反应③显示其是制备过程的副反应,会生成X(乙醇),因此每消耗1mlN2O,制备不了0.5mlCH3CHO,D错误。
10.答案:C
解析:根据图中信息,空穴h+与水反应,其参与发生的反应为2H2O+2h+===H2O2+2H+,A正确;氢离子得到光电子提供的电子,则参与发生的反应为2H++2e-===H2,B正确;该反应的化学方程式为CH4+H2Oeq \(=====,\s\up7(催化剂))CH3OH+H2,水中氢化合价降低,则反应过程中水作氧化剂,C错误;根据图中信息常温常压下使甲烷和水转化为甲醇和氢气,则该反应的化学方程式为CH4+H2Oeq \(=====,\s\up7(催化剂))CH3OH+H2,D正确。
11.答案:D
解析:根据图中信息得到总反应方程式为CH4+N2Oeq \(=====,\s\up7(催化剂))CH3OH+N2,A正确;开始时和N2O反应生成中间体,因此为该反应的催化剂,B正确;该反应中存在碳氢极性键的断裂,氮氮非极性键的形成,C正确;根据N2O分子的结构推测其电子式为:eq \(N,\s\up6(··),\s\d4(··))∶∶eq \(N,\s\up6(··),\s\d4(··))∶∶eq \(O,\s\up6(··),\s\d4(··)),D错误。
12.答案:B
解析:焓变在给定反应中,只与始态和终态有关,与中间状态无关,根据图像可知,该反应为放热反应,放出热量越多,产物能量越低,该物质越稳定,A正确;根据图像可知,反应①、②的第一步都是产物能量高于反应物,即第一步为吸收热量,B错误;CH3CH2CH2Cl(g)⇌CH3CHClCH3(g),该反应为放热反应,升高温度,平衡逆向进行,可以提高CH3CH2CH2Cl(g)的比例,C正确;反应②的活化能比反应①的活化能低,化学反应速率快,因此相同条件下,CH3CHClCH3(g)的生成速率大于CH3CH2CH2Cl(g),D正确。
13.答案:B
解析:第Ⅰ步为慢反应,第Ⅱ步为快反应,根据活化能越小反应速率越大的特点,第Ⅰ步的活化能高于第Ⅱ步的活化能,A正确;在(CH2)n低聚化异构化反应时,元素的化合价没有发生变化,是非氧化还原反应,B错误;催化剂除了高效性,还有选择性,适合的催化剂有利于提高某一产品的单位时间产率,C正确;该研究的应用有利于降低空气中CO2的排放,有利于“碳中和”,D正确。
14.答案:C
解析:由图可知,该反应的催化剂为HC(CO)3,A正确;由图可知,上述循环过程中,C的化学键数目发生了变化,B正确;若反应物为乙烯,根据机理,存在方程式:CH2===CH2+H2+COeq \(――→,\s\up7(催化剂))CH3CH2CHO,则产物为CH3CH2CHO,C错误;由图可知,反应物有丙烯、氢气和CO,生成物有CH3CH2CH2CHO,则总反应式为CH3CH===CH2+H2+COeq \(――→,\s\up7(催化剂))CH3CH2CH2CHO,D正确。
15.答案:D
解析:由图可知,过程中铁元素化合价降低,A错误;由图可知,Ⅳ转化为Ⅴ的过程E正最大,反应速率最慢,为反应的决速步骤,B错误;过程中氢原子之间形成共价键,无离子键形成,C错误;由图可知该反应的总反应式为:HCOOHeq \(=====,\s\up7(催化剂))CO2+H2,D正确。
高分必刷
1.答案:B
解析:根据Cl2(g)―→2Cl·(g),ΔH1=+242.7kJ·ml-1可知,Cl2的键能为242.7kJ·ml-1,A正确;反应速率较快的一步应该是活化能较低的一步,由图可知,反应速率较快的一步的热化学方程式为:CH3·+Cl2(g)―→CH3Cl(g)+Cl·,B错误;由图可知,链增长中碳上的氢原子可能失去,故链增长过程中可能产生·CH2Cl,·CHCl2,·CCl3,C正确;链终止反应的过程中,两个CH3·结合在一起可以形成乙烷,D正确。
2.答案:B
解析:中间体1的相对能量为-56.21,中间体2的相对能量为-154.82,中间体1→中间体2的过程是放热过程,A正确;催化剂不能改变反应物和生成物的能量,加入催化剂,该反应的反应热不变,B错误;Ni和C2H6的相对总能量为0,NiCH2和CH4的相对总能量为-6.57,正反应放热,Ni和C2H6总键能小于NiCH2和CH4的总键能,C正确;慢反应决定总反应速率,中间体2→中间体3的过程正反应活化能最大,反应速率最慢,所以中间体2→中间体3的过程是决定整个历程反应速率的关键步骤,D正确。
3.答案:D
解析:由图可知,在CO2→CH4历程中能垒最大的是*CO2→*HCOO的能垒为0.77eV,A错误;CO2加氢生成了副产物CO、CH3OH、CH4的选择性小于100%,B错误;由图可知,*CO2→CO(g)是脱附过程,需要吸收能量,C错误;反应历程中*CO2→CO(g)过程中有极性键的断裂,*H3CO→*H3COH过程中有极性键的生成,D正确。
4.答案:D
解析:反应中没有非极性键的断裂,A错误;分子中,C原子的杂化方式有sp、sp2、sp3,B错误;催化剂可以降低反应的活化能,不可以改变反应的焓变,C错误;由图中信息可知,氧化石墨烯可吸附反应物形成更稳定的反应中间体,利于反应进行,D正确。
5.答案:A
解析:催化剂能改变反应机理,加快反应速率,不能改变反应热,A错误;由反应历程图可知反应物的总能量大于生成物的总能量,该反应为放热反应,B正确;HCOO*+4H*===CH3O*+H2O的活化能最大,是该历程的决速步,C正确;该反应的反应物是CO2和H2,生成物是CH3OH和H2O,则总反应为CO2(g)+3H2(g)===CH3OH(g)+H2O(g),D正确。
6.答案:B
解析:速率较慢的反应决定了整个反应的快慢,故决定整个反应快慢的是第ⅰ步,A错误;异构化反应过程中,(CH2)n转化为C3H6、C2H4、C4H8等,该过程中形成了极性键和非极性键,B正确;根据质量守恒定律可知,该反应的总过程为CO2和H2反应生成低碳烯烃和水的过程,则该反应总过程的原子利用率小于100%,C错误;Fe3(CO)12/ZSM5是催化剂,不影响CO2加氢合成低碳烯烃的产率,D错误。
7.答案:C
解析:根据示意图中第一步反应可判断机理①和机理②的不同点在于CO2的吸附、活化位置的不同,A正确;根据机理①可判断吸附在活性金属Rh表面的中间体CO,是由吸附在其表面的CO2直接解离产生的,B正确;同种催化剂,化学反应的途径不同,反应物的平衡转化率和反应的热效应是相同的,C错误;二氧化碳中含有极性键,水中含有极性键,氢气中含有非极性键,所以反应中既有极性键的断裂和形成,又有非极性键的断裂,D正确。
8.答案:B
解析:③是第一步反应的产物,第二个反应的反应物,所以③只是该反应的中间产物,不是该反应的催化剂,A错误;③到④的过程中,有C—N极性键的断裂和C—C非极性键的生成,B正确;⑥中有2个手性碳原子,如图,C错误;合成⑦的总反应为,D错误。
9.答案:C
解析:由图可知,图1中一氧化碳反应生成二氧化碳和碳单质,碳元素化合价有升高也有降低,故CO转化过程中既作氧化剂又作还原剂,A正确;由图可知,图1中山梨醇中碳元素转化成二氧化碳和一氧化碳,部分一氧化碳又转化为碳和二氧化碳,B正确;图2中1ml碳酸乙烯酯和3mlH2恰好完全反应生成HOCH2CH2OH和CH3OH,C错误;图2中Cu@C/SiO2作为催化剂,能降低反应的活化能,提高碳酸乙烯酯和H2反应的活化分子百分率,加快反应速率,D正确。
10.答案:A
解析:对比甲图和乙图中①和②的变化可知,C3H6在催化剂上的吸附能高于C3H6与O2共吸附在表面的吸附能,A错误;由甲图和乙图可知空气氧化丙烯生成环氧丙烷是放热反应,B正确;由甲图和乙图可知,甲图中②到Ts1的吸收的能量较低,更容易发生反应,C正确;由甲图和乙图可知,总反应方程式为2C3H6+O2eq \(=====,\s\up7(Cu2O))2C3H6O,D正确。
11.答案:D
解析:活化能越大,速率越慢,慢反应为决速步骤,故反应历程的决速步骤:中间体2→中间体3,A正确;中间体2→过渡态2涉及C—C非极性键断裂,Ni(s)→中间体1,中间体2→过渡态2,过渡态2→中间体3,均涉及极性键的形成,B正确;三种中间体比较,中间体2能量最低,最稳定,C正确;Ni(s)+C2H6(g)的总能量比NiCH2+CH4高6.57kJ,该反应为放热反应,升高温度,Ni+C2H6⇌NiCH2+CH4的化学平衡常数K减小,D错误。
12.答案:C
解析:由结构简式可知L脯氨酸的化学式为:C5H9NO2,A正确;由结构可知羧基中的H与N原子以及羟基中O原子均形成氢键,B正确;若R≠H,由结构可知两个羟基所连碳原子以及羧基所连碳为手性碳原子,同时N原子也与四个不同原子或原子团连接,也为手性原子,因此共有4个手性原子,C错误;由图可知该过程中丙酮与RCHO在L脯氨酸催化作用下最终转化为,D正确。
13.答案:B
解析:卤代烃的取代反应中生成物能量低于反应物,该反应为放热反应,A正确;SN1为单分子亲核取代反应,反应物先解离为碳正离子与带负电荷的离去基团,这个过程的活化能大,决定反应速率,所以SN1反应速率只和c(R3CX)相关,B错误;SN2反应为双分子亲核取代反应,只有一个阶段,其反应速率与c(RX)和c(Nu:-)相关,C正确;SN1反应是两步反应,第一步是反应物在溶剂中离解成为碳正离子和由离去基团形成的负离子(慢反应),第二步是碳正离子与X-结合(快反应)。SN2反应中R—X的断裂与新的R—Nu键的形成是同时的,为一步反应,D正确。
14.答案:B
解析:由图可知,反应③过程中,涉及碳氮极性键的形成,A错误;三键氮原子的杂化方式为sp杂化、双键氮原子的杂化方式为sp2杂化,所以转化过程中氮原子的杂化方式发生改变,B正确;由题意可知,该反应的总反应是一价铜催化的叠氮化物-端炔烃环加成反应,C错误;催化剂能降低反应的活化能,但不能改变反应的焓变,D错误。
15.答案:D
解析:由图可知,该过程的总反应为2CO+2NO===N2+2CO2,根据盖斯定律可知,反应①+反应②+反应③=总反应,因此ΔH=+199.2kJ·ml-1+(-513.5kJ·ml-1)+(-306.6kJ·ml-1)=-620.9kJ·ml-1,即总反应的热化学方程式为:2CO(g)+2NO(g)===N2(g)+2CO2(g) ΔH=-620.9kJ·ml-1,总反应为放热反应,提高反应温度,平衡逆移,反应物转化率降低,A错误;一般使用催化剂可以降低反应的活化能,部分非活化分子变为活化分子,则增大活化分子百分数,增大活化分子有效碰撞几率,加快化学反应速率,但不影响平衡移动,所以不能提高反应物的平衡转化率,B错误;由图可知,正反应活化能最大的是①,活化能越大,反应速率越慢,整个反应是由最慢的一步决定的,则该化学反应的速率主要由反应①决定,C错误;由图可知,该过程的总反应为2CO+2NO===N2+2CO2,根据盖斯定律可知,反应①+反应②+反应③=总反应,因此ΔH=+199.2kJ·ml-1+(-513.5kJ·ml-1)+(-306.6kJ·ml-1)=-620.9kJ·ml-1,即总反应的热化学方程式为:2CO(g)+2NO(g)===N2(g)+2CO2(g) ΔH=-620.9kJ·ml-1,因此N2(g)+2CO2(g)===2CO(g)+2NO(g) ΔH=+620.9kJ·ml-1,D正确。
物质的量
物质
完全断键所需吸收的总能量
1ml
CO2
1598kJ·ml-1
1ml
CO
1072kJ·ml-1
1ml
O2
496kJ·ml-1
题号
1
2
3
4
5
6
7
8
答案
题号
9
10
11
12
13
14
15
答案
题号
1
2
3
4
5
6
7
8
答案
题号
9
10
11
12
13
14
15
答案
相关试卷
这是一份新教材2024届高考化学二轮专项分层特训卷第二部分常考热点特训5分子结构晶体结构分析(附解析),共13页。
这是一份新教材2024届高考化学二轮专项分层特训卷第二部分常考热点特训10有机合成路线设计(附解析),共25页。
这是一份新教材2024届高考化学二轮专项分层特训卷第二部分常考热点特训8各种平衡常数的计算(附解析),共13页。








