所属成套资源:新教材2024届高考化学二轮专项分层特训卷多份(附解析)
新教材2024届高考化学二轮专项分层特训卷第二部分常考热点特训8各种平衡常数的计算(附解析)
展开
这是一份新教材2024届高考化学二轮专项分层特训卷第二部分常考热点特训8各种平衡常数的计算(附解析),共13页。
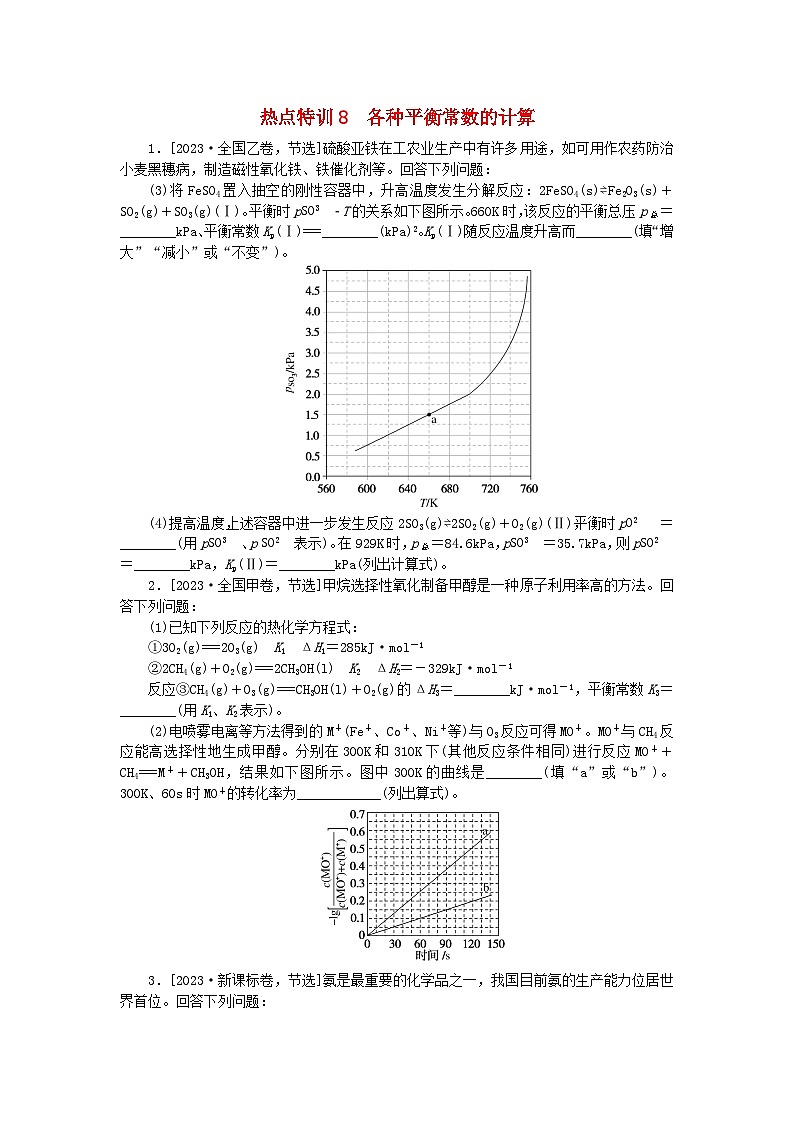
(3)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:2FeSO4(s)⇌Fe2O3(s)+SO2(g)+SO3(g)(Ⅰ)。平衡时peq \a\vs4\al(SO3)T的关系如下图所示。660K时,该反应的平衡总压p总=________kPa、平衡常数Kp(Ⅰ)===________(kPa)2。Kp(Ⅰ)随反应温度升高而________(填“增大”“减小”或“不变”)。
(4)提高温度,上述容器中进一步发生反应2SO3(g)⇌2SO2(g)+O2(g)(Ⅱ),平衡时peq \a\vs4\al(O2)=________(用peq \a\vs4\al(SO3)、peq \a\vs4\al(SO2)表示)。在929K时,p总=84.6kPa,peq \a\vs4\al(SO3)=35.7kPa,则peq \a\vs4\al(SO2)=________kPa,Kp(Ⅱ)=________kPa(列出计算式)。
2.[2023·全国甲卷,节选]甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
(1)已知下列反应的热化学方程式:
①3O2(g)===2O3(g) K1 ΔH1=285kJ·ml-1
②2CH4(g)+O2(g)===2CH3OH(l) K2 ΔH2=-329kJ·ml-1
反应③CH4(g)+O3(g)===CH3OH(l)+O2(g)的ΔH3=________kJ·ml-1,平衡常数K3=________(用K1、K2表示)。
(2)电喷雾电离等方法得到的M+(Fe+、C+、Ni+等)与O3反应可得MO+。MO+与CH4反应能高选择性地生成甲醇。分别在300K和310K下(其他反应条件相同)进行反应MO++CH4===M++CH3OH,结果如下图所示。图中300K的曲线是________(填“a”或“b”)。300K、60s时MO+的转化率为____________(列出算式)。
3.[2023·新课标卷,节选]氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
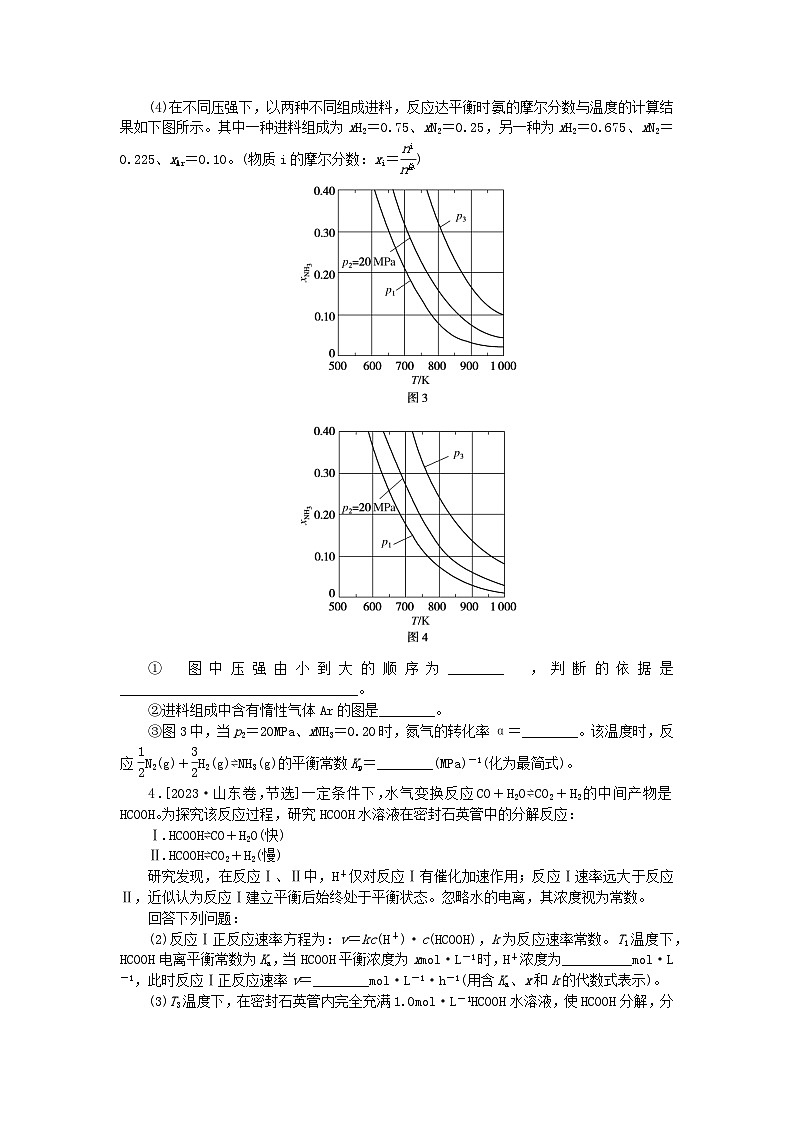
(4)在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为xH2=0.75、xN2=0.25,另一种为xH2=0.675、xN2=0.225、xAr=0.10。(物质i的摩尔分数:xi=eq \f(ni,n总))
①图中压强由小到大的顺序为________,判断的依据是__________________________________。
②进料组成中含有惰性气体Ar的图是________。
③图3中,当p2=20MPa、xNH3=0.20时,氮气的转化率α=________。该温度时,反应eq \f(1,2)N2(g)+eq \f(3,2)H2(g)⇌NH3(g)的平衡常数Kp=________(MPa)-1(化为最简式)。
4.[2023·山东卷,节选]一定条件下,水气变换反应CO+H2O⇌CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:
Ⅰ.HCOOH⇌CO+H2O(快)
Ⅱ.HCOOH⇌CO2+H2(慢)
研究发现,在反应Ⅰ、Ⅱ中,H+仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。
回答下列问题:
(2)反应Ⅰ正反应速率方程为:v=kc(H+)·c(HCOOH),k为反应速率常数。T1温度下,HCOOH电离平衡常数为Ka,当HCOOH平衡浓度为xml·L-1时,H+浓度为__________ml·L-1,此时反应Ⅰ正反应速率v=________ml·L-1·h-1(用含Ka、x和k的代数式表示)。
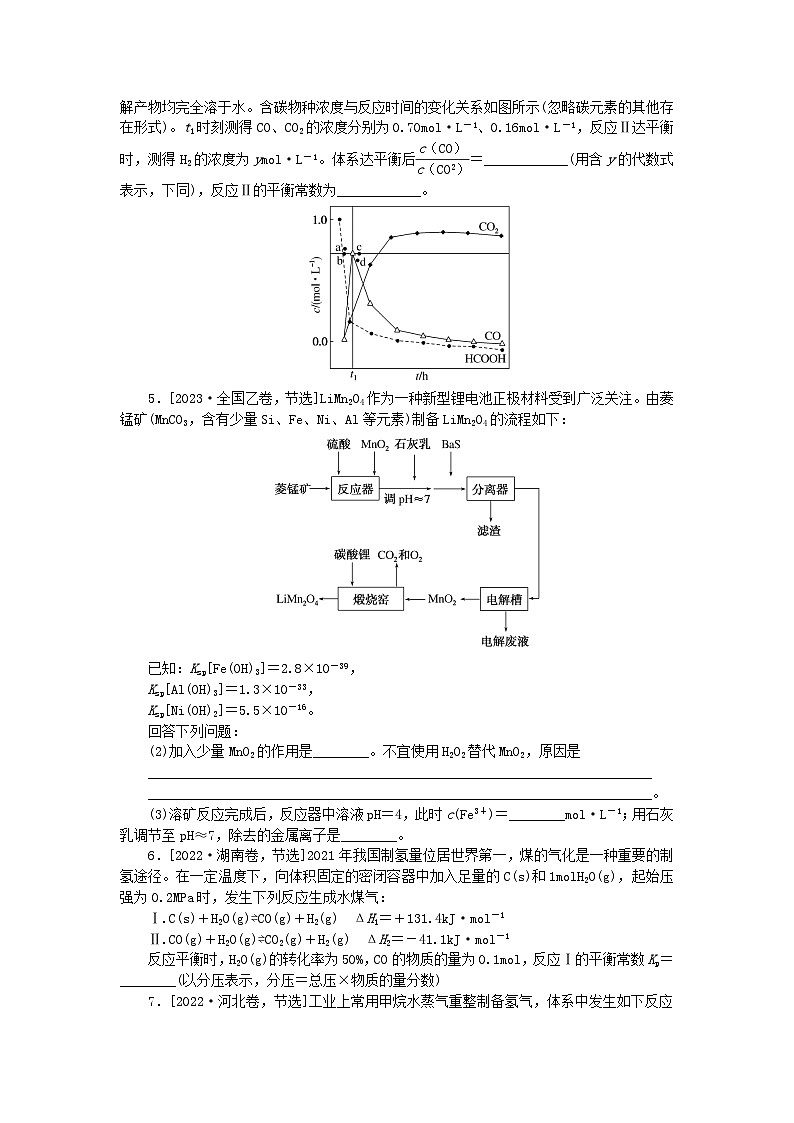
(3)T3温度下,在密封石英管内完全充满1.0ml·L-1HCOOH水溶液,使HCOOH分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。t1时刻测得CO、CO2的浓度分别为0.70ml·L-1、0.16ml·L-1,反应Ⅱ达平衡时,测得H2的浓度为yml·L-1。体系达平衡后eq \f(c(CO),c(CO2))=____________(用含y的代数式表示,下同),反应Ⅱ的平衡常数为____________。
5.[2023·全国乙卷,节选]LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3,含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如下:
已知:Ksp[Fe(OH)3]=2.8×10-39,
Ksp[Al(OH)3]=1.3×10-33,
Ksp[Ni(OH)2]=5.5×10-16。
回答下列问题:
(2)加入少量MnO2的作用是________。不宜使用H2O2替代MnO2,原因是
________________________________________________________________________
________________________________________________________________________。
(3)溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)=________ml·L-1;用石灰乳调节至pH≈7,除去的金属离子是________。
6.[2022·湖南卷,节选]2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。在一定温度下,向体积固定的密闭容器中加入足量的C(s)和1mlH2O(g),起始压强为0.2MPa时,发生下列反应生成水煤气:
Ⅰ.C(s)+H2O(g)⇌CO(g)+H2(g) ΔH1=+131.4kJ·ml-1
Ⅱ.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2=-41.1kJ·ml-1
反应平衡时,H2O(g)的转化率为50%,CO的物质的量为0.1ml,反应Ⅰ的平衡常数Kp=________(以分压表示,分压=总压×物质的量分数)
7.[2022·河北卷,节选]工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应
Ⅰ.CH4(g)+H2O(g)⇌CO(g)+3H2(g)
Ⅱ.CO(g)+H2O(g)⇌CO2(g)+H2(g)
(1)下列操作中,能提高CH4(g)平衡转化率的是________;
A.增加CH4(g)用量
B.恒温恒压下通入惰性气体
C.移除CO(g)
D.加入催化剂
(2)恒温恒压条件下,1mlCH4(g)和1mlH2O(g)反应达平衡时,CH4(g)的转化率为a,CO2(g)的物质的量为bml,则反应Ⅰ的平衡常数Kx=________________ (写出含有a、b的计算式;对于反应mA(g)+nB(g)⇌pC(g)+qD(g),Kx=eq \f(xp(C)·xq(D),xm(A)·xn(B)),x为物质的量分数)。其他条件不变,H2O(g)起始量增加到5ml,达平衡时,a=0.90,b=0.65,平衡体系中H2(g)的物质的量分数为________(结果保留两位有效数字)。
1.[2021·湖南卷,节选]某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1mlNH3通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
(1)若保持容器容积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=________ml·L-1·min-1(用含t1的代数式表示)
(2)在该温度下,反应的标准平衡常数Kθ=________[已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g)⇌gG(g)+hH(g) Kθ=eq \f((\f(pG,pθ))g·(\f(pH,pθ))h,(\f(pD,pθ))d·(\f(pE,pθ))e),其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压]
2.[2021·河北卷,节选](1)雨水中含有来自大气的CO2,溶于水中的CO2进一步和水反应,发生电离:
①CO2(g)⇌CO2(aq)
②CO2(aq)+H2O(l)⇌H+(aq)+HCO eq \\al(\s\up1(-),\s\d1(3)) (aq)
25℃时,反应②的平衡常数为K2。
溶液中CO2的浓度与其在空气中的分压成正比(分压=总压×物质的量分数),比例系数为yml·L-1·kPa-1,当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为________ml·L-1(写出表达式,考虑水的电离,忽略HCO eq \\al(\s\up1(-),\s\d1(3)) 的电离)。
(2)105℃时,将足量的某碳酸氢盐(MHCO3)固体置于真空恒容容器中,存在如下平衡:
上述反应达平衡时体系的总压为46kPa。
保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于________________kPa。
3.[2021·广东省,节选]我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
(a)CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ΔH1
(b)CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2
(c)CH4(g)⇌C(s)+2H2(g) ΔH3
(d)2CO(g)⇌CO2(g)+C(s) ΔH4
(e)CO(g)+H2(g)⇌H2O(g)+C(s) ΔH5
设K eq \\al(\s\up1(r),\s\d1(p)) 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa),反应a、c、e的lnK eq \\al(\s\up1(r),\s\d1(p)) 随eq \f(1,T)(温度的倒数)的变化如图所示
(1)反应a、c、e中,属于吸热反应的有________(填字母)。
(2)反应c的相对压力平衡常数表达式为K eq \\al(\s\up1(r),\s\d1(p)) =________。
(3)在图中A点对应温度下、原料组成为n(CO2)∶n(CH4)=1∶1、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时H2的分压为40kPa。计算CH4的平衡转化率,写出计算过程。
4.Bdensteins研究了下列反应:2HI(g)⇌H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正=0.0027min-1,在t=40min时,v正=________min-1。
5.已知:N2(g)+3H2(g)⇌2NH3(g) ΔH
相关试卷
这是一份新教材2024届高考化学二轮专项分层特训卷第二部分常考热点特训5分子结构晶体结构分析(附解析),共13页。
这是一份新教材2024届高考化学二轮专项分层特训卷第二部分常考热点特训10有机合成路线设计(附解析),共25页。
这是一份新教材2024届高考化学二轮专项分层特训卷第二部分常考热点特训6陌生有机物的结构与性质(附解析),共13页。








