



所属成套资源:高二上学期期末考试化学试题(含答案解析)
天津市南开区南开中学2021-2022学年高二上学期期末检测化学试题(含答案解析)
展开
这是一份天津市南开区南开中学2021-2022学年高二上学期期末检测化学试题(含答案解析),文件包含精品解析天津市南开区南开中学2021-2022学年高二上学期期末检测化学试题原卷版docx、精品解析天津市南开区南开中学2021-2022学年高二上学期期末检测化学试题解析版docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。
Ⅰ卷(共54分)
一、选择题(每小题只有1个正确选项,每小题3分,共54分)
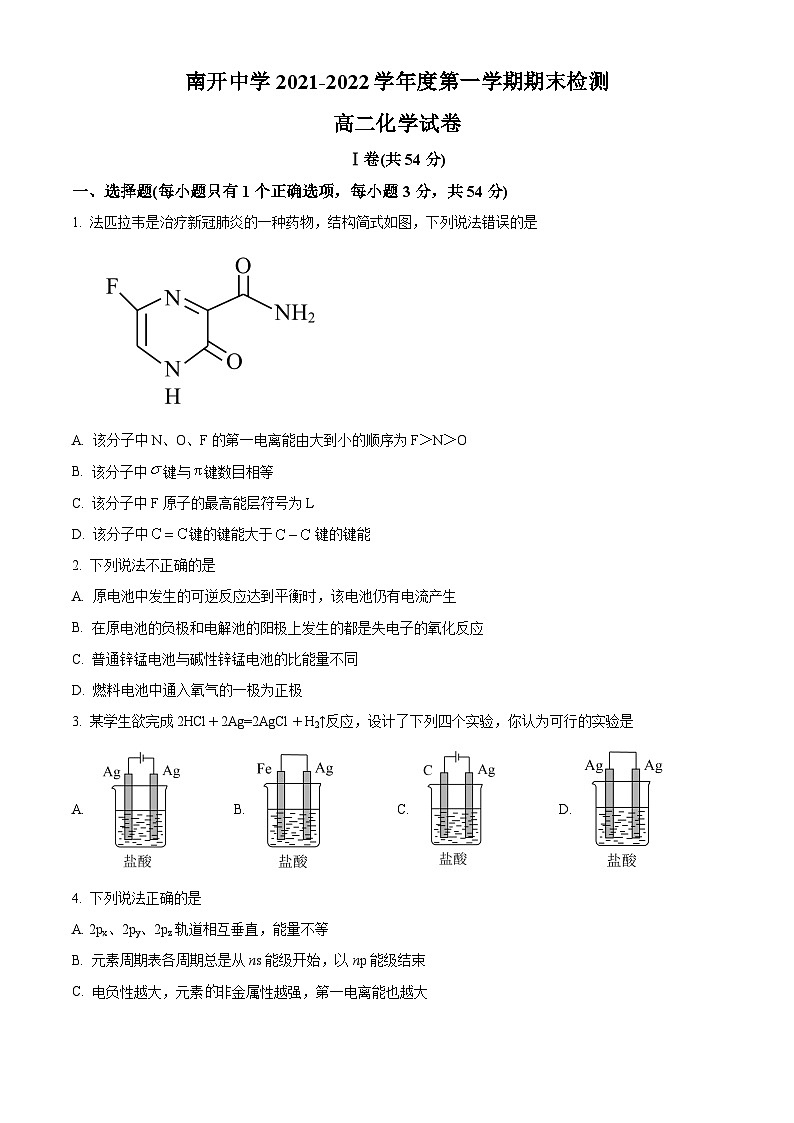
1. 法匹拉韦是治疗新冠肺炎的一种药物,结构简式如图,下列说法错误的是
A. 该分子中N、O、F的第一电离能由大到小的顺序为F>N>O
B. 该分子中键与键数目相等
C. 该分子中F原子的最高能层符号为L
D. 该分子中键的键能大于键的键能
2. 下列说法不正确的是
A. 原电池中发生的可逆反应达到平衡时,该电池仍有电流产生
B. 在原电池的负极和电解池的阳极上发生的都是失电子的氧化反应
C. 普通锌锰电池与碱性锌锰电池的比能量不同
D. 燃料电池中通入氧气的一极为正极
3. 某学生欲完成2HCl+2Ag=2AgCl+H2↑反应,设计了下列四个实验,你认为可行的实验是
A. B. C. D.
4. 下列说法正确的是
A. 2px、2py、2pz轨道相互垂直,能量不等
B. 元素周期表各周期总是从ns能级开始,以np能级结束
C. 电负性越大,元素非金属性越强,第一电离能也越大
D. d区、ds区全部是金属元素
5. 下列有关说法正确的是
A. 电解法精炼铜时,以粗铜作阴极,纯铜作阳极
B. 一定温度下向恒容密闭容器中充入和,当反应到达平衡时,容器中、、的物质的量之比一定为2∶1∶2
C. 常温下,向溶液中加入少量浓盐酸,溶液中的值增大
D. 反应的可通过下式估算:产物的键能之和-反应物的键能之和
6. 如图所示的装置,通电一段时间后,测得甲池中某电极质量增加,乙池中某电极上析出某金属。下列说法正确的是
A. 某盐溶液可能是溶液B. 某盐溶液可能是溶液
C. 甲池中b电极上析出金属银D. 乙池中d电极上析出某金属
7. 下列说法不正确的是
A. 从空间角度看,2s轨道比1s轨道大,其空间包含了1s轨道
B. s-s键与s-p键的电子云形状的对称性相同
C. 电负性大于1.8的为非金属,小于1.8的为金属
D. 共价键是原子间通过共用电子对所形成的相互作用
8. 下列说法正确的是
A. 如图所示为向10mL一定浓度的HCl溶液中滴加NaOH溶液时,所得室温下溶液pH随NaOH溶液体积的变化,由图可知
B. 用石墨电极电解熔融,可得到金属铝
C. 由方程式 可知甲烷的燃烧热为
D. 用惰性电极电解硫酸铜溶液一段时间后,溶液酸性增强,向其中加入CuO、、均可使其恢复到原状态
9. MFC-电芬顿技术通过产生羟基自由基处理有机污染物,可获得高效的废水净化效果,其原理示意图如图,下列说法错误的是
A. 甲池中移动方向从M室到N室
B. 电子移动方向为a→Y,X→b
C. 乙池中的能量转化为化学能转化为电能
D. Y电极上得到双氧水的反应为
10. 下列说法正确的是
A. 反应 ,若正反应的活化能为,逆反应的活化能为,且,则正反应放热
B. 若在海轮钢制外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
C. 将的溶液与的NaOH溶液等体积混合后,溶液中有关粒子的浓度满足下列关系:
D. 常温下,将浓度为溶液加水不断稀释过程中,变小
11. 下列各项叙述中,正确的是
A. 在同一电子层上运动的电子,其自旋状态肯定不同
B. 基态原子的价电子排布为的元素的族序数一定为
C. 镁原子由时,原子释放能量,光谱仪摄取到吸收光谱
D. 硅原子有14种不同运动状态的电子
12. 短周期主族元素X、Y、Z、W原子序数依次增大,X原子核外有7个电子,基态Y原子无未成对电子,Z与X为同族元素,W最高价含氧酸为二元酸,下列说法正确的是
A. 原子半径:
B. 元素Y、W的简单离子具有相同的电子层结构
C. Z的最高价氧化物对应水化物的酸性比X的强
D. 电负性大小:Y<Z<W
13. 铅酸蓄电池、镍镉碱性电池都是重要的二次电池。已知镍镉碱性电池放电时,正极反应为:,负极反应为:。下列有关说法不正确的是
A. 铅酸蓄电池放电时,在两个电极上生成
B. 若用铅酸蓄电池为镍镉碱性电池充电,则电极与Cd电极相连接且两电极附近的pH值均增大
C. 镍镉碱性电池在充电时的反应为
D. 放电一段时间后镍镉碱性电池内变大
14. 常温下,某一元酸(HA)溶液的,下列叙述正确的是
A. 该溶液中由水电离出的
B. 常温下,由的HA与的NaOH溶液等体积混合,溶液中
C. 浓度均为的HA和NaA溶液等体积混合,若溶液呈酸性,则
D. 用已知浓度NaOH溶液滴定未知浓度HA溶液,宜选择酚酞做指示剂
15. 下列实验操作、实验现象、解释或结论都正确且有因果关系的是
A AB. BC. CD. D
16. 电有机合成反应温和高效,体系简单,环境友好。电解合成1,2-二氯乙烷的实验装置如图所示。下列说法中不正确的是
A. 该装置工作时,NaCl溶液的浓度不断减小
B. 液相反应中,转变为1,2-二氯乙烷的同时,CuCl转变为
C. 该装置总反应为
D. 离子交换膜X、Y分别为阴离子交换膜、阳离子交换膜
17. 一定温度下,向1.0L恒容密闭容器中充入2 ml SO2和1 ml O2发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
下列说法正确的是
A. 4 s内反应的平均速率v(O2)=0.35 ml· L-1·s-1
B. 该反应的平衡常数K=810
C. 保持温度不变,向容器中再充入2 ml SO2、1 ml O2,反应的平衡常数增大
D. 此温度下,若该容器中有0.1 ml SO2、0.5 ml O2和0.8 ml SO3,则反应逆向进行
18. 钠离子电池具有资源丰富、成本低、安全性好、转换效率高等特点,有望成为锂离子电池之后的新型首选电池,如图是一种钠离子电池工作示意图,下列说法中错误的是
A 放电时,通过交换膜向N极移动
B. 充电时,光照可促进电子的转移
C. 充电时,光电极上发生的电极反应为
D. 放电时,若负极室有3ml阴离子发生反应,则电路中转移2ml电子
Ⅱ卷(共46分)
二、填空题
19. A、B、C、D、E、F、G元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请用化学用语回答下列问题。
(1)写出元素符号A:___________B:___________G___________,写出元素B的基态原子的轨道表示式:___________。
(2)C、D、E三种元素的原子半径由大到小的顺序___________。
(3)由A、B、C三种元素分别与氢元素形成的简单气态氢化物,其空间构型分别为:___________,___________,___________,其中C的简单气态氢化物的键角为:___________。
(4)已知元素A、B形成的链状分子中所有原子都满足8电子稳定结构,则其分子中键与键之比为___________。
(5)F元素的简单阴离子结构示意图___________。电解D与F形成的化合物的水溶液在工业上有着重要应用,试写出其电解的总的化学反应方程式:___________。
(6)元素G位于周期表的___________区,其价电子的排布式为:___________,该元素可形成、,其中较稳定的是,原因是___________。
(7)短周期元素M与元素E在周期表中的位置呈现对角线关系,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是___________化合物(填“离子”或“共价”)。推测M的最高价氧化物对应水化物___________(填“能”或“不能”)与D的最高价氧化物对应水化物发生反应。
20. 研究金属腐蚀和防腐的原理很有现实意义。
(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置实验,导管中液柱的上升缓慢,下列措施可以更快更清晰观察到水柱上升现象的有___________(填序号)。
A. 用纯氧气代替试管内空气B. 用酒精灯加热试管提高温度
C. 将铁钉换成铁粉和炭粉混合粉末D. 换成更细的导管,水中滴加红墨水
(2)该小组将甲图装置改进成乙图装置并进行实验,导管中红墨水液柱高度随时间的变化如下表,根据数据判断腐蚀的速率随时间逐渐___________(填“加快”、“不变”、“减慢”),你认为影响因素为___________。
(3)为探究铁钉腐蚀实验a、b两点发生的反应,进行以下实验,请完成表格空白:
(4)为防止钢铁被腐蚀,很多钢铁部件采用在表面电镀一层锌或镍的方法,电镀时钢铁部件需连接电源的___________极。而对于地下输水钢管,经常使用“牺牲阳极法”进行保护,钢铁承担的电极是___________极。金属阳极钝化也是电化学防腐方法之一,将Fe作阳极置于溶液中,一定条件下Fe钝化形成致密氧化膜,试写出该阳极电极反应式___________。选项
实验操作
实验现象
解释或结论
A
向盛有2mL0.1ml∙L-1AgNO3溶液的试管中滴加3mL0.1ml∙L-1NaCl溶液,再向其中滴加一定量0.1ml∙L-1KI溶液
先有白色沉淀生成,后又产生黄色沉淀
常温下,溶度积:Ksp(AgCl)>Ksp(AgI)
B
常温下,用pH计分别测定1ml∙L-1CH3COONH4溶液和0.1ml∙L-1 CH3COONH4溶液的pH
测得pH都等于7
同温下,不同浓度的CH3COONH4溶液中水的电离程度相同
C
用铂(Pt)电极电解等浓度的足量Fe(NO3)3、Cu(NO3)2混合溶液
阴极有红色固体物质析出
金属活动性:Fe>Cu
D
向5mL0.1ml∙L-1FeCl3溶液中滴加3mL0.1ml∙L-1KI溶液,充分反应后,取少量反应后溶液于试管中,再滴入几滴KSCN溶液
溶液变红
KI与FeCl3的反应为可逆反应
t/s
0
2
4
6
8
n(SO3)/ml
0
0.8
1.4
1.8
1.8
A
原子核外有6种不同运动状态的电子
C
基态原子中s电子总数与p电子总数相等
D
原子半径在同周期元素中最大
E
基态原子最外层电子排布式为
F
基态原子的最外层p轨道有2个电子的自旋状态与其他电子的自旋状态相反
G
生活中使用最多的一种金属
时间/min
1
3
5
7
9
液柱高度/cm
0.8
2.1
3.0
3.7
4.2
实验操作
实验现象
实验结论
向NaCl溶液中滴加2~3滴酚酞指示剂
a点附近溶液出现红色
a点电极反应为①___________
然后再滴加2~3滴②___________
b点周围出现蓝色沉淀
b点电极反应为③___________
相关试卷
这是一份天津市南开区2023-2024学年高三上学期质量检测(二)化学试题,文件包含天津市南开区20232024学年度第一学期高三期末测试化学试题pdf、天津市南开区20232024学年度第一学期高三期末测试化学答案pdf等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。
这是一份天津市南开区2023-2024学年高二上学期11月期中考试化学试题(含答案),共10页。试卷主要包含了选择题等内容,欢迎下载使用。
这是一份2022-2023学年天津市南开区高二上学期阶段性质量监测化学试题含解析,共22页。试卷主要包含了 下列物质属于强电解质的是, 25℃时,水中存在电离平衡, 溶液中存在如下平衡, 已知反应, 下列叙述不正确的是, 下列叙述正确的是等内容,欢迎下载使用。









