

陕西省汉中市2024届高三化学上学期教学质量第一次检测试题(一模)(Word版附答案)
展开(命题学校:勉县武侯中学)
注意事项:
1.试题分第I卷(选择题)和第II卷(非选择题)两部分。满分100分,考试时间90分钟。
2.答卷前,考生务必将自己的姓名、考号填涂在答题卡上。
3.选择题答案用2B铅笔把答题卡上对应题目的答案标号涂黑,非选择题用0.5mm黑色签字笔在答题卡上各题的答题区域内作答,超出答题区域的答案无效。
4.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 P-31 S-32 Fe-56
C-59 As-75
第Ⅰ卷 ( 选择题,共42分 )
一、选择题 ( 1~14题,每小题3分,共42分。每小题只有一个选项符合题意 )
1.2023年11月19日我国商用卫星“吉林一号”拍摄了富士山清晰的侧面照片,引起了世界的广泛关注,这是我国科技的巨大进步。关于“吉林一号”下列说法错误的是( )
A.“吉林一号”的太阳能电池板芯片材料是硅
B.“吉林一号”表层材料中的玻璃纤维属于无机非金属材料
C.发射“吉林一号”卫星的火箭使用偏二甲肼(CH3)2NNH2做燃料,(CH3)2NNH2属于烃类
D.“吉林一号”的太阳能面板使用的氮化镓材料是性能优异的半导体材料
2.下列说法正确的是( )
A.甲烷分子的球棍模型为 :
B.HClO的结构式 :H—Cl—O
C.H216O、D216O、H218O互为同系物
D.KOH电子式:
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,2.24L苯含C—H键的数目为0.6NA
B.过氧化钠与水反应,生成0.1 ml氧气时,转移的电子数为0.4NA
C.142 g Na2SO4和Na2HPO4 固体混合物中,阴阳离子总数为3NA
D.0.2 ml SO2与0.1ml O2充分反应生成SO3的分子数为0.2NA
4.化合物M(结构如图所示)是一种重要的有机盐,常用作食品和洗涤剂的添加剂,W、X、Y、Z、R是原子序数依次增大的短周期主族元素。下列说法正确的是( )
A.最高价含氧酸的酸性:X >Y
B.R的单质在同周期中还原性最强
C.简单气态氢化物的稳定性:Y >Z
D.W、Y、Z均为非金属元素,三元素之间只能形成共价化合物
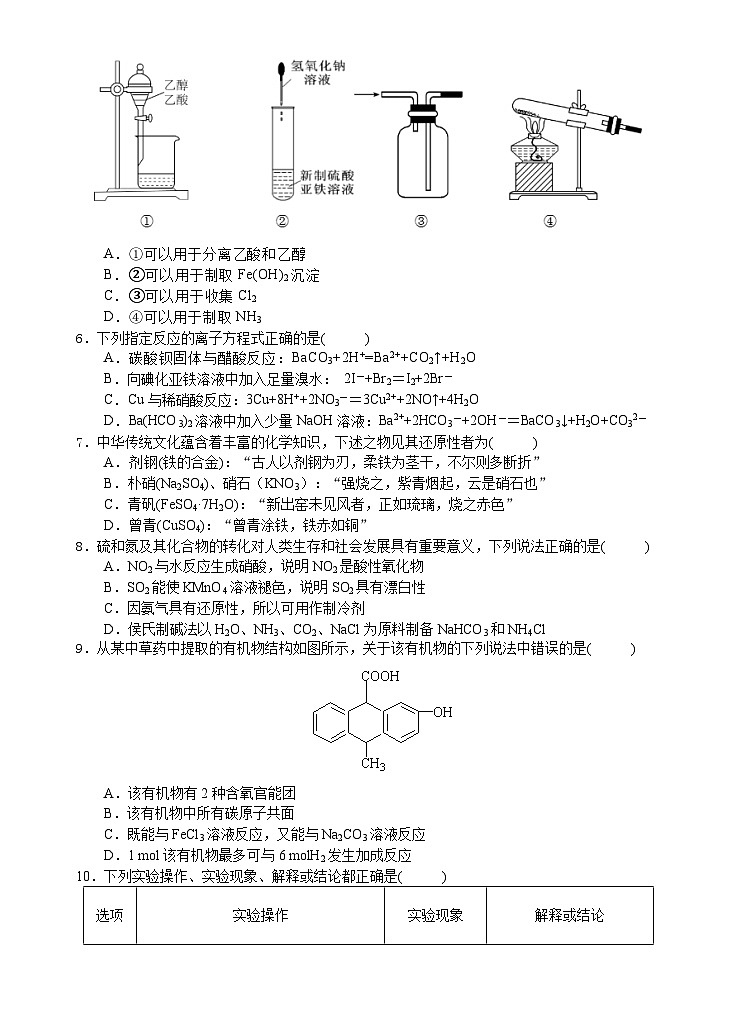
5.关于下列图示仪器说法正确的是( )
A.①可以用于分离乙酸和乙醇
B.②可以用于制取Fe(OH)2沉淀
C.③可以用于收集Cl2
D.④可以用于制取NH3
6.下列指定反应的离子方程式正确的是( )
A.碳酸钡固体与醋酸反应:BaCO3+2H+=Ba2++CO2↑+H2O
B.向碘化亚铁溶液中加入足量溴水: 2I-+Br2=I2+2Br-
C.Cu与稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.Ba(HCO3)2溶液中加入少量NaOH溶液:Ba2++2HCO3-+2OH-=BaCO3↓+H2O+CO32-
7.中华传统文化蕴含着丰富的化学知识,下述之物见其还原性者为( )
A.剂钢(铁的合金):“古人以剂钢为刃,柔铁为茎干,不尔则多断折”
B.朴硝(Na2SO4)、硝石(KNO3):“强烧之,紫青烟起,云是硝石也”
C.青矾(FeSO4·7H2O):“新出窑未见风者,正如琉璃,烧之赤色”
D.曾青(CuSO4):“曾青涂铁,铁赤如铜”
8.硫和氮及其化合物的转化对人类生存和社会发展具有重要意义,下列说法正确的是( )
A.NO2与水反应生成硝酸,说明NO2是酸性氧化物
B.SO2能使KMnO4溶液褪色,说明SO2具有漂白性
C.因氨气具有还原性,所以可用作制冷剂
D.侯氏制碱法以H2O、NH3、CO2、NaCl为原料制备NaHCO3和NH4Cl
9.从某中草药中提取的有机物结构如图所示,关于该有机物的下列说法中错误的是( )
A.该有机物有2种含氧官能团
B.该有机物中所有碳原子共面
C.既能与FeCl3溶液反应,又能与Na2CO3溶液反应
D.1 ml该有机物最多可与6 mlH2发生加成反应
10.下列实验操作、实验现象、解释或结论都正确是( )
11.大力推广锂电池新能源汽车对实现“碳达峰”“碳中和”具有重要意义。Li4Ti5O12与LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还有少量MgO、SiO2等杂质)来制备,工艺流程如下:
下列叙述错误的是( )
A.酸浸后,得到滤渣的主要成分是SiO2
B.在滤液②中主要的金属阳离子有Fe2+、Mg2+
C.高温煅烧时发生的反应为2FePO4+Li2CO3+H2C2O42LiFePO4+3CO2↑+H2O
D.制备Li4Ti5O12过程中会生成Li2Ti5O15(Ti为+4价),则Li2Ti5O15中不含过氧键
12.一种新型电池是利用催化剂可以光降解2﹣萘酚,将其处理成无害物,装置如图。下列说法正确的是( )
A.工作时的负极发生反应:
—46e-+23O2-=10CO2↑+4H2O
B.该装置只是将化学能转化为电能
C.工作时,O2-从负极迁移到正极
D.b极电势高于a极
13.在超临界水中进行碳碳加成反应时存在两条不同的路径,其反应机理如图所示。下列有关说法错误的是( )
A.比稳定
B.反应生成的活化能为54.0kJ•ml-1
C.生成的反应为吸热反应
D.选择适当的催化剂,不会改变不同路径产物的产量
14.常温下,现有0.1 ml∙L-1的NH4HCO3溶液,pH=7.8。已知含氮或含碳各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示。下列说法错误的是( )
A.常温下,Kb(NH3·H2O)>Ka1(H2CO3)
B.向pH=7.8的上述溶液中逐滴滴加NaOH溶液时,NH4+和HCO3-浓度都逐渐减小
C.NH4HCO3溶液中存在下列守恒关系:
c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.当溶液的pH=9时,溶液中存在下列关系:
c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
第Ⅱ卷 ( 非选择题,共58分 )
二、必考题 ( 15~17题,共43分 )
15.(14分)二氯化砜又名磺酰氯(SO2Cl2),是重要的化学试剂,主要用作氯化剂或氯磺化剂,也可用于制造染料、橡胶等。
查阅资料:①磺酰氯熔点为-54.1 ℃,沸点为69.1 ℃,遇冷水逐渐分解。
②实验需要加入适当的催化剂,控制温度在140-150℃。
③该实验中活性炭的作用仅为增大反应的接触面积。
现用如图所示装置(加热仪器、夹持仪器已略去)进行实验。请回答相应问题:
用98%浓硫酸配置70%的浓硫酸,下列仪器不需要的是____________(填仪器名称)。
冷凝管的作用是__________________,进水口为____________。(填“a”或“b”)
仪器A中发生反应的离子方程式________________________________________。
干燥管G中装入碱石灰的目的____________________________________________。
反应温度控制在140-150℃的方法___________________,温度控制在该范围的可能原因是______________________________________________________________。
写出D瓶中生成磺酰氯(SO2Cl2)的化学方程式_____________________________________ 。
16.(15分)钴在现代有着广泛应用,如草酸钴可作指示剂与催化剂,氯化钴是一种饲料营养强化剂。利用水钴矿(主要成分为C2O3,含少量Fe2O3、Al2O3、MnO2、MgO、CaO、SiO2等)可以制取草酸钴晶体和氯化钴晶体,依据以下制备流程回答下列问题:
已知:①C2O3具有强氧化性。 ②沉淀Ⅰ中只含有两种沉淀。③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)为加快钴矿“浸出”效率,可采取的措施是___________(任选一条),浸出过程中加入的Na2SO3与C2O3反应的离子方程式为_________________________________。
(2)加入NaClO3的作用是___________,后续加入Na2CO3调pH得到沉淀Ⅰ的成分是_________。
(3)NaF溶液可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×10-5ml·L-1,则:c(Mg2+)=__________ml∙L-1。[已知:KSP(CaF2)=1.05×10-10,KSP(MgF2)=7.35×10-11]
(4)加入萃取剂可以除去的杂质离子是_________。
(5)操作I包括:向水层加入浓盐酸调整pH为2~3,___________________、过滤、洗涤、减压烘干等过程。
(6)在空气中加热5.49g草酸钴晶体(CC2O4·2H2O),受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:[已知:M(CC2O4·2H2O)=183g/ml]
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是
。
17.(14分)CO2是一种温室气体,研究CO2的利用对促进低碳社会构建具有重要意义,我国科学家利用MS2作为催化剂,实现了CO2加氢制CH3OH。
主反应为 : I. CO2(g)+3H2(g)CH3OH(g)+H2O(g) ∆H1
同时伴随发生副反应 :II. CO2(g)+H2(g)CO(g)+H2O(g) ∆H2=+41.4kJ·ml-1
(1)已知CO(g)+2H2(g)CH3OH(g) ∆H3=—94.1kJ·ml-1,则∆H1=_____ kJ·ml-1。
(2)一定温度下,向某容器中充人2 mlCO2和6 mlH2,假设只发生上述反应I,一段时间后达到平衡。
①关于上述反应体系的分析,下列说法正确的是____________。
当3v(H2)正=v(CH3OH)逆时,反应达到平衡状态
B.恒温恒压下,当混合气体的密度恒定时,反应达到平衡状态
C.保持容器的容积不变,向体系中充人氩气,平衡不移动
D.改加高效催化剂,可以提高CO2的平衡转化率
②恒容条件下,测得反应过程中CO2和CH3OH的物质的量浓度随时间的变化如图1所示,该温度下的平衡常数K=________________(保留小数点后两位)。
(3)在恒温恒容的密闭容器中,加入一定量的CO2和足量的 H2,同时发生主、 副反应。体系中CH3OH的选择性(指转化为CH3OH的CO2占发生反应的CO2的百分比) 随温度、压强的变化曲线如图2所示:
①p1_______ p2(填“>”或“=”或“<”)。
②CH3OH的选择性随温度升高而降低的原因可能是______________________________。
(4)科学家研究了用电解法把CO2转化为CH3OH,从而消除CO2对环境的影响,其原理如图3所示:
则图中A电极接电源________极。已知B电极为惰性电极,则在水溶液中,该极的电极反应式为______________________________________。
三.选考题(请从18、19题中任选一题做在答题卷上,15分)
18.[选修3:物质结构与性质]砷化铝 (AlAs)常用作光谱分析试剂和制备电子组件的原料,是一种新型半导体材料。回答下列问题:
(1)基态As原子的核外价电子排布式为___________;第一电离能I1(As)___________I1(Se) (填“>”或“<”),其原因是______________________________________。
(2)AsH3是一种剧毒气体,其中心原子杂化轨道类型___________。
(3)MgCl2的熔点约为712℃,AlCl3的熔点约为194℃,其晶体类型分别是_________、_________。
(4)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图1所示,其中的致密保护膜可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。
图1 图2
①上述致密保护膜是一种常见的金属氧化物,其化学式为___________。
②已知AlAs的立方晶胞如图2所示,其中As的配位数为___________;该晶体密度为ρ g·cm-3,设NA为阿伏加德罗常数的值,晶胞参数为___________pm。
19.[选修5:有机化学基础]青霉素酰化酶活性试剂的中间体G的合成路线如下图:
请回答下列问题:
(1)A的化学名称_______________。
(2)B生成C反应的所用的化学试剂和条件_________________________。
(3)C生成D的反应类型_______________。
(4)请写出D生成E的化学反应方程式____________________________________________;
此过程中加入(CH3CO)2O的目的_______________________________________________。
(5)F的结构简式____________________;G中的含氧官能团名称_________________________。
(6)有机物X相对分子质量比D大14,则符合下列条件的X的同分异构体共有___________种。
①分子中含有苯环和氨基(—NH2);
②能水解且能发生银镜反应。
写出核磁共振氢谱为5组峰,且峰值面积之比为2:2:2:2:1分子的结构简式______________。
(写出其中一种)
选项
实验操作
实验现象
解释或结论
A
在稀硝酸中加入过量铁粉,
充分反应后滴加KSCN溶液
有气体生成,溶液呈血红色
稀硝酸将Fe氧化为Fe3+
B
Al2(SO4)3溶液中加入
过量氢氧化钡溶液
生成白色沉淀
Al(OH)3不溶于
氢氧化钡溶液
C
向某无色溶液中滴加浓盐酸
产生的气体使品红溶液褪色
原溶液中一定含有SO32-
D
向盛有2mL0.1ml∙L-1AgNO3溶液的试管中滴加3mL0.1ml∙L-1NaCl溶液,再向其中滴加一定量0.1ml∙L-1KI溶液
先有白色沉淀生成,后又产生黄色沉淀
该条件下,溶度积:Ksp(AgCl)>Ksp(AgI)
沉淀物
Fe(OH)3
Fe(OH)2
C(OH)2
Al(OH)3
Mn(OH)2
开始沉淀
2.7
7.6
7.6
4.0
7.7
沉淀完全
3.7
9.6
9.2
5.1
9.8
温度范围/℃
150~210
290~320
890~920
固体质量/g
4.41
2.41
2.25
汉中市2024届高三年级教学质量第一次检测考试
化学参考答案
第Ⅰ卷(选择题,共42分)
一、选择题(1~14题,每小题3分,共42分。每小题只有一个选项符合题意)
第Ⅱ卷(非选择题,共58分)
二、必考题(15~17题,共43分)
(14分)(1)碱式滴定管、坩埚(2分)
冷凝回流(1分) a(1分)
2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O(2分)
尾气处理,并防止空气中的水蒸汽进入三颈烧瓶,引起产品不纯(2分)
油浴加热(2分)
温度过低造成反应速率过慢,温度高于150℃有可能造成催化剂失活(2分)
(2分)
16.(15分)
(1) 将水钴矿粉碎、加热、适当增大盐酸浓度、搅拌等(任选1条) (1分) (2分)
(2) 氧化Fe 2+(2分) Fe(OH)3 、Al(OH)3(2分)
(3)(2分)
(4)(2分)
(5)蒸发浓缩,冷却结晶(2分)
(6)(2分)
17.(14分)
(1) -52.7(2分)
(2) ① BC(2分) ② 3.70(2分)
(3) ① > (2分) ② 主反应为放热反应,副反应为吸热反应,升高温度,平衡向吸热方向移动,故温度升高时不利于主反应、有利于副反应的发生,所以CH3OH的选择性降低(2分)
(4)负(2分) 2H2O-4e-===4H++O2↑(2分)
三、选考题(请从18、19题中任选一题做在答题卷上,15分)
18.【选修3:物质结构与性质】
(1) 4S24P3 (2分) >(1分) As最外层的4p能级为比较稳定的半充满结构,较稳定,故第一电离能I1(As) 大于I1(Se)(2分)
(2) sp3(2分)
(3) 离子晶体(1分) 分子晶体(1分)
(4) Al2O3 (2分) 4 (2分) ×1010(2分)
19. (15分)【选修5:有机化学基础】
(1)甲苯(1分)
浓硫酸、浓硝酸、加热(1分)
还原反应(1分)
(2分)
保护氨基,防止氨基被氧化(2分)
(2分)硝基、羧基(2分)
17(2分)(2分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
C
A
C
B
D
C
C
D
B
D
D
A
D
B
2024届陕西省汉中市高三上学期教学质量第一次检测(一模)化学试卷: 这是一份2024届陕西省汉中市高三上学期教学质量第一次检测(一模)化学试卷,共11页。试卷主要包含了试题分第Ⅰ卷两部分,可能用到的相对原子质量,关于下列图示仪器说法正确的是等内容,欢迎下载使用。
陕西省汉中市2024届高三上学期第一次教学质量检测(汉中一模)化学试卷及答案: 这是一份陕西省汉中市2024届高三上学期第一次教学质量检测(汉中一模)化学试卷及答案,共10页。
2024届陕西省汉中市高三上学期教学质量第一次检测(一模)化学试卷(含答案): 这是一份2024届陕西省汉中市高三上学期教学质量第一次检测(一模)化学试卷(含答案),共11页。试卷主要包含了试题分第Ⅰ卷两部分,可能用到的相对原子质量,关于下列图示仪器说法正确的是等内容,欢迎下载使用。












