

专题一 化学用语与基本概念 选择题专攻 3.离子方程式的正误判断(含解析)-2024年江苏高考化学大二轮复习讲义
展开这是一份专题一 化学用语与基本概念 选择题专攻 3.离子方程式的正误判断(含解析)-2024年江苏高考化学大二轮复习讲义,共8页。试卷主要包含了下列反应的离子方程式正确的是等内容,欢迎下载使用。
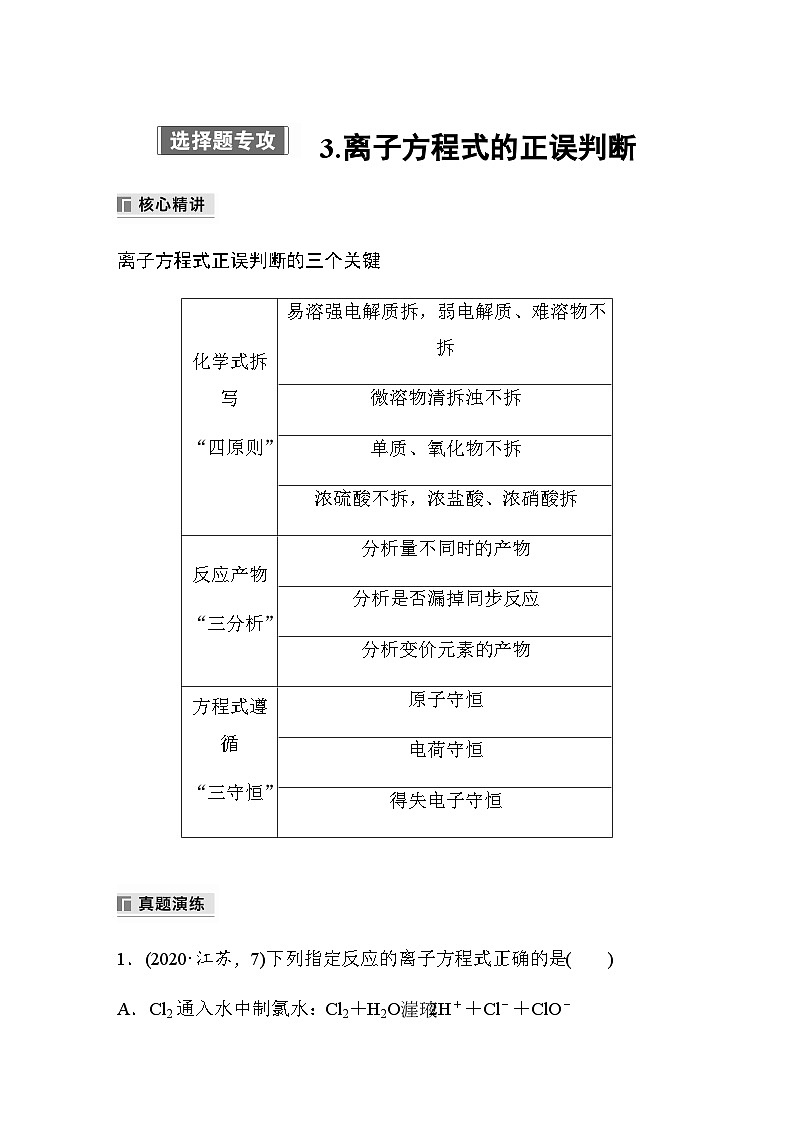
离子方程式正误判断的三个关键
1.(2020·江苏,7)下列指定反应的离子方程式正确的是( )
A.Cl2通入水中制氯水:Cl2+H2O2H++Cl-+ClO-
B.NO2通入水中制硝酸:2NO2+H2O===2H++NOeq \\al(-,3)+NO
C.0.1 ml·L-1 NaAlO2溶液中通入过量CO2:AlOeq \\al(-,2)+CO2+2H2O===Al(OH)3↓+HCOeq \\al(-,3)
D.0.1 ml·L-1 AgNO3溶液中加入过量浓氨水:Ag++NH3+H2O===AgOH↓+NHeq \\al(+,4)
2.(2023·浙江6月选考,9)下列反应的离子方程式正确的是( )
A.碘化亚铁溶液与等物质的量的氯气:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
B.向次氯酸钙溶液通入足量二氧化碳:ClO-+CO2+H2O===HClO+HCOeq \\al(-,3)
C.铜与稀硝酸:Cu+4H++2NOeq \\al(-,3)===Cu2++2NO2↑+2H2O
D.向硫化钠溶液通入足量二氧化硫:S2-+2SO2+2H2O===H2S+2HSOeq \\al(-,3)
3.(2023·北京,6)下列离子方程式与所给事实不相符的是( )
A.Cl2制备84消毒液(主要成分是NaClO):Cl2+2OH-===Cl-+ClO-+H2O
B.食醋去除水垢中的CaCO3:CaCO3+2H+===Ca2++H2O+CO2↑
C.利用覆铜板制作印刷电路板:2Fe3++Cu===2Fe2++Cu2+
D.Na2S去除废水中的Hg2+:Hg2++S2-===HgS↓
4.(2023·湖南,5)下列有关电极方程式或离子方程式错误的是( )
A.碱性锌锰电池的正极反应:MnO2+H2O+e-===MnO(OH)+OH-
B.铅酸蓄电池充电时的阳极反应:Pb2++2H2O-2e-===PbO2+4H+
C.K3[Fe(CN)6]溶液滴入FeCl2溶液中:K++Fe2++[Fe(CN)6]3-===KFe[Fe(CN)6]↓
D.TiCl4加入水中:TiCl4+(x+2)H2O===TiO2·xH2O↓+4H++4Cl-
1.下列离子方程式正确的是( )
A.碳酸钠稀溶液中通入二氧化碳:COeq \\al(2-,3)+CO2+H2O===2HCOeq \\al(-,3)
B.常温下铜丝插入浓硝酸中:2H++Cu===Cu2++H2↑
C.氧化铁粉末溶于氢碘酸:Fe2O3+6H+===3H2O+2Fe3+
D.用惰性电极电解氯化镁溶液:2Cl-+2H2Oeq \(=====,\s\up7(电解))2OH-+Cl2↑+H2↑
2.能正确表示下列反应的离子方程式的为( )
A.钠和冷水反应:Na+2H2O===Na++OH-+H2↑
B.用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2===I2+2OH-
C.1 L 1 ml·L-1 FeBr2溶液与一定量氯气反应转移的电子数为2×6.02×1023时,反应的离子方程式为2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
D.向NaClO溶液中通入少量SO2:ClO-+SO2+H2O===SOeq \\al(2-,4)+Cl-+2H+
3.下列关于氯及其化合物之间转化反应的离子方程式书写不正确的是( )
A.实验室制备少量Cl2:MnO2+4H++2Cl-eq \(=====,\s\up7(△))Mn2++2H2O+Cl2↑
B.向KAl(SO4)2溶液中加入氨水:Al3++3OH-===Al(OH)3
C.用Na2S2O3溶液吸收水中的Cl2:4Cl2+S2Oeq \\al(2-,3)+5H2O===10H++2SOeq \\al(2-,4)+8Cl-
D.AgCl固体可溶于氨水:AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O
4.宏观辨识与微观探析是化学学科核心素养之一。下列物质性质实验对应的反应方程式书写错误的是( )
A.用过量饱和Na2CO3溶液吸收废气中的SO2:2COeq \\al(2-,3)+SO2+H2O===SOeq \\al(2-,3)+2HCOeq \\al(-,3)
B.用白醋除铁锈:Fe2O3·xH2O+6H+===(3+x)H2O+2Fe3+
C.将少量溴水滴入过量Na2SO3溶液中:Br2+3SOeq \\al(2-,3)+H2O===2Br-+2HSOeq \\al(-,3)+SOeq \\al(2-,4)
D.将KI溶液滴入稀硫酸酸化的KIO3溶液中:5I-+IOeq \\al(-,3)+6H+===3I2+3H2O
5.用黄铁矿为原料制硫酸产生的硫酸渣(含Fe2O3、SiO2、Al2O3、MgO等)提取铁红(Fe2O3)的过程如图所示。下列有关反应离子方程式判断和书写错误的是( )
A.酸溶过程中Fe2O3溶解反应的离子方程式为Fe2O3+6H+===2Fe3++3H2O
B.滤渣A溶解于NaOH溶液的离子方程式为SiO2+2OH-===SiOeq \\al(2-,3)+H2O
C.“还原”过程产物之一为H2SO4,发生反应的离子方程式为FeS2+16Fe3++9H2O===17Fe2++2SOeq \\al(2-,4)+18H+
D.“氧化”过程发生反应的离子方程式为4Fe2++O2+2H2O+8OH-===4Fe(OH)3↓
选择题专攻3 离子方程式的正误判断
真题演练
1.C [A错,次氯酸是弱酸,不能拆开;B错,电荷及氧原子个数不守恒,正确的离子方程式为3NO2+H2O===2H++2NOeq \\al(-,3)+NO;D错,向硝酸银溶液中加入过量氨水,最终生成[Ag(NH3)2]+,离子方程式为Ag++2NH3·H2O===[Ag(NH3)2]++2H2O。]
2.B [碘化亚铁溶液与等物质的量的氯气反应,碘离子与氯气恰好完全反应:2I-+Cl2===I2+2Cl-,故A错误;向次氯酸钙溶液通入足量二氧化碳,反应生成碳酸氢钙和次氯酸:ClO-+CO2+H2O===HClO+HCOeq \\al(-,3),故B正确;铜与稀硝酸反应生成硝酸铜、一氧化氮和水:3Cu+8H++2NOeq \\al(-,3)===3Cu2++2NO↑+4H2O,故C错误;向硫化钠溶液通入足量二氧化硫,发生反应:2S2-+5SO2+2H2O===3S↓+4HSOeq \\al(-,3),故D错误。]
3.B
4.B [碱性锌锰电池放电时正极得到电子生成MnO(OH),电极反应为MnO2+H2O+e-===MnO(OH)+OH-,A正确;铅酸蓄电池在充电时阳极失电子,发生反应:PbSO4-2e-+2H2O===PbO2+4H++SOeq \\al(2-,4),B错误;K3[Fe(CN)6]溶液与Fe2+反应生成蓝色沉淀,反应的离子方程式为K++Fe2++[Fe(CN)6]3-===KFe[Fe(CN)6]↓,C正确;TiCl4容易发生水解,反应的离子方程式为TiCl4+(x+2)H2O===TiO2·xH2O↓+4H++4Cl-,D正确。]
考向预测
1.A [碘离子具有还原性,会和铁离子反应生成亚铁离子和碘单质,反应的离子方程式为Fe2O3+6H++2I-===2Fe2++3H2O+I2,C错误;生成的氢氧根离子会和镁离子反应生成氢氧化镁沉淀,反应的离子方程式为Mg2++2Cl-+2H2Oeq \(=====,\s\up7(电解))Mg(OH)2↓+Cl2↑+H2↑,D错误。]
2.C [钠和冷水反应生成氢氧化钠和氢气,离子方程式为2Na+2H2O===2Na++2OH-+H2↑,故A错误;FeBr2和Cl2反应过程中,Cl2先将Fe2+氧化为Fe3+,然后将Br-氧化为Br2,1 L 1 ml·L-1 FeBr2溶液与一定量氯气反应转移的电子数为2×6.02×1023时,说明生成1 ml Fe3+和0.5 ml Br2,反应的离子方程式为2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-,故C正确;向NaClO溶液中通入少量SO2,离子方程式为3ClO-+H2O+SO2===SOeq \\al(2-,4)+2HClO+Cl-,故D错误。]
3.B [实验室制备少量氯气,可以用MnO2与浓盐酸加热制备,其离子方程式为MnO2+4H++2Cl-eq \(=====,\s\up7(△))Mn2++2H2O+Cl2↑,故A正确;向KAl(SO4)2溶液中加入氨水,铝离子与氨水反应,生成氢氧化铝和铵根离子,一水合氨为弱碱,化学式不拆,故B错误。]
4.B [白醋除铁锈:Fe2O3·xH2O+6CH3COOH===(3+x)H2O+6CH3COO-+2Fe3+,B错误;少量溴水氧化部分Na2SO3,剩余Na2SO3与溶液中氢离子结合生成HSOeq \\al(-,3),离子方程式为Br2+3SOeq \\al(2-,3)+H2O===2Br-+2HSOeq \\al(-,3)+SOeq \\al(2-,4),C正确。]
5.C [硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,稀硫酸溶解主要除去不与酸反应的SiO2,加入FeS2将溶液中的Fe3+还原为Fe2+,再加氢氧化钠和空气,调节溶液的pH使Fe3+沉淀,而Mg2+、Al3+都不沉淀,最后洗涤、烘干、研磨使氢氧化铁分解生成氧化铁,从而得到铁红。酸溶过程中Fe2O3溶解反应的离子方程式为Fe2O3+6H+===2Fe3++3H2O,A正确;滤渣A为SiO2,溶解于NaOH溶液的离子方程式为SiO2+2OH-===SiOeq \\al(2-,3)+H2O,B正确;“还原”过程产物之一为H2SO4,发生反应的离子方程式为FeS2+14Fe3++8H2O===15Fe2++2SOeq \\al(2-,4)+16H+,C错误;“氧化”过程发生反应的离子方程式为4Fe2++O2+2H2O+8OH-===4Fe(OH)3↓,D正确。]
化学式拆写
“四原则”
易溶强电解质拆,弱电解质、难溶物不拆
微溶物清拆浊不拆
单质、氧化物不拆
浓硫酸不拆,浓盐酸、浓硝酸拆
反应产物
“三分析”
分析量不同时的产物
分析是否漏掉同步反应
分析变价元素的产物
方程式遵循
“三守恒”
原子守恒
电荷守恒
得失电子守恒
相关试卷
这是一份专题八 有机化学 选择题专攻 3.同分异构体的判断(含解析)-2024年江苏高考化学大二轮复习讲义,共9页。试卷主要包含了概念,特点,构造异构的类别等内容,欢迎下载使用。
这是一份专题四 电化学 选择题专攻 3.电解原理的多方面应用(含解析)-2024年江苏高考化学大二轮复习讲义,共11页。试卷主要包含了图解电解池工作原理,对比掌握电解规律,金属的电化学腐蚀与防护,陌生电解池装置图的知识迁移等内容,欢迎下载使用。
这是一份专题一 化学用语与基本概念 选择题专攻 4.离子共存、离子检验与推断(含解析)-2024年江苏高考化学大二轮复习讲义,共8页。试卷主要包含了离子共存的常见限制条件,常见阳离子的检验,常见阴离子的检验等内容,欢迎下载使用。












