




- 新教材适用2023_2024学年高中化学专题2原子结构与元素性质第1单元原子核外电子的运动第1课时原子核外电子的运动课件苏教版选择性必修2 课件 0 次下载
- 新教材适用2023_2024学年高中化学专题2原子结构与元素性质第1单元原子核外电子的运动第2课时原子核外电子的排布课件苏教版选择性必修2 课件 0 次下载
- 新教材适用2023_2024学年高中化学专题2原子结构与元素性质第2单元元素性质的递变规律第2课时元素第一电离能和电负性的周期性变化课件苏教版选择性必修2 课件 0 次下载
- 新教材适用2023_2024学年高中化学专题3微粒间作用力与物质性质专题整合课件苏教版选择性必修2 课件 0 次下载
- 新教材适用2023_2024学年高中化学专题3微粒间作用力与物质性质第1单元金属键金属晶体课件苏教版选择性必修2 课件 0 次下载
高中化学苏教版 (2019)选择性必修2第二单元 元素性质的递变规课文内容ppt课件
展开1.能从原子核外电子排布的规则理解核外电子排布的周期性,能从外围电子排布的角度理解元素周期表中元素的分区及周期、族的划分。2.通过原子结构与元素在周期表中的位置关系的相互推导,形成“结构—位置”的推导模型。
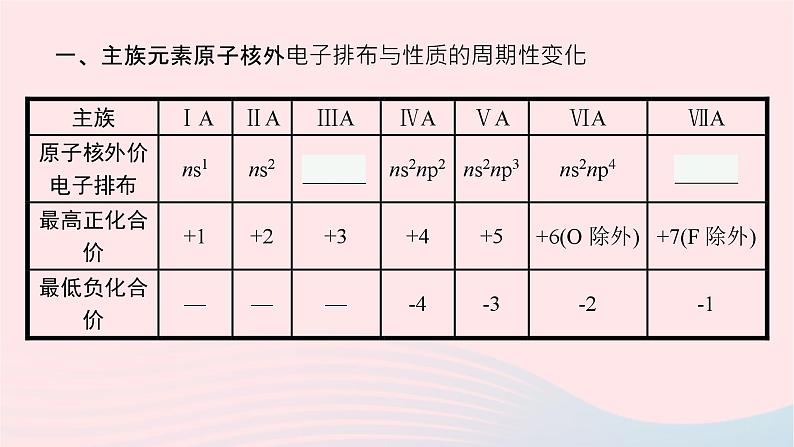
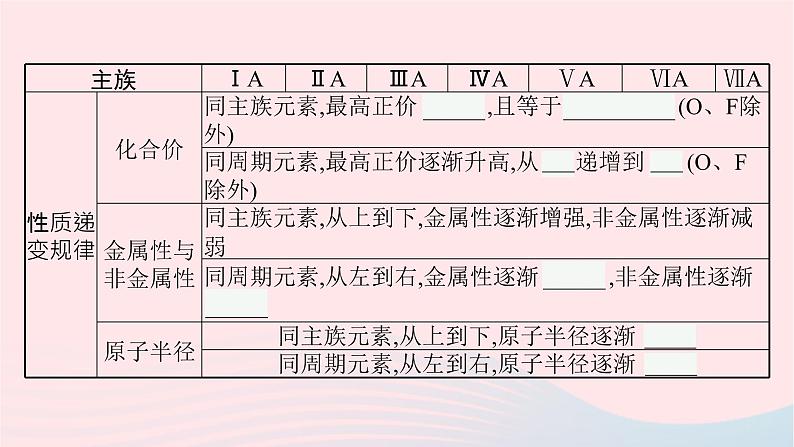
一、主族元素原子核外电子排布与性质的周期性变化
【自主思考1】 最高正化合价和最低负化合价代数和为6的原子核外价电子排布式是什么?提示:ⅦA族元素(O除外)的原子最高正化合价和最低负化合价代数和为6,其原子核外价电子排布式是ns2np5。
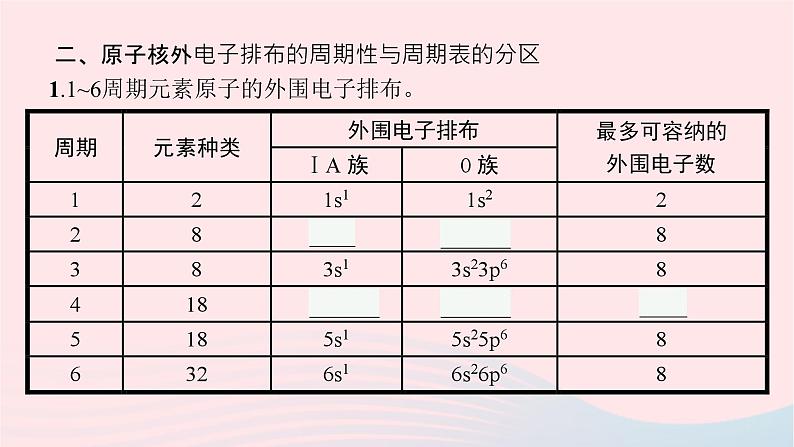
二、原子核外电子排布的周期性与周期表的分区1.1~6周期元素原子的外围电子排布。
2.周期表的分区。根据元素原子的 外围电子排布 的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区。五个区的位置关系如下图所示。【自主思考2】 过渡元素存在于元素周期表的哪些分区?提示:d区、ds区和f区。
【效果自测】 1.判断正误,正确的画“√”,错误的画“×”。(1)除0族外,短周期元素的最高化合价在数值上都等于该元素所属的族序数。( )(2)碱金属元素是指ⅠA族的所有元素。 ( )(3)价电子数与最高化合价相等的元素一定是主族元素。( )(4)元素周期表5个区中都有金属元素。( )(5)非金属元素都分布在p区。( )(6)原子价电子排布式为3d84s2的元素属于s区。( )
2.下列说法不正确的是( )。A.元素原子核外电子排布的周期性变化导致元素性质的周期性变化B.前6周期中,周期序数越大,该周期所含金属元素越多C.所有区的名称均来自按构造原理最后填入电子的轨道符号D.周期表共18个纵列,可分为7个主族7个副族,1个Ⅷ族,1个0族答案:C解析:除ds区外,区的名称来自按构造原理最后填入电子的轨道的符号。
3.下表为元素周期表的一部分,其中的编号代表对应的元素。 请回答下列问题。(1)表中属于d区的元素是 (填编号)。 (2)表中元素①的6个原子与元素③的6个原子形成的某种环状物名称为 。(3)某元素原子的价电子排布式为nsnnpn+1,该元素原子的最外层电子数为 。
答案:(1)⑨(2)苯(3)5解析:(1)⑨属于d区元素。(2)元素①是氢元素,元素③是碳元素,依题意,形成的环状物是苯。(3)从nsnnpn+1可知,n=2,该元素为氮元素,最外层电子数为5。
1.Fe元素处于周期表中的哪个区?Fe2+、Fe3+的电子排布式怎样书写?提示:Fe位于d区,常见离子为Fe2+、Fe3+,电子排布式分别为1s22s22p63s23p63d6、1s22s22p63s23p63d5。2.某元素基态原子的核外电子排布式为1s22s22p63s23p63d104s2,据此判断该元素是何种元素?位于周期表中的哪一区?提示:该元素为Zn,位于ds区。3.为什么s区(除氢元素)、d区和ds区的元素都是金属元素?提示:s区(除氢元素)、d区和ds区的元素原子最外层电子数为1~2(Pd除外),在反应中易失去电子,故都是金属元素。
1.元素周期表中族和分区的关系。(1)主族:s区和p区。(ns+np)的电子数=族序数。(2)0族:p区。(ns+np)的电子数=8(或2)。(3)ⅢB~ⅦB族:d区。[(n-1)d+ns]的电子数=族序数。(4)Ⅷ族:d区。8≤[(n-1)d+ns]的电子数≤10。(钯除外)(5)ⅠB~ⅡB族:ds区。(n-1)d全充满,ns的电子数=族序数。(6)镧系和锕系元素位于f区。
2.各区元素原子价电子排布特点。
3.洪特规则特例。当同一轨道上的电子排布为全充满(p6、d10、f14)、半充满(p3、d5、f7)和全空状态(p0、d0、f0)时,具有较低的能量和较强的稳定性。例如,铬(24Cr)元素基态原子的外围电子排布式为3d54s1(3d、4s均为半充满),而不是3d44s2;铜(29Cu)元素基态原子的外围电子排布式为3d104s1(3d全充满、4s半充满),而不是3d94s2。
【例题】 已知某些元素在周期表中的位置如图所示: 下列说法正确的是( )。A.表中五种元素位于5个不同的区B.元素4的基态原子的外围电子排布式为3d104s2,与它具有相同最外层电子数的元素只可能处于ds区C.元素1、2、3的基态原子中,未成对电子数之比为1∶3∶5D.元素5的原子结构示意图为
解析:元素2和元素5均位于p区,A项错误。元素4为锌,其基态原子的外围电子排布式为3d104s2,最外层电子数为2的元素还包括s区的Be、Mg等,d区的Ti、Mn、Fe等,p区的He等,B项错误。元素1、2、3分别是H、O、Mn,它们的基态原子的外围电子排布式分别为1s1、2s22p4、3d54s2,故其未成对电子数之比为1∶2∶5,C项错误。元素5位于第4周期ⅣA族,原子结构示意图正确。
归纳总结 根据原子结构特征判断元素在元素周期表中的位置电子排布式 外围电子排布式
【变式训练】 在研究原子核外电子排布与元素周期表的关系时,人们发现外围电子排布相似的元素集中在一起。据此,人们将元素周期表分为五个区,并以最后填入电子的轨道符号作为该区的符号,如图所示。(1)在s区中,族序数最大且原子序数最小的元素,原子的外围电子的电子云形状为___________。 (2)在d区中,族序数最大且原子序数最小的元素,常见离子的电子排布式为___________,其中较稳定的是___________ 。 (3)在ds区中,族序数最大且原子序数最小的元素,原子的外围电子排布式为___________ 。 (4)在p区中,第2周期ⅤA族元素原子外围电子轨道表示式为__________。(5)当今常用于核能开发的元素是铀和钚,它们在___________区中。
答案:(1)球形(2)Fe2+:1s22s22p63s23p63d6,Fe3+:1s22s22p63s23p63d5 Fe3+(3)3d104s2(4)(5)f
解析:(1)s区包含ⅠA族、ⅡA族,符合条件的元素为Be,其电子排布式为1s22s2,外围电子的电子云形状为球形。(2)d区包含ⅢB族~ⅦB族、Ⅷ族,族序数最大且原子序数最小的为Fe,常见离子为Fe2+、Fe3+,电子排布式为1s22s22p63s23p63d6、1s22s22p63s23p63d5,由离子的电子排布式可知Fe3+的3d轨道“半充满”,其稳定性强于Fe2+。(3)ds区符合条件的为Zn,其电子排布式为1s22s22p63s23p63d104s2,外围电子排布式为3d104s2。(4)该题中符合题意的为N,外围电子轨道表示式为 。(5)铀和钚均为锕系元素,位于f区。
化学选择性必修2第二单元 元素性质的递变规集体备课ppt课件: 这是一份化学选择性必修2第二单元 元素性质的递变规集体备课ppt课件,共39页。PPT课件主要包含了内容索引,自主预习新知导学,合作探究释疑解惑,课堂小结,素养阐释,问题引领,归纳提升,典型例题等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修2第一单元 原子核外电子的运动教课内容课件ppt: 这是一份高中化学苏教版 (2019)选择性必修2第一单元 原子核外电子的运动教课内容课件ppt,共31页。PPT课件主要包含了内容索引,自主预习新知导学,合作探究释疑解惑,课堂小结,素养阐释,问题引领,归纳提升,典型例题等内容,欢迎下载使用。
苏教版 (2019)选择性必修2第一单元 原子核外电子的运动集体备课ppt课件: 这是一份苏教版 (2019)选择性必修2第一单元 原子核外电子的运动集体备课ppt课件,共25页。PPT课件主要包含了内容索引,自主预习新知导学,合作探究释疑解惑,课堂小结,素养阐释,原子轨道,问题引领,归纳提升,典型例题等内容,欢迎下载使用。













