





所属成套资源:新教材适用2023_2024学年高中化学全一册课件打包19套苏教版选择性必修2
- 新教材适用2023_2024学年高中化学专题3微粒间作用力与物质性质第3单元共价键共价晶体第2课时共价键键能与化学反应的反应热共价晶体课件苏教版选择性必修2 课件 0 次下载
- 新教材适用2023_2024学年高中化学专题3微粒间作用力与物质性质第4单元分子间作用力分子晶体课件苏教版选择性必修2 课件 0 次下载
- 新教材适用2023_2024学年高中化学专题4分子空间结构与物质性质专题整合课件苏教版选择性必修2 课件 0 次下载
- 新教材适用2023_2024学年高中化学专题4分子空间结构与物质性质第1单元分子的空间结构第1课时分子的空间结构模型课件苏教版选择性必修2 课件 0 次下载
- 新教材适用2023_2024学年高中化学专题4分子空间结构与物质性质第2单元配合物的形成和应用课件苏教版选择性必修2 课件 0 次下载
选择性必修2专题4 分子空间结构与物质性质第一单元 分子的空间结构授课课件ppt
展开
这是一份选择性必修2专题4 分子空间结构与物质性质第一单元 分子的空间结构授课课件ppt,共39页。PPT课件主要包含了内容索引,素养阐释,自主预习新知导学,合作探究释疑解惑,问题引领,归纳提升,典型例题,课堂小结等内容,欢迎下载使用。
1.知道分子可以分为极性分子和非极性分子,能依据分子的空间结构和键的极性判断分子的极性,能根据分子的极性预测其溶解性。2.能描述手性分子的结构特征和性质特点,认识手性分子在药物研究中的重要作用。
一、分子的极性1.极性分子与非极性分子。
2.分子极性的判断方法。分子的极性是由分子中所含共价键的极性与分子的空间结构两方面共同决定的。判断分子极性时,可根据以下原则进行:(1)双原子分子。①以非极性键结合的双原子分子是 非极性 分子,如O2、H2。②以极性键结合的双原子分子都是 极性 分子,如HCl、HF、HBr。(2)多原子分子。以极性键结合的多原子分子,分子是否有极性取决于分子的空间结构,若配位原子对称地分布在中心原子周围,使整个分子的正、负电荷重心重合,则是非极性分子;否则,是极性分子。
3.分子的极性对物质溶解性的影响——“相似相溶规则”。非极性分子构成的物质一般易溶于 非极性 溶剂,极性分子构成的物质一般易溶于 极性 溶剂。【自主思考1】 含有非极性键的分子一定是非极性分子吗?由极性键形成的双原子分子一定是极性分子吗?提示:含有非极性键的分子不一定是非极性分子,如H2O2;由极性键形成的双原子分子一定是极性分子,如HCl。
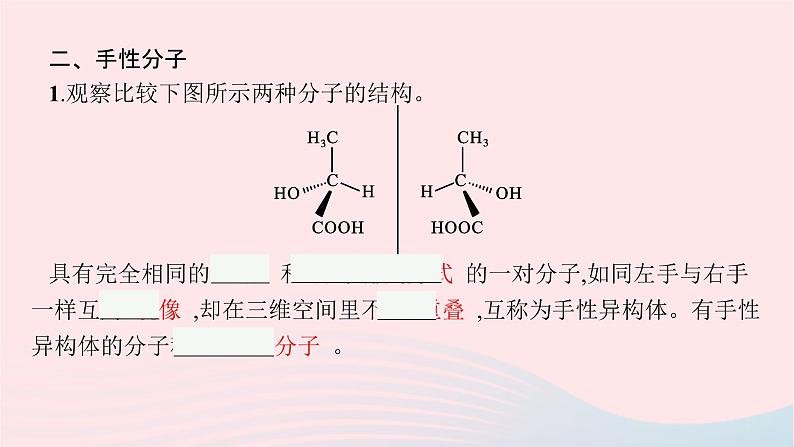
二、手性分子1.观察比较下图所示两种分子的结构。 具有完全相同的 组成 和 原子排列方式 的一对分子,如同左手与右手一样互为 镜像 ,却在三维空间里不能 重叠 ,互称为手性异构体。有手性异构体的分子称为 手性分子 。
2.手性碳原子的判断。连接 四个不同的原子或基团 的碳原子称为手性碳原子。如 ,R1、R2、R3、R4互不相同,含有手性碳原子,该有机物分子具有手性。3.手性分子的物理性质。一对手性异构体的物理性质(沸点、熔点、密度等)基本相同,但它们的旋光性和生理作用往往不同。
4.手性分子的重要用途。人们把含有手性分子的药物称为手性药物。一种药物分子必须包含适宜的官能团,这些官能团还必须以具有生物活性的构型排列。因此,在药物的合成过程中,“左”旋和“右”旋的药物手性异构体往往会被同时制造出来。目前所用的很多药物都具有手性,它们主要通过与体内的酶、核苷酸等大分子作用,抑制(或激发)该大分子的生理活性,达到治疗疾病的目的。由于手性分子对生命及生理活动有其特殊的活性,化学工作者期望可以找到对癌症和一些目前的疑难杂症有治疗作用的手性药物等。
【自主思考2】 互为手性分子的物质是同一种物质吗?二者具有什么关系?提示:不是同一种物质,二者互为同分异构体。【自主思考3】 互为手性分子的物质性质相同吗?分析其原因。提示:物质结构决定性质。互为手性分子的物质组成、结构几乎完全相同,所以其化学性质相似,但由于结构上的差异,其旋光性和生理作用会有差异。
【效果自测】 1.判断正误,正确的画“√”,错误的画“×”。(1)非极性分子只能是双原子单质分子。( )(2)非极性分子中,一定含有非极性共价键。( )(3)手性分子之间,因分子式相同,故其性质相同。( )
2.在HF、H2S、NH3、CO2、CCl4、N2、C60、SO2中:(1)以非极性键结合的非极性分子是 ; (2)以极性键相结合,具有直线形结构的非极性分子是 ; (3)以极性键相结合,具有正四面体形结构的非极性分子是 ; (4)以极性键相结合,具有三角锥形结构的极性分子是 ; (5)以极性键相结合,具有V形结构的极性分子是 ; (6)以极性键相结合,而且分子极性最大的是 。 答案:(1)N2、C60 (2)CO2 (3)CCl4 (4)NH3 (5)H2S、SO2 (6)HF
解析:HF是含有极性键、直线形的极性分子(极性最大,因F的电负性最大);H2S和SO2都是含有极性键、V形结构的极性分子;NH3是含有极性键、三角锥形结构的极性分子;CO2是含有极性键、直线形的非极性分子;CCl4是含有极性键、正四面体形的非极性分子;N2、C60都是由非极性键结合的非极性分子。
用一带静电的玻璃棒靠近A、B两种纯液体流,现象如图所示。
1.根据实验现象分析A、B两种分子是极性分子还是非极性分子。提示:A为非极性分子,B为极性分子。2.说明你作出上述判断的理由。提示:带静电的玻璃棒靠近A,液体不偏转,说明A液体不受玻璃棒所带电荷的影响,分子为非极性分子;带静电的玻璃棒靠近B,液体发生偏转,说明B液体与玻璃棒之间有电性作用,由此推知B中存在带正电性的部分和带负电性的部分,分子为极性分子。
1.判断分子极性的一般思路。
2.判断ABn型分子极性的方法。(1)化合价法:ABn型分子中,中心原子的化合价的绝对值等于该原子的价电子数时,该分子为非极性分子,此时分子的空间结构对称;若中心原子的化合价的绝对值不等于其价电子数,则分子的空间结构不对称,该分子为极性分子。具体实例如下:
(2)根据键的极性、分子的空间结构判断:
【例题1】 (双选)下列叙述正确的是( )。A.NH3是极性分子,分子中氮原子处在3个氢原子所组成的三角形的中心B.CCl4是非极性分子,分子中碳原子位于正四面体形结构的中心C.H2O是极性分子,分子中氧原子不处在2个氢原子所连成的直线的中央D.CO2是非极性分子,分子中碳原子不处在2个氧原子所连成的直线的中央答案:BC解析:NH3是三角锥形的分子,A项错误;CCl4是以碳原子为中心的正四面体形结构的分子,B项正确;CO2是碳原子在2个氧原子中间的直线形分子,D项错误;H2O是氧原子在两个氢原子中间的V形分子,C项正确。
易错警示 对键的极性和分子极性的认识误区(1)极性分子中一定有极性键,非极性分子中不一定含有非极性键。如CH4是非极性分子,只有极性键。(2)含有非极性键的分子不一定为非极性分子,如H2O2是含有非极性键的极性分子。
【变式训练1】 下列化合物中,化学键的极性和分子的极性皆相同的是( )。A.CO2和SO2B.CH4和H2OC.BF3和NH3D.HCl和HI答案:D解析:A项中,CO2为极性键构成的非极性分子,SO2是极性分子;B项中,CH4为极性键构成的非极性分子,H2O是极性键构成的极性分子;C项中,BF3为极性键构成的非极性分子,NH3为极性键构成的极性分子;D项中,HCl和HI都是极性键构成的极性分子。
PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度较小;另一种为黄绿色,在水中的溶解度较大。1.PtCl2(NH3)2是平面四边形结构还是四面体形结构?提示:根据PtCl2(NH3)2可以形成两种固体,即其有两种同分异构体,可知其结构应为平面四边形结构,若为四面体形结构则无同分异构体。
2.淡黄色的PtCl2(NH3)2是极性分子还是非极性分子?其空间结构是怎样的?提示:淡黄色的PtCl2(NH3)2在水中溶解度小,根据“相似相溶规则”,应为非极性分子,其空间结构为 。 3.黄绿色的PtCl2(NH3)2是极性分子还是非极性分子?其空间结构是怎样的?提示:黄绿色的PtCl2(NH3)2在水中溶解度较大,应为极性分子,其空间结构为 。
1.物质溶解性的判断与比较。(1)依据“相似相溶规则”。非极性溶质一般易溶于非极性溶剂,难溶于极性溶剂。极性溶质一般易溶于极性溶剂,难溶于非极性溶剂。(2)依据溶质与溶剂之间是否存在氢键。如果溶质与溶剂之间能形成氢键,则溶质溶解度增大,且氢键作用力越大,溶解性越好。如:NH3、HF极易溶于水;甲醇、乙醇、乙二醇、丙三醇、甲酸、乙酸、甲醛、乙醛、氨基乙酸、乙胺等易溶于水,就是因为它们与水形成分子间氢键。(3)依据分子结构的相似性。溶质与溶剂分子结构的相似程度越大,其溶解度越大。如烃基越大的醇(羧酸、醛)在水中的溶解度越小。
2.注意的问题。(1)“相似相溶规则”是从分子结构的角度,通过实验的观察和研究而得出的关于物质溶解性的经验规律,也有不符合此规律的例外情况,如CO、NO等极性分子难溶于水。(2)“相似相溶规则”可以解释一些物质在某些溶剂中溶解的情况。
【例题2】 (1)下列叙述不正确的是 。 A.卤化氢易溶于水,不易溶于四氯化碳B.碘易溶于汽油,微溶于水C.氯化钠易溶于水,也易溶于食用油D.甲烷易溶于汽油,难溶于水(2)将几种物质在水和四氯化碳中的溶解情况填入下表: 其原因是 。
答案:(1)C (2)易溶 易溶 难溶 难溶 难溶 难溶 易溶 易溶 根据“相似相溶规则”判断,极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂解析:(1)HX(X为卤素)、H2O为极性分子,I2、CH4为非极性分子,CCl4、汽油为非极性溶剂。根据“相似相溶规则”,可知A、B、D项正确。NaCl为离子化合物,易溶于水,难溶于有机溶剂,故C项不正确。(2)分析题给物质和溶剂的分子极性可知,蔗糖、磷酸、水是极性分子,而碘、萘、四氯化碳是非极性分子。根据“相似相溶规则”,可判断出物质的溶解情况。
【变式训练2】 下列说法中正确的是( )。A.极性溶质一定易溶于极性溶剂中,非极性溶质一定易溶于非极性溶剂中B.溴分子和水分子是极性分子,四氯化碳分子是非极性分子,所以溴难溶于水而易溶于四氯化碳C.白磷分子是非极性分子,水分子是极性分子,而二硫化碳是非极性分子,所以白磷难溶于水而易溶于二硫化碳D.水分子是极性分子,二氧化碳可溶于水,因此二氧化碳是极性分子解析:很多有机化合物分子都是极性分子,但因为极性很弱,所以大部分难溶于水,而许多极性有机化合物在非极性有机化合物中的溶解度却很大,A项错误。溴分子是非极性分子,B项错误。二氧化碳是非极性分子,D项错误。
在生命的产生和演变过程中,往往对一对手性异构体中的一种手性分子有所“偏爱”,如自然界存在的糖大多为右旋体,氨基酸大多为左旋体。因为构成生命的重要物质如蛋白质和核酸等大多是由手性分子缩合而成的,所以生物体内进行的化学反应也往往选择性地“接纳”某种类型的手性分子。A B
1.分析上面两组有机化合物,指出A组、B组内的左右两侧的有机化合物是什么关系。提示:A组中左右两侧的有机化合物是同一种物质;B组内左右两侧的两种有机化合物互为手性异构体。2.B组中的两种有机化合物一种具有镇痛作用,而另一种没有镇痛作用,却是有效的镇咳药。上述事实给你什么启示?简要说明并与同学交流。提示:手性异构体具有不同的性质。提高药物的专一性,开发和服用有效的单一手性药物可以排除无效(或不良)手性异构体所引起的毒副作用。
1.手性分子的判断方法。(1)观察实物与其镜像能否重合,如果不能重合,说明是手性分子。(2)观察有机化合物分子中是否有手性碳原子,如果有一个手性碳原子,则该有机化合物分子就是手性分子,具有手性异构体。含有两个手性碳原子的有机化合物分子不一定是手性分子。2.手性异构体的性质。物质结构决定性质。互为手性异构体的物质组成、原子排列完全相同,所以其物理性质、化学性质几乎完全相同,但两种手性分子可能具有明显不同的生理作用。
【例题3】 丙氨酸(C3H7NO2)分子为手性分子,它存在手性异构体,如下图所示: 下列关于丙氨酸的两种手性异构体(Ⅰ和Ⅱ)的说法正确的是( )。A.Ⅰ和Ⅱ分子中均存在2个手性碳原子B.Ⅰ和Ⅱ呈镜面对称,具有相同的分子极性C.Ⅰ和Ⅱ分子都是极性分子,只含有极性键,不含非极性键D.Ⅰ和Ⅱ的化学键相同,所以分子的性质完全相同
解析:Ⅰ和Ⅱ分子中都只含有1个手性碳原子,都是极性分子,分子中都含有极性键和非极性键,两者互为手性异构体,但可能具有不同的生理活性和光学活性。
【变式训练3】 已知3-氯-2-丁氨酸的结构简式为 ,请回答下列问题:(1)3-氯-2-丁氨酸分子中含有 个手性碳原子。 (2)3-氯-2-丁氨酸的一对手性异构体可用简单的投影式表示为 和 ,则另一对手性异构体的简单投影式应为 和 。
答案:(1)2 (2)解析:根据手性碳原子上连接四个不同的原子或原子团可以判断出该物质分子中与—NH2和—Cl相连的两个碳原子为手性碳原子;参照例子可以知道手性异构体之间的关系就像我们照镜子一样,某物质的手性异构体就是该物质在镜子中的“镜像”。
相关课件
这是一份高中化学苏教版 (2019)选择性必修2第一单元 分子的空间结构教学演示课件ppt,共36页。PPT课件主要包含了内容索引,自主预习新知导学,合作探究释疑解惑,课堂小结,素养阐释,等电子原理,问题引领,归纳提升,典型例题等内容,欢迎下载使用。
这是一份高中化学苏教版 (2019)选择性必修2专题4 分子空间结构与物质性质第一单元 分子的空间结构教课内容ppt课件,共21页。PPT课件主要包含了手性分子,要点一分子的极性,要点二手性分子等内容,欢迎下载使用。
这是一份高中化学第一单元 分子的空间结构示范课课件ppt,共8页。PPT课件主要包含了特别提醒,三角锥形等内容,欢迎下载使用。









