
2024雅安多校联考高二上学期12月月考试题化学含解析
展开1.本试卷分选择题和非选择题两部分,共100分。考试时间75分钟。
2.请将各题答案填写在答题卡上。
3.本试卷主要考试内容:人教版选择性必修1。
4.可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cu-64
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.中国航天科技发展举世瞩目。2020年“嫦娥五号”成功携带月球样品返回地球,2021年“天问一号”着陆火星,它们都是由以液氢为燃料的“长征五号”火箭搭载升空的。下列有关说法错误的是
A.氢气燃烧的产物不污染环境,有利于实现碳中和
B.低温液态储氢可以大大提高氢气的密度,降低储运成本
C.已知2H2(g)+O2(g)=2H2O(g) △H1=-483.6kJ/ml,则H2的燃烧热△H=-241.8kJ/ml
D.氢气的来源较多,包括水的电解、煤的气化、乙烷裂解和氯碱工业等
2.下列事实不能用勒夏特列原理(化学平衡移动原理)解释的是
A.合成氨时,选定温度为400~500℃,而不是常温
B.人体血液的pH稳定在7.4±0.05范围内
C.氯气在水中的溶解度大于在饱和食盐水中的溶解度
D.生活中,可用热的纯碱溶液除油污
3.下列做法的目的与改变化学反应速率无关的是
A.瓜子包装袋内放置除氧剂 B.青香蕉和苹果放一起催熟
C.食盐中添加碘酸钾 D.红薯放在地窖中保存
4.下列应用与盐类水解无关的是
A.氯化铵用作除锈剂
B.明矾作净水剂
C.用氯化铁溶液制氢氧化铁胶体
D.盐酸用作除垢剂,除去水垢
5.下列说法能证明一元酸(HA)是弱电解质的是:
A.HA溶液的导电性比醋酸溶液弱.
B.常温下测得0.01ml/LHA溶液的pH=2
C.常温下测得NaA溶液呈碱性
D.往HA溶液中滴加甲基橙,溶液显红色
6.下列说法错误的是
A.多元弱酸的逐级电离平衡常数依次减小
B.强酸与强碱形成的盐,其水溶液不一定呈中性
C.水的离子积常数Kw不仅适用于纯水,也适用于稀的酸、碱、盐溶液
D.电离平衡常数大的酸溶液中的c(H+)一定比电离平衡常数小的酸溶液中的c(H+)大.
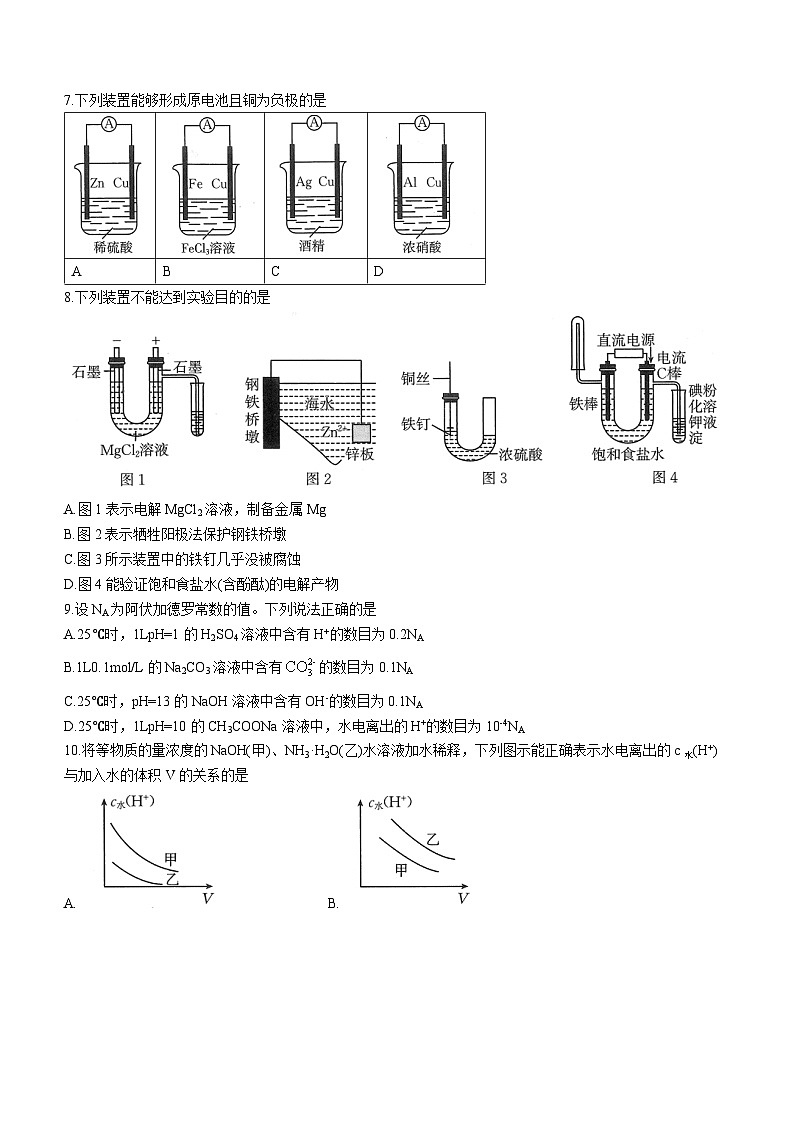
7.下列装置能够形成原电池且铜为负极的是
8.下列装置不能达到实验目的的是
A.图1表示电解MgCl2溶液,制备金属Mg
B.图2表示牺牲阳极法保护钢铁桥墩
C.图3所示装置中的铁钉几乎没被腐蚀
D.图4能验证饱和食盐水(含酚酞)的电解产物
9.设NA为阿伏加德罗常数的值。下列说法正确的是
A.25℃时,1LpH=1的H2SO4溶液中含有H+的数目为0.2NA
的Na2CO3溶液中含有的数目为0.1NA
C.25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA
D.25℃时,1LpH=10的CH3COONa溶液中,水电离出的H+的数目为10-4NA
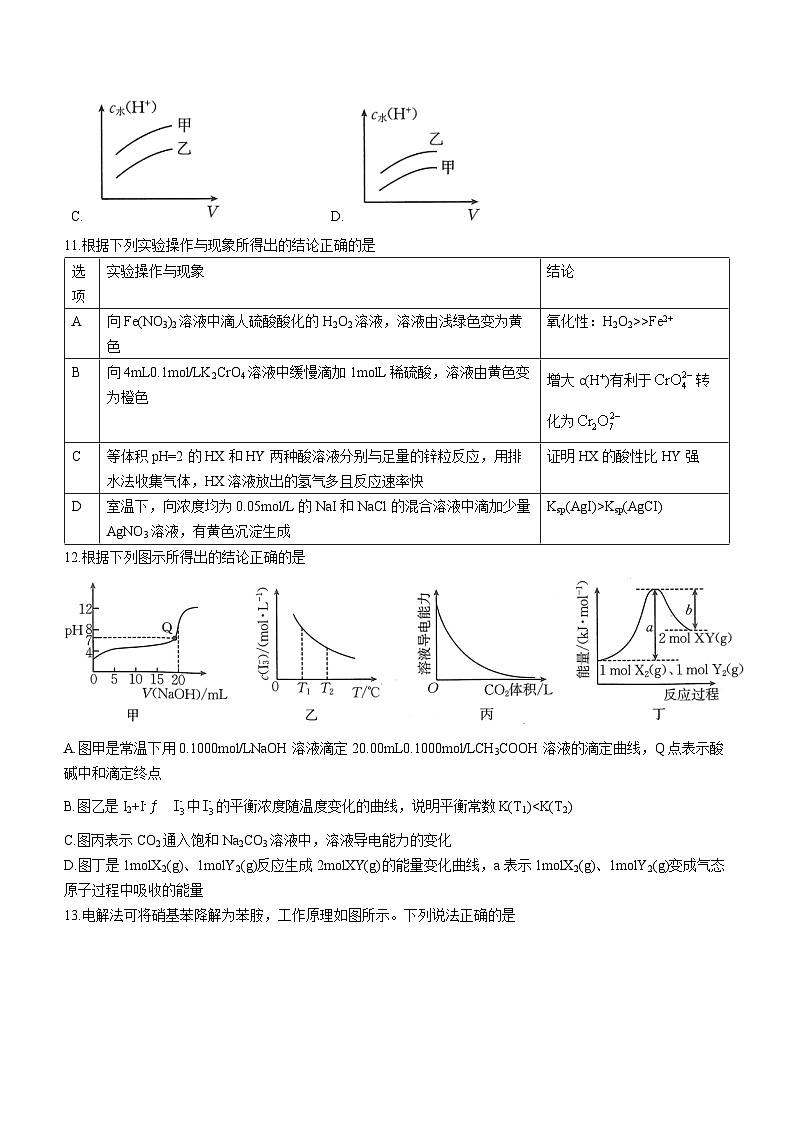
10.将等物质的量浓度的NaOH(甲)、NH3·H2O(乙)水溶液加水稀释,下列图示能正确表示水电离出的c水(H+)与加入水的体积V的关系的是
A. B.
C. D.
11.根据下列实验操作与现象所得出的结论正确的是
12.根据下列图示所得出的结论正确的是
A.图甲是常温下用0.1000ml/LNaOH溶液滴定溶液的滴定曲线,Q点表示酸碱中和滴定终点
B.图乙是I2+I-中的平衡浓度随温度变化的曲线,说明平衡常数K(T1)
D.图丁是1mlX2(g)、1mlY2(g)反应生成2mlXY(g)的能量变化曲线,a表示1mlX2(g)、1mlY2(g)变成气态原子过程中吸收的能量
13.电解法可将硝基苯降解为苯胺,工作原理如图所示。下列说法正确的是
A.b极连接电源负极
B.理论上每转移4ml电子,将有4mlH+从右室移入左室
C.电解质溶液中H+浓度越大,越利于硝基苯降解
D.a极上硝基苯发生的反应为-6e-+6H+=+2H2O
14.根据表中数据判断,下列说法中错误的是
A.少量的CO2气体通入次氯酸钠溶液中的反应为NaClO+H2O+CO2=HClO+NaHCO3
的NaHSO4溶液逐渐滴加到同浓度的NaClO溶液中,混合后溶液pH减小
C.NaHSO3溶液中,离子浓度由大到小的顺序是c(Na+)>c(H+)>c()>c()>c(OH-)
D.浓度均为0.1ml/L的Na2CO3、NaHCO3、NaClO、NaHSO3溶液,pH最大的是Na2CO3
二、非选择题:本题共4小题,共58分。
15.(14分)能源的开发、利用与人类社会的可持续发展息息相关,充分利用好能源是摆在人类面前的重大课题。
(1)为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有专家提出利用太阳能促进燃料循环使用的构想,如图所示:
过程Ⅰ的能量转化形式为_______能转化为_________能。
(2)有机物M经过太阳光照射可转化成N,转化过程如下:
△H=+88.6kJ/ml
则M、N中,较稳定的是____________。
(3)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。其过程如图所示:
太阳能→热能→→热能-→电能
反应Ⅰ:2H2SO4(l)2SO2(g)+2H2O(g)+O2(g) △H1=+551kJ/ml
反应Ⅲ:S(s)+O2(g)SO2(g) △H3=-297kJ/ml
写出反应Ⅱ的热化学方程式:__________________。
(4)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是___(填标号)。
A.C(s)+CO2(g)=2CO(g) △H>0
B.4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H<0
C.NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l) △H<0
D.C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(l) △H<0
(5)如图所示的装置中,X、Y都是惰性电极。将电路接通后,向乙装置中滴入无色酚酞溶液,Fe极附近显红色。
①甲装置是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,电极a上的电极反应式是__________________。
②乙装置中,总反应的离子方程式是__________________。
③若丙裝置中精铜电极的质量增加了6.4g,则甲装置中标准状况下消耗的CH4的体积为_________________。
16.(15分)某研究小组为了精确检测果脯蜜饯中添加剂亚硫酸盐的含量,用如图所示装置进行实验,实验步骤如下:
Ⅰ.三颈烧瓶中加入25.00g均匀的果脯蜜饯样品和200mL水,锥形瓶中加入溶液。
Ⅱ.以0.1L/min的流速通入氮气,再滴入磷酸,加热并保持微沸,待锥形瓶中溶液的颜色不再发生变化,停止加热。
Ⅲ.向润洗过的滴定管中装入0.0500ml/L(NH4)2Fe(SO4)2溶液至0刻度以上,排尽空气后记录读数,将(NH4)2Fe(SO4)2溶液逐滴滴入锥形瓶,待溶液变为浅红色时,用蒸馏水洗涤锥形瓶内壁,继续滴定至溶液由浅红色褪为无色,记录读数。
Ⅳ.重复步骤Ⅲ实验3次,记录消耗的(NH4)2Fe(SO4)2溶液体积如下表:
回答下列问题:
(1)冷凝管的进水口为_____(填“a”或“b”),通入氮气的目的是_____。
(2)步骤Ⅱ中KMnO4被还原为Mn2+,发生反应的离子方程式为_______。
(3)设计步骤Ⅲ的目的是_____________,其中所用滴定管的名称是____。
(4)加入的H3PO4的作用是______________。
(5)上述实验中若先加磷酸再通氮气,会使测定结果__________(填“偏高”“偏低”或“无影响”);该样品中亚硫酸盐含量(以SO2计)为______g/kg。
17.(14分)以水氯镁石样品(主要成分为MgCl2·6H2O,含少量有机色素和Fe2+、Cu2+、Mn2+、Pb2+)为原料,制备氯化镁的流程如图:
回答下列问题:
(1)“脱色”过程中H2O2会转化为·OH(羟基自由基),·OH可使部分有机色素转化为CO2和H2O。
①·OH体现的性质是________________。
②相同时间内,测得不同温度下脱色率的变化如图所示。50℃前脱色率随着温度升高而升高,原因是______________。
(2)“沉淀”时,在H2O2的作用下,Mn2+转化成MnO2的离子方程式为_____________。
(3)在加入(NH4)2S之前需先加热微沸,其目的是__________。
(4)已知:室温下Ksp(CuS)=6×10-36、Ksp(PbS)=8×10-28,溶液中离子浓度小于或等于1×10-5ml/L即认为该离子已经除尽。除Cu2+、Pb2+时,Cu2+、Pb2+均沉淀完全,此时需控制溶液中c(S2-)不低于__________。
(5)从氯化镁溶液中制得MgCl2·6H2O的操作为_______。制备无水氯化镁的方法为_______________。
18.(15分)研发二氧化碳的利用技术,将二氧化碳转化为能源是减轻环境污染和解决能源问题的方案之一。回答下列问题:
(1)利用CO2合成二甲醚有两种工艺。
工艺1:
涉及以下主要反应:
反应Ⅰ.甲醇的合成:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=-49.0kJ/ml
反应Ⅱ.逆水汽变换:CO2(g)+H2(g)CO(g)+H2O(g) △H2=+41.0kJ/ml
反应Ⅲ.甲醇脱水:2CH3OH(g)CH3OCH3(g)+H2O(g) △H3=-23.5kJ/ml
工艺2:反应Ⅳ.2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) △H
①△H=_________kJ/ml,反应Ⅳ在_____(填“低温”“高温”或“任意温度”)下自发进行。
②反应Ⅳ的活化能Ea(正)________(填“>”“<"或“=”)Ea(逆)。
③在恒温恒容的密闭容器中,下列说法能判断反应Ⅳ达到平衡的是____(填标号)。
A.气体物质中碳元素与氧元素的质量比不变
B.容器内CH3OCH3浓度保持不变
C.容器内气体密度不变
D.容器内气体的平均摩尔质量不变
(2)在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇(反应Ⅰ),实验测得CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图甲、乙所示。
①下列说法正确的是______(填标号)。
A.图甲纵坐标表示CH3OH的平衡产率
B.p1
D.一定温度、压强下,提高CO2的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是___________。
(3)在T1温度下,将3mlCO2和7mlH2充人2L的恒容密闭容器中发生反应Ⅰ和Ⅳ,达到平衡状态时CH3OH(g)和CH3OCH3(g)的物质的量分别为1ml和0.5ml。
①反应经过10min达到平衡,0~10min内CO2的平均反应速率v(CO2)=______ml/(L·min)。
②T1温度时反应Ⅰ的平衡常数K=_____________。
A
B
C
D
选项
实验操作与现象
结论
A
向Fe(NO3)2溶液中滴人硫酸酸化的H2O2溶液,溶液由浅绿色变为黄色
氧化性:H2O2>>Fe2+
B
向4mL0.1ml/LK2CrO4溶液中缓慢滴加1mlL稀硫酸,溶液由黄色变为橙色
增大c(H+)有利于转化为
C
等体积pH=2的HX和HY两种酸溶液分别与足量的锌粒反应,用排水法收集气体,HX溶液放出的氢气多且反应速率快
证明HX的酸性比HY强
D
室温下,向浓度均为0.05ml/L的NaI和NaCl的混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成
Ksp(AgI)>Ksp(AgCI)
酸
H2SO3
HClO
H2CO3
电离平衡常数(25℃)
K1=1.23×10-2
K2=6.6×10-8
K=3.2×10-8
K1=4.5×10-7
K2=4.7×10-11
第一次
第二次
第三次
第四次
(NH4)2Fe(SO4)2溶液体积
19.98mL
20.50mL
20.00mL
20.02mL
化学试卷参考答案
1.C【解析】燃烧热是指1ml物质完全燃烧生成稳定产物时放出的热量,该热化学方程式中,H2O(g)不是稳定产物,且不知道气态水转化为液态水放出的能量,故不能计算H2的燃烧热,C项错误。
2.A【解析】合成氨的反应为放热反应,升高温度平衡逆向移动,不利于生成氨气,所以选定温度为400~500℃,而不是常温,主要是从速率角度考虑,与平衡移动无关,不能用勒夏特列原理解释,A项符合题意。
3.C【解析】瓜子包装袋内放置除氧剂的目的是减慢食品腐败变质的速率,A项不符合题意;未成熟的青香蕉与成熟的苹果一起密封放置,可以加快香蕉的成熟速率,B项不符合题意;红薯放在地窖中保存可以减慢红薯变质的速率,D项不符合题意。
4.D【解析】水垢的主要成分为碳酸钙和氢氧化镁,盐酸除垢利用的是盐酸的酸性,D项符合题意。
5.C【解析】没有说明溶液的浓度,无法比较HA和醋酸的酸性强弱,A项不符合题意;常温下测得0.01ml/LHA溶液的pH=2,则氢离子浓度为0.01ml/L,HA完全电离,为强电解质,B项不符合题意;往HA溶液中滴加甲基橙,溶液显红色只能说明HA溶液显酸性,无法证明HA是弱电解质,D项不符合题意。
6.D【解析】酸的浓度没确定,所以电离平衡常数大的酸溶液中的c(H+)与电离平衡常数小的酸溶液中的c(H+)无法比较,D项错误。
7.D【解析】Al遇浓硝酸钝化,铜与浓硝酸反应生成硝酸铜,失电子,作负极,D项符合题意。
8.A【解析】图1电解MgCl2溶液制备不到Mg,反应的化学方程式为MgCl2+2H2OMg(OH)2↓+Cl2↑十H2↑,A项符合题意。
9.D【解析】25℃时,1LpH=1的H2SO4溶液中含有H+的物质的量为0.1ml/L×1L=0.1ml,A项错误;Na2CO3是强碱弱酸盐,碳酸根离子在溶液中会水解使溶液呈碱性,的数目小于0.1NA,B项错误;缺溶液的体积,无法计算,C项错误。
10.D【解析】NaOH和NH3·H2O的电离均会抑制水的电离,所以加水稀释的过程中,水电离出的氢离子浓度会越来越大,但NH3·H2O为弱电解质,甲、乙两溶液物质的量浓度相同时乙溶液电离出的氢氧根离子较少,对水的电离的抑制作用较弱,水电离出的氢离子浓度更大,D项符合题意。
11.B【解析】硝酸根离子在酸性条件下有强氧化性,也可氧化二价铁,故不能得到氧化性:H2O2>Fe3+,A项错误;等体积pH均为2的HX和HY两种酸溶液分别与足量锌反应,HX溶液放出的H2多且速率快,说明HX的物质的量浓度更大,但是电离出的氢离子浓度相同(pH都是2),所以说明HX的电离程度更小,即HX的酸性更弱,C项错误;有黄色沉淀生成说明碘化银先沉淀,故其溶解度更小,Ksp(AgI)
13.B【解析】b极为阳极,与电源正极相连,A项错误;电解质溶液中H+浓度过高,在电极上得电子的氢离子会更多,不利于硝基苯得电子,不利于硝基苯降解,C项错误;a极上硝基苯发生的反应为+6e-+6H+=+2H2O,D项错误。
14.C【解析】NaHSO3完全电离得到Na+和,存在微弱的水解和微弱的电离过程,故c()>c(H+),C项错误。
15.(1)太阳(1分);化学(1分)
(2)M(2分)
(3)3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) △H=-254kJ/ml(2分)
(4)BD(2分)
(5)①CH4+10OH--8e-=+7H2O(2分)
②2H2O+2Cl-Cl2↑+2OH-+H2↑(2分)
③0.56L或560mL(2分)
【解析】(3)由图可知,反应Ⅱ为3SO2(g)+2H2O(g)=2H2SO4(l)+S(s),根据盖斯定律,Ⅱ=(Ⅰ+Ⅲ)×(-1),整理可得3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) △H=-254kJ/ml 。
(4)依据原电池的构成原理,自发进行的放热的氧化还原反应在理论上可以设计成原电池,A项是吸热反应,C项是非氧化还原反应。
(5)①将电路接通后,向乙装置中滴入酚酞溶液,Fe极附近显红色,说明Fe为阴极,C为阳极,甲装置左边为负极,右边为正极,则a处通入的是CH4,电极上发生的电极反应是CH4+10OH--8e-=+7H2O。
②乙装置为电解饱和食盐水,其总反应的离子方程式是2H2O+2Cl-Cl2↑+2OH-+H2↑。
③丙装置中精铜电极的电极反应式为Cu2++2e-=Cu,若该电极质量增加了6.4g,则生成Cu的物质的量n===0.1ml,转移0.2ml电子,甲装置中a处通入的是CH4,电极上发生的电极反应是CH4+10OH--8e-=+7H2O,转移0.2ml电子时,消耗0.025mlCH4,体积V=0.025ml×22.4L/ml=0.56L。
16.(1)a(2分);实验开始前,排尽装置内的空气,实验开始后将生成的SO2全部排入高锰酸钾溶液中(2分)
(2)2 +5SO2+2H2O=2Mn2++5+4H+(2分)
(3)测定锥形瓶中剩余的KMnO4的量(2分);酸式滴定管(2分)
(4)使亚硫酸盐转化为SO2逸出(2分)
(5)偏低(1分);1.28(2分)
【解析】磷酸和果脯蜜饯中的亚硫酸盐反应放出二氧化硫,用氮气把二氧化硫全部排人高锰酸钾溶液中,然后用(NH4)2Fe(SO4)2溶液滴定剩余的高锰酸钾,从而计算果脯蜜饯放出二氧化硫的量。
(5)n总(KMnO4)=25.00×10-3L×0.016ml/L=4.000×10-4ml
n[(NH4)2Fe(SO4)2]=n(Fe2+)=20.00×10-3L×0.0500ml/L=1.000×10-3ml
由题意可得关系式:KMnO4~5Fe2+
n剩余(KMnO4)=n(Fe2+)=×1.000×10-3ml=2.000×10-4ml
由题意可得关系式:2KMnO4~5SO2
与SO2反应的KMnO4的物质的量:4.000×10-4ml-2.000×10-4ml=2.000×10-4ml
n(SO2)=n(KMnO4)=×2.000×10-4ml=5.000×10-4ml
m(SO2)=5.000×10-4ml×64g/ml=3.200×10-2g
样品中亚硫酸盐的含量:=1.28g/kg。
17.(1)①氧化性(2分)
②升高温度,吸附速率加快,双氧水(·OH浓度增大)的氧化能力增强,氧化速率加快,形成Fe(OH)3胶体,吸附能力提高,脱色率提高(合理答案均可,2分)
(2)Mn2++2NH3·H2O+H2O2=MnO2↓+2+2H2O(2分)
(3)将多余的双氧水分解,防止氧化后加入的S2-(2分)
(4)8×10-23ml/L(2分)
(5)蒸发浓缩、冷却结晶(2分);在氯化氢的氛围中加热分解脱水(2分)
【解析】(1)①·OH具有较强的得电子能力,体现氧化性。
(2)加氨水调节pH时,Mn2+被溶液中的H2O2氧化转化成MnO2的离子方程式为Mn2++2NH3·H2O+H2O2=MnO2↓+2+2H2O。
(3)加入(NH4)2S之前加热,将多余的双氧水分解,防止氧化后加入的S2-。
(4)除Cu2+、Pb2+时,Cu2+、Pb2+均沉淀完全,此时需控制溶液中c(S2-)使Pb2+完全沉淀,则c(S2-)===8×10-23(ml/L)。
18.(1)①-121.5(2分);低温(1分)
②<(2分)
③BD(2分)
(2)①AC(2分)
②温度到一定值时,此时反应以反应Ⅱ为主,反应Ⅱ气体体积不变的反应,改变压强平衡不移动,二氧化碳转化率不变,三条压强曲线交于一点(2分)
(3)①0.1(2分).
②10(2分)
【解析】(1)③反应前后质量守恒、原子守恒,碳与氧元素质量比恒定不变,A项不符合题意;体积不变,气体质量不变,气体密度是定值不能判断达到平衡状态,C项不符合题意。
(2)①图甲中,同一温度下压强增大反应Ⅰ平衡正向移动,甲醇的产率越高,因此p1>p2>p3,B项错误;催化剂不能提高CO2的平衡转化率,D项错误。
(3)根据碳元素守恒可知,n余(CO2)=1ml,有1mlCH3OH(g)和0.5mlCH3OCH3(g)生成,则反应Ⅰ生成的H2O(g)为1ml,消耗的H2为3ml;反应Ⅳ生成的H2O(g)为1.5ml,消耗的H2为3ml;则平衡时,n平(CO2)=1ml,n平(H2O)=2.5ml,n平(H2)=1ml。由此计算可得v(CO2)=ml/(L·min)=0.1 ml/(L·min),反应Ⅰ的平衡常数K==10。
2024榆林五校联考高二上学期12月月考试题化学含答案: 这是一份2024榆林五校联考高二上学期12月月考试题化学含答案,共10页。试卷主要包含了本试卷分选择题和非选择题两部分,答题前,本卷命题范围,可能用到的相对原子质量,下列有关说法中正确的是,为阿伏加德罗常数的值等内容,欢迎下载使用。
2024开封五县联考高二上学期12月月考试题化学PDF版含解析: 这是一份2024开封五县联考高二上学期12月月考试题化学PDF版含解析,共17页。
2024邯郸五校高二上学期12月月考试题化学含解析: 这是一份2024邯郸五校高二上学期12月月考试题化学含解析,共11页。试卷主要包含了本试卷分选择题和非选择题两部分,答题前,考生务必用直径0,本卷命题范围,可能用到的相对原子质量,c,K=,因为K=0等内容,欢迎下载使用。












