


浙江省湖州市吴兴高级中学2023-2024学年高一上学期12月第二次阶段性测试化学试题(含答案)
展开化 学
考试时间:90分钟 试卷总分:100分
可能用到元素的相对原子量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5 K:39 Ca:40 Fe:56 Cu:64 Zn:65 Br:80 I:127 Ba:137
第一部分 选择题(共50分)
一、选择题(每小题只有一个正确选项,每题2分)
1、下列属于碱的是( )
A.NH3·H2OB.Na2CO3C.C2H5OHD.Cu2(OH)2CO3
2、化学与生活、社会发展息息相关,下列说法不正确的是( )
A.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
C.“青蒿一握,以水二升渍,绞取汁”,诗句中体现的屠呦呦对青蒿素的提取属于化学变化
D.“春蚕到死丝方尽,蜡炬成灰泪始干” 诗句中涉及氧化还原反应
3、下列物质的俗名与化学式对应正确的是( )
A.漂白液有效成分:Ca(ClO)2 B.生石灰:Ca(OH)2
C.小苏打:Na2CO3 D.铁红:Fe2O3
4、下列说法正确的是( )
A.18O2和16O3互为同位素 B.H与Na在元素周期表中处于同一主族
C.35Cl和37Cl是两种不同的元素 D.C60和C70是具有相同质子数的不同核素
5、下列表示不正确的是( )
A.氯离子的结构示意图8
8
+17
2
B.次氯酸的电子式eq H\(\s\up2(•),\s\d2(•))\\ac(Cl,\s\up7(••),\s\d7(••))\(\s\up2(•),\s\d2(•))\\ac(O,\s\up7(••),\s\d7(••))\(\s\up2(•),\s\d2(•))
C.原子核内有8个中子的碳原子14eq\\ar(14,6)C D.氯化钙的电子式
6、2016年IUPAC命名117号元素为Ts(中文名“”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
A.Ts是第七周期第ⅦA族元素 B.AgTs是一种能溶于硝酸的白色沉淀
C.Ts在同族元素中非金属性最弱 D.中子数为176的Ts核素符号是Ts
7、下列说法正确的是( )
A.Li在空气中加热可得固体Li2O2
B.FeO在空气中加热可得固体Fe2O3
C.Mg加入到过量FeCl3溶液中只能得到Fe2+
D.H2O2溶液中加入少量MnO2粉末生成H2和O2
8、下列物质的保存方法,与其化学性质无关的是
A.浓盐酸需密封保存B.新制氯水需存放于棕色瓶中
C.金属钠保存在煤油中D.过氧化钠需在干燥密闭的环境中保存
9、下列说法正确的是( )
A.干燥的氯气能使鲜花褪色
B.实验室中未用完的钠、钾、白磷等不可以放回原试剂瓶
C.做焰色试验前,铂丝用稀硫酸清洗并灼烧至火焰呈无色
D.用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色
10、化学烫发巧妙利用了头发中蛋白质发生化学反应实现对头发的“定型”,其变化过程示意图如下。下列说法不正确的是( )
A.药剂A具有还原性
B.①→②过程若有2 ml S-S键断裂,则转移4 ml电子
C.②→③过程若药剂B是H2O2,
其还原产物为O2
D.化学烫发通过改变头发中某些蛋白质中S-S键位置来实现头发的定型
11、下列变化不需要破坏化学键的是( )
A.加热碳酸氢钠固体 B.干冰升华
C.水通电分解 D.氯化氢溶于水
12、下列除杂操作方法不正确的是( )
13、用n(NaOH)为0.6ml的NaOH浓溶液吸收一定量的氯气,充分反应后溶液中只含有NaCl、NaClO、NaClO3三种溶质。下列判断不正确的是( )
A.被吸收的氯气的物质的量为0.6 ml
B.若反应中转移的电子的物质的量为n ml,则0.3
D.n(Na+):n(Cl-)可能为14:9
14、已知草酸(H2C2O4)是一种弱酸,157℃升华,170℃以上分解可放出CO2和CO;可与酸性KMnO4溶液反应;其钠盐易溶于水,钙盐难溶于水。下列说法正确的是( )
A.草酸受热产生的气体,用足量的NaOH溶液充分吸收后,可收集得到纯净的CO
B.草酸受热产生的气体通过灼热的氧化铜,若出现黑色变红色现象,则说明产生的气体中一定有CO
C.草酸受热产生的气体直接通入足量的澄清石灰水中,若能产生白色浑浊现象,则说明产生的气体中一定有CO2
D.H2C2O4与酸性KMnO4溶液反应的离子方程式为:
5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O
15、下列“类比”合理的是( )
A.碳酸钠溶于水放热,则碳酸氢钠溶于水也放热
B.NaClO溶液与CO2反应生成 NaHCO3和HClO,则 NaClO溶液与SO2反应生成NaHSO3和HClO
C.Cl2+2NaOH==NaCl+NaClO+H2O是氧化还原反应,则ICl+2NaOH==NaCl+NaIO+H2O也是氧化还原反应
D.Na3N与盐酸反应生成NaCl和NH4Cl,则Mg3N2与盐酸反应生成MgCl2和NH4Cl
16、下列说法正确的是( )
A.同一原子中,在离核较远的区域运动的电子能量较高
B.原子核外电子排布,先排满K层再排L层、先排满M层再排N层
C.同一周期中,随着核电荷数的增加,元素的原子半径逐渐增大
D.同一周期中,ⅡA与ⅢA族元素原子的核电荷数都相差1
17、W、X、Y、Z、M、N六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是( )
N
Z
M
W
X
Y
第17小题
A.原子半径:Y>Z>W
B.单质的还原性:X>Y
C.溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D.元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
18、X、Y、Z、W是原子序数依次递增的短周期元素,X、Y、Z的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构,W与Y同主族。下列说法正确的是( )
A.原子半径:Z>Y>X
B.Y与X形成的简单化合物的沸点高于W与X形成化合物的沸点
C.CaY2与水发生氧化还原反应时,CaY2只作氧化剂
D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1︰2
19、通过实验得出的结论正确的是( )
A.将某固体试样完全溶于盐酸,再滴加BaCl2溶液,出现白色沉淀,则该固体试样中存在SO42-
B.将某固体试样完全溶于盐酸,再滴加KSCN溶液,没有出现血红色,则该固体试样中不存在Fe3+
C.在某固体试样加水后的溶液中,滴加NaOH溶液,没有产生使湿润红色石蕊试纸变蓝的气体,该固体试样中仍可能存在NH4+
D.钠在氧气中燃烧所得固体粉末取少量于试管,加入2 mL蒸馏水,若无气体生成,则固体粉末为Na2O;若有气体生成,则固体粉末为Na2O2
20、某同学通过如下流程制备氧化亚铜:
eq \x(Cu2(OH)2CO3)eq \(————→,\s\up7(过量盐酸),\s\d18(①))eq \x(CuCl2溶液)eq \(——→,\s\up7(SO2),\s\d18(②))eq \(——→,\s\up7(过滤),\s\d7(洗涤),\s\d18(③))eq \x(CuCl)eq \(—————→,\s\up7(NaOH溶液),\s\d7(△),\s\d18(④))eq \(——→,\s\up7(过滤),\s\d7(洗涤),\s\d18(⑤))eq \x(Cu2O)
已知:CuCl难溶于水和稀硫酸;Cu2O+2H+Cu2++Cu+H2O
下列说法不正确的是( )
A.步骤②中的SO2可用Na2SO3替换
B.步骤③中为防止CuCl被氧化,可用SO2水溶液洗涤
C.步骤④发生反应的离子方程式为2CuCl+2OHˉCu2O+2Clˉ+H2O
D.检验Cu2O试样中是否混有CuO杂质,可在试样中加入足量稀硫酸,若溶液变蓝色,则证明试样中含有CuO
21、在下列各溶液中,所给离子一定能大量共存的是( )
A.加入铝片有气体产生的溶液中:K+、Mg2+、NO3¯、SO42-
B.澄清透明的溶液中:K+、Cu2+、NO3¯、SO42-
C.强酸性溶液中:Na+、Fe2+、NO3¯、SO42-
D.含有[Al(OH)4]¯的溶液中:K+、Al3+、SO42-、Cl¯
22、能正确表示下列变化的离子方程式是( )
A.BaCO3溶于盐酸:BaCO3+2H+eq \(===)Ba2++CO2↑+H2O
B.FeCl3溶液腐蚀铜板:2Fe3++3Cueq \(===)2Fe+3Cu2+
C.(NH4)2Fe(SO4)2溶液与少量Ba(OH)2溶液反应:SOeq \\al(2−,4)+Ba2+=BaSO4↓
D.Na与CuSO4水溶液反应:2Na+Cu2+ =Cu +2Na+
23、设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.1ml氯气与足量的水充分反应转移电子的数目为NA
B.2 g H218O与D216O的混合物中所含中子、电子数目均为NA
C.1 L 0.1 ml·Lˉ1硫酸钠溶液中含有的氧原子数为0.4 NA
D.a ml的R2+(R的核内中子数为N,质量数为A)的核外电子数为a(A-N + 2) NA
24、已知还原性:SO32- > I-。向含有a ml KI和a ml K2SO3的混合液中通入b ml Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是( )
A.当a≥b时,发生的离子反应为SO32-+Cl2+H2O=SO42-+2H++2Cl-
B.当5a = 4b时,发生的离子反应为4SO32-+2I-+5Cl2 +4H2O=4SO42-+I2 +8H++10Cl-
C.当a≤b≤ eq \f(3,2)a时,反应中转移电子的物质的量n(e-)为a ml≤n(e-)≤3a ml
D.当a < b < eq \f(3,2)a时,溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b
25、某固体混合物X可能含有Cu、Fe、Fe2O3、Ca(OH)2和Na2CO3中的几种。为确定其组成,
某同学进行了如下实验:
已知:向溶液B中滴加KSCN溶液,未出现血红色。
下列推断正确的是( )
A.固体混合物X中一定含Ca(OH)2和Na2CO3
B.固体混合物X中若含Cu,则一定还含Fe2O3
C.气体B一定是纯净物
D.溶液B中一定含2种金属阳离子
第二部分 非选择题(共50分)
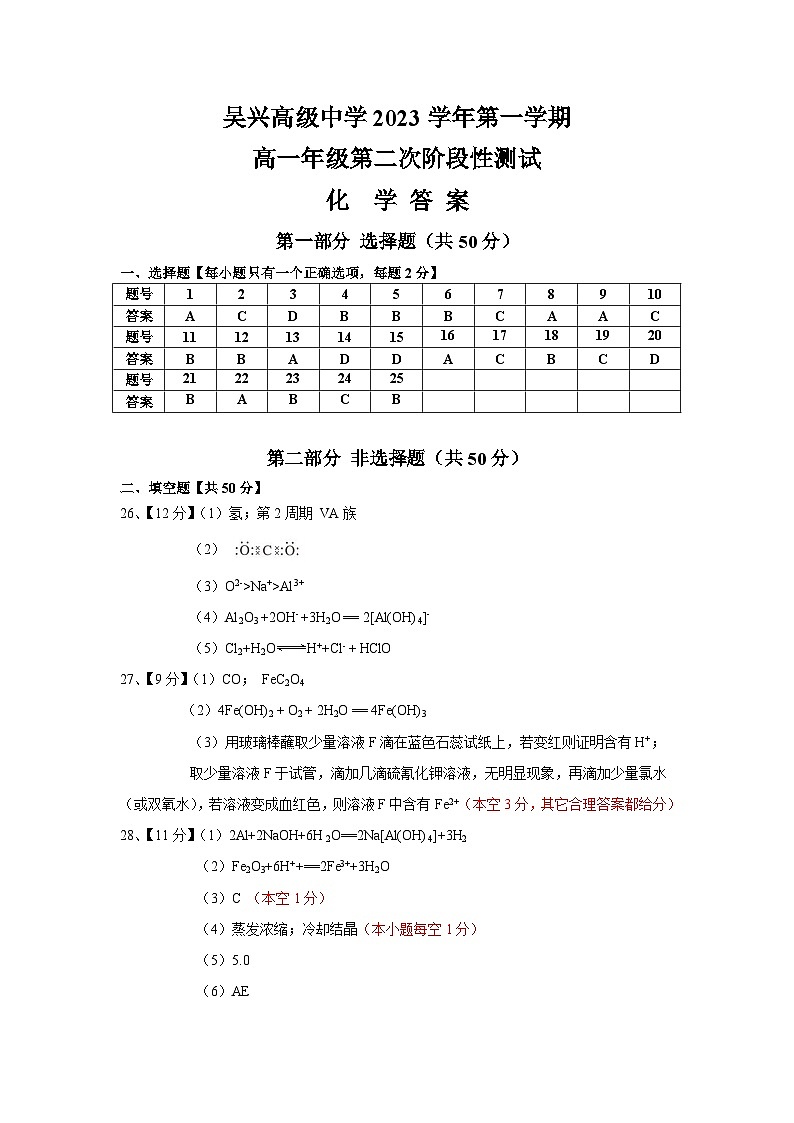
二、简答题【共44分】
26、(12分)W、X、Y、Z、R、V、Q是七种短周期元素,原子序数依次增大。X原子的最外层电子数是次外层的2倍,Z为地壳中含量最多的元素,V的周期数和主族序数相等,W和R同主族,且都能与Z形成A2Z、A2Z2(A可以表示W或R)型的两种化合物,Q的单质为黄绿色有毒气体。请回答下列问题:
(1)W为__________(填元素名称),Y在元素周期表中的位置为________________。
(2)请写出XZ2的电子式_______________。
(3)Z、R、V形成的简单离子的半径由大到小的顺序为_______________(填离子符号)。
(4)请写出V的最高价氧化物与R的最高价氧化物对应的水化物的溶液反应的离子方程式_____
___________________________________________。
(5)请写出Q的单质与水反应的离子方程式_________________________________________。
27、(9分)某化合物A(由三种元素构成),为了探究其组成,进行了如下实验:
已知:气体D在标准状况下的密度为1.25g/L。试回答:
(1)无色气体D的化学式为_________,化合物A的化学式为______________。
(2)请写出白色沉淀J变成红褐色固体K的化学方程式_________________________。
(3)请写出溶液F中阳离子的检验方法__________________________________________
__________________________________________________________________。
28、(11分)某化学兴趣小组利用某工业废铁屑制备食品添加剂FeSO4·7H2O,流程图如下:
请回答:
(1)请写出废铁屑中加入足量NaOH溶液的化学方程式______________________________。
(2)“酸浸”过程中属于非氧化还原反应的离子方程式 。
(3)“灼烧”操作应选择下列哪一种仪器___________(填序号)。
A. B. C. D.
(4)若要从稀溶液B得到FeSO4·7H2O绿矾晶体,必须进行的实验操作步骤: 、 、过滤、洗涤、自然干燥。
(5)该实验需要用到0.5ml·L-1 NaOH溶液240mL,现用固体NaOH进行配制。
①配制时需用托盘天平称量_________ g NaOH固体。
②下列说法正确的是 。
A.容量瓶经蒸馏水洗涤后,有少量蒸馏水残留,不影响使用
B.容量瓶在实验室可用于存放试剂
C.配制时,NaOH固体溶解后,立即用玻璃棒引流至容量瓶中,然后缓慢加水至刻度线1~2cm处,再滴加蒸馏水至刻度线
D.定容时若俯视刻度线,则会使所配溶液的浓度偏低
E.称取的NaOH固体中若含有Na2O杂质,会导致所配溶液的浓度偏高
29、(12分)高铁酸钾(K2FeO4)是一种新型高效无毒的多功能水处理剂。K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液】】中较稳定。
I.制备K2FeO4
(1)写出A中发生反应的化学方程式:__________________________________________。
(2)除杂装置B中的试剂为__________________。
(3)请写出装置C中制备K2FeO4的离子方程式______________________________________。
II.探究K2FeO4的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能氧化Cl-而产生Cl2设计以下方案:
(4)方案1中溶液变红可知溶液a中含有Fe3+,该离子的产生__________(填“能”或“不能”)判断一定是由K2FeO4被Cl-还原而形成的,理由是________________________________________。
(5)方案2可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是排除ClO-的干扰。
根据K2FeO4的制备实验得出:氧化性Cl2________FeO42-(填“>”或“<”),而方案2实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是_______________________________。
(6)资料表明,酸性溶液中的氧化性FeO42->MnO4-,验证实验如下:
将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象________(填“能”或“不能”)证明氧化性FeO42->MnO4-。请说明理由:___________________________________。
三、计算题【共6分】
30、(6分)现有一包铁粉和铜粉混合均匀的粉末样品,为确定其组成,某兴趣小组同学将不同质量的该样品分别与50mL 1.2ml/L的FeCl3溶液反应,实验结果如下表所示(忽略反应前后溶液体积的微小变化)。
(1)实验②反应后溶液中含有的金属阳离子的物质的量浓度为__________(请指明具体金属阳离子,否则不给分;离子写错也不给分)。
(2)实验④样品中m(Fe)=_____________g。选项
括号内为杂质
除杂操作方法
A
Fe(Al)固体
加过量NaOH溶液充分反应后过滤
B
NaHCO3(Na2CO3)溶液
滴加适量盐酸
C
FeCl3(FeCl2)溶液
通入适量Cl2
D
CO2(HCl)气体
混合气体通过饱和NaHCO3溶液
方案1
取少量溶液a,滴加KSCN溶液至过量,溶液呈红色
方案2
用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量溶液b,滴加盐酸,有Cl2产生
实验序号
①
②
③
④
M(粉末样品)/g
1.2
2.4
3.6
4.8
M(反应后剩余固体)/g
0
0.64
1.92
3.12
浙江省湖州市2023-2024学年高一上学期1月期末调研测试化学试题(PDF版含答案): 这是一份浙江省湖州市2023-2024学年高一上学期1月期末调研测试化学试题(PDF版含答案),共7页。
浙江省湖州市吴兴高级中学2023-2024学年高一上学期12月第二次阶段性测试化学试题含答案: 这是一份浙江省湖州市吴兴高级中学2023-2024学年高一上学期12月第二次阶段性测试化学试题含答案,共10页。试卷主要包含了5 K,25g/L,24等内容,欢迎下载使用。
浙江省湖州市南浔高级中学2023-2024学年高一上学期十二月月考化学试题: 这是一份浙江省湖州市南浔高级中学2023-2024学年高一上学期十二月月考化学试题,共3页。












