资料中包含下列文件,点击文件名可预览资料内容
















还剩25页未读,
继续阅读
所属成套资源:人教版九年级下册化学课件+教案+学案+分层练习
成套系列资料,整套一键下载
【人教版】九下化学 第十单元 酸和碱(单元复习)(课件+教案+导学案+分层练习)
展开
这是一份【人教版】九下化学 第十单元 酸和碱(单元复习)(课件+教案+导学案+分层练习),文件包含10酸和碱单元复习教学课件pptx、10教学设计酸和碱单元复习docx、10练习·基础巩固酸和碱单元复习docx、10练习·素能拓展酸和碱单元复习docx、10练习·能力提升酸和碱单元复习docx、10预习导学酸和碱单元复习docx等6份课件配套教学资源,其中PPT共33页, 欢迎下载使用。
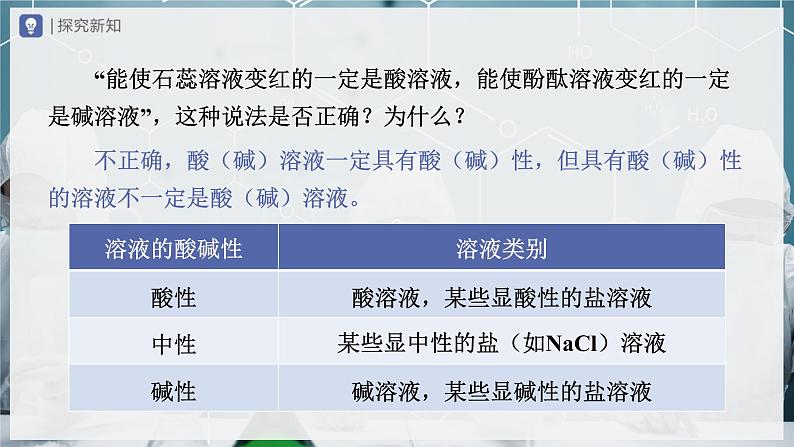
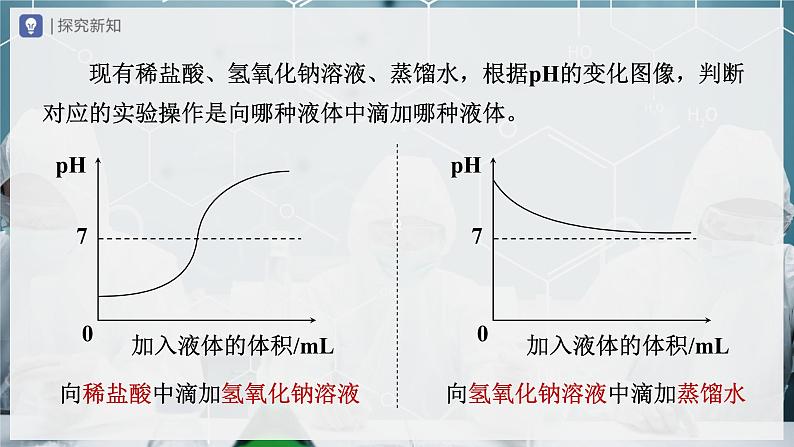
第十单元 酸和碱单元复习人教版化学九年级下册 有两瓶没有标签的液体,分别是稀盐酸和澄清石灰水,设计实验方案,通过实验鉴别出这两瓶液体分别是什么?石蕊溶液酚酞溶液pH试纸二氧化碳锌、铁等活泼金属铁锈等金属氧化物氢氧化钙碳酸钙酸碱性和酸碱度 1.定性研究溶液的酸碱性,可以使用____________检验,常见的是__________、__________。 2.定量研究溶液的酸碱度——酸碱性的______程度,常测定溶液的_____,最简便的方法是使用__________。酸碱指示剂酚酞溶液石蕊溶液强弱pH试纸pH红色无色紫色无色蓝色红色 “能使石蕊溶液变红的一定是酸溶液,能使酚酞溶液变红的一定是碱溶液”,这种说法是否正确?为什么? 不正确,酸(碱)溶液一定具有酸(碱)性,但具有酸(碱)性的溶液不一定是酸(碱)溶液。 1.在白瓷板或玻璃片上放一小片______的pH试纸。 2. 3.试纸变色后,把试纸显示的颜色与标准比色卡比较,读取相同或相近颜色的pH即为待测溶液的pH(普通的pH试纸测得的pH只能精确到整数位)。使用pH试纸的方法用玻璃棒蘸取待测溶液滴到pH试纸上。干燥 注意:不能用试纸直接蘸取溶液,否则会导致待测溶液被污染。 误差分析:若pH试纸被水润湿,则测酸性溶液时,pH______;测碱性溶液时,pH______;测中性溶液时,pH______。偏大偏小不变 现有稀盐酸、氢氧化钠溶液、蒸馏水,根据pH的变化图像,判断对应的实验操作是向哪种液体中滴加哪种液体。向稀盐酸中滴加氢氧化钠溶液向氢氧化钠溶液中滴加蒸馏水pH变大,逐渐接近7,但不能等于、大于7pH变小,逐渐接近7,但不能等于、小于7pH变大,可能小于、等于或大于7pH变小,可能大于、等于或小于7pH介于两溶液的pH之间pH介于两溶液的pH之间调节溶液pH的方法溶液的酸碱度在实际中的意义酸、碱、盐找出下列物质中的酸、碱、盐。(1)NaCl (2) (3)(4) (5) (6)HCl(7) (8) (9)KOH(10) (11) (12)(13) (14)NaOH (15)常见的酸 如果不慎将浓硫酸沾到皮肤或衣服上,应立即_____________,然后 涂上3%~5%的_________溶液。浓硫酸有强烈的腐蚀性 浓硫酸具有强腐蚀性的原因——脱水性:浓硫酸能夺走纸张、木材、布料、皮肤里的水分,生成黑色的炭。用大量水冲洗碳酸氢钠干燥气体——_____性使木材、纸张等变黑——_____性吸水脱水浓硫酸的吸水性和脱水性浓硫酸的稀释将_______沿容器壁缓慢地注入_______中,并用玻璃棒__________。浓硫酸水不断搅拌将水倒入浓硫酸的后果:硫酸液滴向四周飞溅,容易造成伤人事故。浓硫酸的稀释鉴别浓盐酸和浓硫酸常见的碱 2.__________曝露在空气中会发生______——吸收水分,表面潮湿并逐渐溶解的现象。 1.氢氧化钠在水中溶解时______热量。放出氢氧化钠 3.__________的水溶液俗称石灰水,当石灰水中存在较多未溶解的熟石灰时,称为石灰乳或石灰浆。潮解氢氧化钙 4.熟石灰可用生石灰和水制取,化学方程式为: 氢氧化钠有强烈的腐蚀性,如果不慎粘到皮肤上,要立即用大量的____冲洗,再涂上_____溶液。 氢氧化钙对皮肤、衣服等有腐蚀作用,使用时应小心。氢氧化钠、氢氧化钙的腐蚀性硼酸水(挥发性)溶质的质量分数减小(吸水性)溶质的质量分数减小浓盐酸、浓硫酸、氢氧化钠、氢氧化钙需要密封保存的原因:酸、碱的化学性质酸的通性酸具有相似化学性质的原因:酸溶液中都含有H+。碱的通性碱具有相似化学性质的原因:碱溶液中都含有OH- 。酸、碱的化学性质中和反应的实质盐酸与氢氧化钠反应的微观图示 有盐和水生成的反应一定是中和反应吗?实验能力1.怎样证明NaOH能和HCl发生反应? (1)利用酸碱指示剂或pH试纸检验NaOH是否消失。 (2)加入少量的稀盐酸,充分反应后再加入锌粒(或氧化铜、碳酸钠等),若不发生反应,就证明加入的HCl由于和NaOH反应而被消耗了。实验能力2.怎样证明NaOH能和CO2发生反应? (1)根据二氧化碳消失导致的压强变化判断。 (2)通入足量CO2后,滴加盐酸,根据是否有气泡产生,检验是否生成了Na2CO3。常见酸、碱的应用常见酸、碱的应用中和反应在实际中的应用溶液的酸碱性:检验酸碱性——酸碱指示剂;测定酸碱度——pH试纸
第十单元 酸和碱单元复习人教版化学九年级下册 有两瓶没有标签的液体,分别是稀盐酸和澄清石灰水,设计实验方案,通过实验鉴别出这两瓶液体分别是什么?石蕊溶液酚酞溶液pH试纸二氧化碳锌、铁等活泼金属铁锈等金属氧化物氢氧化钙碳酸钙酸碱性和酸碱度 1.定性研究溶液的酸碱性,可以使用____________检验,常见的是__________、__________。 2.定量研究溶液的酸碱度——酸碱性的______程度,常测定溶液的_____,最简便的方法是使用__________。酸碱指示剂酚酞溶液石蕊溶液强弱pH试纸pH红色无色紫色无色蓝色红色 “能使石蕊溶液变红的一定是酸溶液,能使酚酞溶液变红的一定是碱溶液”,这种说法是否正确?为什么? 不正确,酸(碱)溶液一定具有酸(碱)性,但具有酸(碱)性的溶液不一定是酸(碱)溶液。 1.在白瓷板或玻璃片上放一小片______的pH试纸。 2. 3.试纸变色后,把试纸显示的颜色与标准比色卡比较,读取相同或相近颜色的pH即为待测溶液的pH(普通的pH试纸测得的pH只能精确到整数位)。使用pH试纸的方法用玻璃棒蘸取待测溶液滴到pH试纸上。干燥 注意:不能用试纸直接蘸取溶液,否则会导致待测溶液被污染。 误差分析:若pH试纸被水润湿,则测酸性溶液时,pH______;测碱性溶液时,pH______;测中性溶液时,pH______。偏大偏小不变 现有稀盐酸、氢氧化钠溶液、蒸馏水,根据pH的变化图像,判断对应的实验操作是向哪种液体中滴加哪种液体。向稀盐酸中滴加氢氧化钠溶液向氢氧化钠溶液中滴加蒸馏水pH变大,逐渐接近7,但不能等于、大于7pH变小,逐渐接近7,但不能等于、小于7pH变大,可能小于、等于或大于7pH变小,可能大于、等于或小于7pH介于两溶液的pH之间pH介于两溶液的pH之间调节溶液pH的方法溶液的酸碱度在实际中的意义酸、碱、盐找出下列物质中的酸、碱、盐。(1)NaCl (2) (3)(4) (5) (6)HCl(7) (8) (9)KOH(10) (11) (12)(13) (14)NaOH (15)常见的酸 如果不慎将浓硫酸沾到皮肤或衣服上,应立即_____________,然后 涂上3%~5%的_________溶液。浓硫酸有强烈的腐蚀性 浓硫酸具有强腐蚀性的原因——脱水性:浓硫酸能夺走纸张、木材、布料、皮肤里的水分,生成黑色的炭。用大量水冲洗碳酸氢钠干燥气体——_____性使木材、纸张等变黑——_____性吸水脱水浓硫酸的吸水性和脱水性浓硫酸的稀释将_______沿容器壁缓慢地注入_______中,并用玻璃棒__________。浓硫酸水不断搅拌将水倒入浓硫酸的后果:硫酸液滴向四周飞溅,容易造成伤人事故。浓硫酸的稀释鉴别浓盐酸和浓硫酸常见的碱 2.__________曝露在空气中会发生______——吸收水分,表面潮湿并逐渐溶解的现象。 1.氢氧化钠在水中溶解时______热量。放出氢氧化钠 3.__________的水溶液俗称石灰水,当石灰水中存在较多未溶解的熟石灰时,称为石灰乳或石灰浆。潮解氢氧化钙 4.熟石灰可用生石灰和水制取,化学方程式为: 氢氧化钠有强烈的腐蚀性,如果不慎粘到皮肤上,要立即用大量的____冲洗,再涂上_____溶液。 氢氧化钙对皮肤、衣服等有腐蚀作用,使用时应小心。氢氧化钠、氢氧化钙的腐蚀性硼酸水(挥发性)溶质的质量分数减小(吸水性)溶质的质量分数减小浓盐酸、浓硫酸、氢氧化钠、氢氧化钙需要密封保存的原因:酸、碱的化学性质酸的通性酸具有相似化学性质的原因:酸溶液中都含有H+。碱的通性碱具有相似化学性质的原因:碱溶液中都含有OH- 。酸、碱的化学性质中和反应的实质盐酸与氢氧化钠反应的微观图示 有盐和水生成的反应一定是中和反应吗?实验能力1.怎样证明NaOH能和HCl发生反应? (1)利用酸碱指示剂或pH试纸检验NaOH是否消失。 (2)加入少量的稀盐酸,充分反应后再加入锌粒(或氧化铜、碳酸钠等),若不发生反应,就证明加入的HCl由于和NaOH反应而被消耗了。实验能力2.怎样证明NaOH能和CO2发生反应? (1)根据二氧化碳消失导致的压强变化判断。 (2)通入足量CO2后,滴加盐酸,根据是否有气泡产生,检验是否生成了Na2CO3。常见酸、碱的应用常见酸、碱的应用中和反应在实际中的应用溶液的酸碱性:检验酸碱性——酸碱指示剂;测定酸碱度——pH试纸
相关资料
更多










