

所属成套资源:【化学up】结构二轮复习讲义
【化学up】高考化学全国版+ 结构与性质 02 考点三 价电子对互斥理论、杂化轨道理论及应用(学生版)+讲义
展开
这是一份【化学up】高考化学全国版+ 结构与性质 02 考点三 价电子对互斥理论、杂化轨道理论及应用(学生版)+讲义,共6页。学案主要包含了必备知识,概念辨析,跟踪练习等内容,欢迎下载使用。
【必备知识】
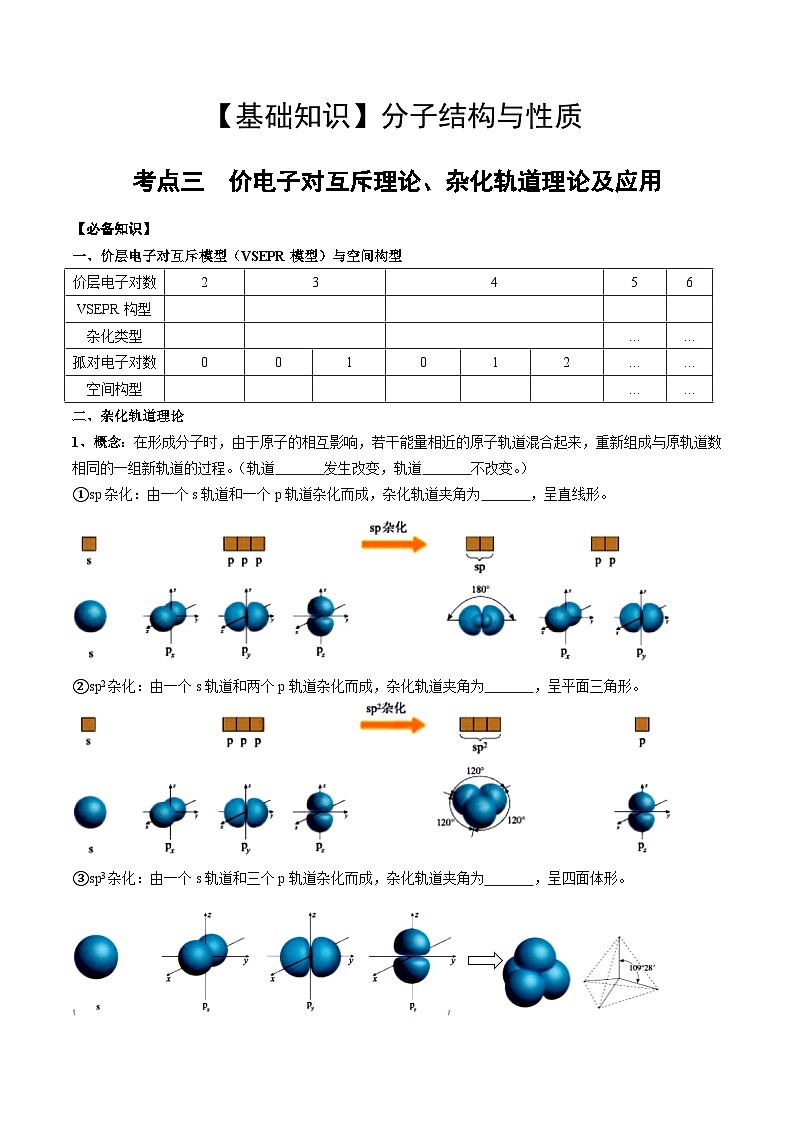
一、价层电子对互斥模型(VSEPR模型)与空间构型
二、杂化轨道理论
1、概念:在形成分子时,由于原子的相互影响,若干能量相近的原子轨道混合起来,重新组成与原轨道数相同的一组新轨道的过程。(轨道 发生改变,轨道 不改变。)
①sp杂化:由一个s轨道和一个p轨道杂化而成,杂化轨道夹角为 ,呈直线形。
②sp2杂化:由一个s轨道和两个p轨道杂化而成,杂化轨道夹角为 ,呈平面三角形。
③sp3杂化:由一个s轨道和三个p轨道杂化而成,杂化轨道夹角为 ,呈四面体形。
2、价电子对数=σ键电子对数+中心原子的孤电子对数
说明:σ键电子对数=中心原子结合的原子数;中心原子的孤电子对数=1/2 (a-xb ±电荷)
①a表示中心原子的价电子数。对于主族元素:a=原子的最外层电子数。
②x表示与中心原子结合的原子数。
③b表示与中心原子结合的原子最多能接受的电子数,即化合价绝对值。
例1、完成下列表格
例2、判断以下有机物中原子的杂化轨道类型。
(1)中氮原子的杂化方式 ,碳原子的杂化方式 。
(2)中氮原子的杂化方式 ,C2H2、C2H4、C2H6、HCHO中碳原子的杂化方式分别为 , , , 。
(3)HOCH2CN分子中碳原子轨道的杂化类型是________。
(4)丙烯腈分子(H2C==CH—C≡N)中碳原子杂化轨道类型为________。
键角比较
1、优先看杂化方式,键角:sp sp2 sp3
2、电子对结构(或杂化方式)相同,看电子对间的斥力。
①三键 双键 单键
②孤多角小:孤对电子之间的斥力 孤对电子与共用对电子的斥力 共用电子对之间的斥力
3、空间结构相同,中心原子相同或配位原子相同,看中心原子或配位原子的电负性。
①配大角小:中心原子相同,配体不同时,配体电负性越大,键角越 。
解释:配体电负性大,对电子云的吸引力大,使成键电子离开中心原子,减少成键的斥力,键角越小。
②心大角大:配体相同,中心原子不同时,中心原子电负性越大,键角越 。
解释:中心原子电负性大,对电子云的吸引力大,使成键电子靠近中心原子,增大成键的斥力,键角越大。
例3、按要求回答问题
(1)Si与C元素位于同一主族,SiO2键角小于CO2的原因是___________________________。
(2)H3BO3 分子中的 O—B—O 的键角________(填“大于”“等于”或“小于”) BHeq \\al(-,4)中的 H—B—H 的键角,判断依据是______________________________________________________________。
(3)高温陶瓷材料Si3N4晶体中键角N—Si—N______(填“>”“C>H B.4个N原子均与C形成配位键
C.分子中C的杂化轨道类型为sp2 D.结构中存在σ键、π键
8、按要求回答问题
(1)[2021·全国甲卷,35(1)节选]SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为________。SiCl4可发生水解反应,机理如下:
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为____。
(2)[2021·全国乙卷,35(3)节选]PH3中P的杂化类型是 ________。
(3)[2021·湖南,18(2)②节选]N-甲基咪唑()中碳原子的杂化轨道类型为________。
(4)[2022·河北,17(3)]SnCleq \\al(-,3)的空间结构为________,其中心离子杂化方式为__________。
(5)[2022·北京,15(2)]比较SOeq \\al(2-,4)和H2O分子中的键角大小并给出相应解释:____________。
(6)[2021·山东,16(3)]Xe是第5周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价电子对数为____________,下列对XeF2中心原子杂化方式推断合理的是______________(填标号)。
A.sp B.sp2 C.sp3 D.sp3d
(7)[2020·全国卷Ⅰ,35(3)]磷酸根离子的空间结构为________,其中P的价电子对数为________,杂化轨道类型为________。
(8)[2018·全国卷Ⅰ,35(3)节选]LiAlH4中的阴离子空间结构是________,中心原子的杂化形式为________。
(9)[2019·新课标Ⅲ]NH4H2PO4中,电负性最高的元素是___;P的_____杂化轨道与O的2p轨道形成____键。
(10)[2019·江苏卷]抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为__________;推测抗坏血酸在水中的溶解性:____________(填“难溶于水”或“易溶于水”)。
9、按要求回答问题
(1)Cu2+处于[Cu(NH3)4]2+的中心,若将配离子[Cu(NH3)4]2+中的2个NH3换为CN-,则有2种结构,则Cu2+是否为sp3杂化?__________(填“是”或“否”),理由为______________________________。
(2)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的空间构型为____;也可以得到偏钒酸钠,其阴离子呈如图所示的无限链状结构,则偏钒酸钠的化学式为________。(3)SO2Cl2和SO2F2中S==O之间以双键结合,S—Cl、S—F之间以单键结合。请你预测SO2Cl2和SO2F2分子的空间结构为__________。SO2Cl2分子中∠Cl—S—Cl_____SO2F2分子中∠F—S—F(填“<”“>”或“=”)。
(4)乙酸分子()中键角1大于键角2,其原因为_____________________________。
(5)NH3分子在独立存在时,H—N—H键角为107.3°。如图是[Zn(NH3)6]2+的部分结构以及H—N—H键角的测量值。解释NH3形成如图配合物后H—N—H键角变大的原因:_________________________________。
(6)AsH3分子为三角锥形,键角为91.80°,小于氨分子的键角107.3°,AsH3分子键角较小的原因是______________________________________________________________________________。价层电子对数
2
3
4
5
6
VSEPR构型
杂化类型
…
…
孤对电子对数
0
0
1
0
1
2
…
…
空间构型
…
…
ABn
б键数
孤对电子对数
价电子对数
中心原子杂化轨道类型
空间构型
SOCl2
中心原子为S
NH4+
SO42-
ClO4-
NH3
H2O
SO3
BF3
SO2
NO2
CS2
O3
相关学案
这是一份【化学up】高考化学全国版+ 结构与性质 02 考点八 配合物、超分子(学生版)+讲义,共5页。学案主要包含了必备知识,易错辨析,跟踪练习等内容,欢迎下载使用。
这是一份【化学up】高考化学全国版+ 结构与性质 02 考点六 分子性质(学生版)+讲义,共5页。学案主要包含了必备知识,易错辨析,跟踪练习等内容,欢迎下载使用。
这是一份【化学up】高考化学全国版+ 结构与性质 02 考点五 等电子体(学生版)+讲义,共2页。学案主要包含了必备知识,跟踪练习等内容,欢迎下载使用。









