所属成套资源:【化学up】结构二轮复习讲义
【化学up】高考化学全国版+ 结构与性质 02 考点五 等电子体(教师版)+讲义
展开
这是一份【化学up】高考化学全国版+ 结构与性质 02 考点五 等电子体(教师版)+讲义,共2页。学案主要包含了必备知识,跟踪练习等内容,欢迎下载使用。
【必备知识】
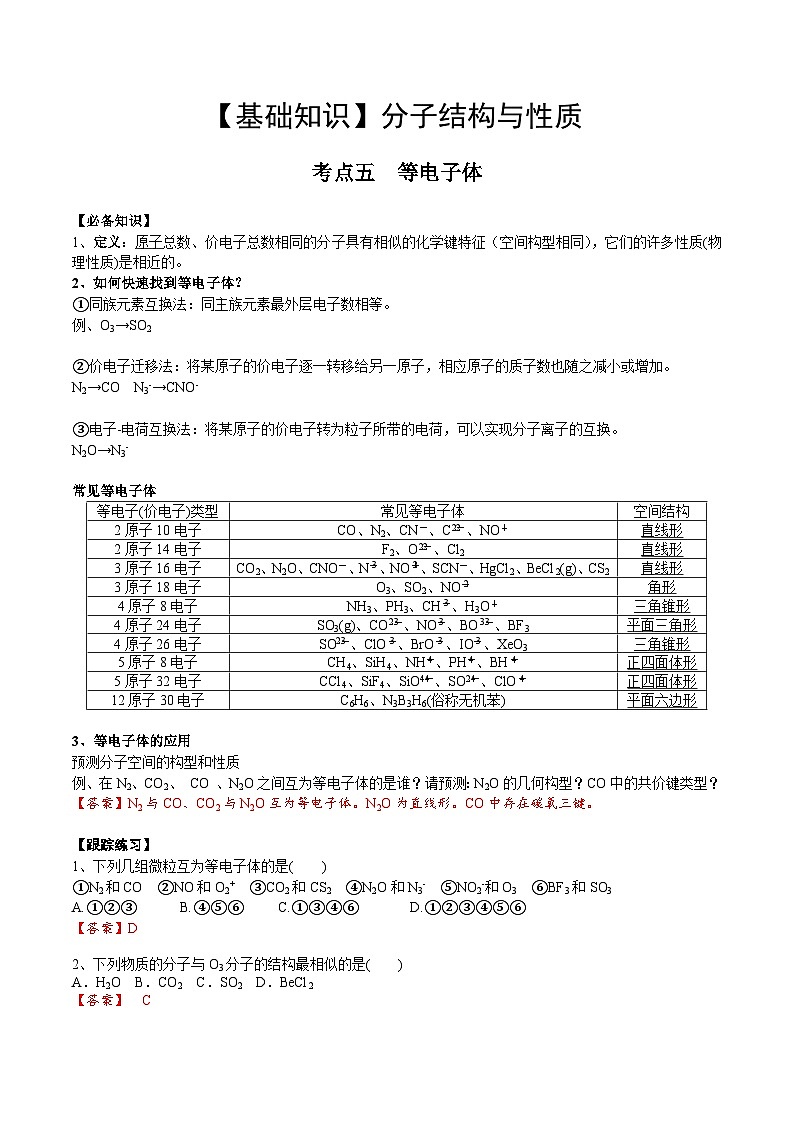
定义:原子总数、价电子总数相同的分子具有相似的化学键特征(空间构型相同),它们的许多性质(物理性质)是相近的。
如何快速找到等电子体?
①同族元素互换法:同主族元素最外层电子数相等。
例、O3→SO2
②价电子迁移法:将某原子的价电子逐一转移给另一原子,相应原子的质子数也随之减小或增加。
N2→CO N3-→CNO-
③电子-电荷互换法:将某原子的价电子转为粒子所带的电荷,可以实现分子离子的互换。
N2O→N3-
常见等电子体
等电子体的应用
预测分子空间的构型和性质
例、在N2、CO2、 CO 、N2O之间互为等电子体的是谁?请预测:N2O的几何构型?CO中的共价键类型?
【答案】N2与CO、CO2与N2O互为等电子体。N2O为直线形。CO中存在碳氧三键。
【跟踪练习】
1、下列几组微粒互为等电子体的是( )
①N2和CO ②NO和O2+ ③CO2和CS2 ④N2O和N3- ⑤NO2-和O3 ⑥BF3和SO3
A.①②③B.④⑤⑥ C.①③④⑥D.①②③④⑤⑥
【答案】D
2、下列物质的分子与O3分子的结构最相似的是( )
A.H2O B.CO2 C.SO2 D.BeCl2
【答案】 C
【解析】 H2O分子中氧原子采用sp3杂化方式;CO2中碳原子采用sp杂化方式;BeCl2中Be原子采用sp杂化方式。
3、(2022·福州高级中学月考)美国科学家合成了含有Neq \\al(+,5)的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈V形,如图所示。以下有关该物质的说法不正确的是( )
A.每个Neq \\al(+,5)中含有35个质子和34个电子 B.该离子中有非极性键和配位键
C.该离子中含有4个π键 D.与PCleq \\al(+,4)互为等电子体
【答案】D
【解析】1个氮原子中含有7个质子、7个电子,则1个N5分子中含有35个质子、35个电子,Neq \\al(+,5)是由N5分子失去1个电子得到的,则1个Neq \\al(+,5)离子中有35个质子,34个电子,故A项正确;Neq \\al(+,5)中氮氮三键是非极性共价键,中心的氮原子有空轨道,两边的2个氮原子提供孤电子对形成配位键,故B项正确;1个氮氮三键中含有2个π键,所以该离子中含有4个π键,故C项正确;Neq \\al(+,5)和PCleq \\al(+,4)具有相同原子数,但价电子数分别为24、27,不是等电子体,故D项错误。
4、按要求回答问题
(1)CNS-、NO2+具有相同的通式:AX2,它们的价电子总数都是16,因此它们的结构与由第二周期两元素组成的________分子的结构相同,呈________形,NO2+的中心原子的价电子数为________。
(2)CO32-、NO3-等微粒具有相同的通式:________,它们的价电子总数都是________,因此它们与由ⅥA族两元素组成的________分子的结构相同,呈________形,CO32-中心原子的价层电子对数为________。
(3)已知HN3是一种弱酸,其在水溶液中的电离方程式为HN3H++Neq \\al(-,3),与Neq \\al(-,3)互为等电子体的一种分子为________,Neq \\al(-,3)离子杂化类型为________杂化。
(4)H2SeO3的中心原子杂化类型是________杂化;SeOeq \\al(2-,3)的立体构型________;与SeO42-互为等电子体的分子有________(任写一种)。
(5)H2SeO3的中心原子杂化类型是____________,Se的空间构型是____________,与SeOeq \\al(2-,3)互为等电体的分子有______________(写一种物质的化学式即可)。
(6)B(OCH3)3中B采用的杂化类型是____________。写出两个与B(OCH3)3具有相同空间构型的分子或离子:________________________________________________。
(7)(2020·新课标Ⅲ)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是_________________。与NH3BH3原子总数相等的等电子体是_________(写分子式),其熔点比NH3BH3____________(填“高”或“低”),原因是在NH3BH3分子之间,存在___________,也称“双氢键”。
(8)(2020·江苏卷)与NH4+互为等电子体的一种分子为_______________(填化学式)。
【答案】(1)CO2 直线 2 (2)AX3 24 SO3 3 (3)CO2 sp (4)sp3 三角锥 CCl4或SiF4
sp3 三角锥形 PCl3 (6)sp2 SO3、COeq \\al(2-,3)(或其他合理答案)
(7)N>H>B CH3CH3 低 Hδ+与Hδ−的静电引力 (8) CH4或SiH4
【解析】(7)NH3BH3分子中,与N原子相连的H呈正电性,说明N的电负性大于H;与B原子相连的H呈负电性,说明H的电负性大于B,因此3种元素电负性由大到小的顺序为N>H>B。NH3BH3分子中有8个原子,其价电子总数为14,N和B的价电子数的平均值为4,依据等量代换的原则,可以找到其等电子体为CH3CH3。由于NH3BH3分子属于极性分子,而CH3CH3属于非极性分子,两者相对分子质量接近,但是极性分子的分子间作用力较大,故CH3CH3熔点比NH3BH3低。NH3BH3分子间存在“双氢键”,类比氢键的形成原理,说明其分子间存在Hδ+与Hδ-的静电引力。等电子(价电子)类型
常见等电子体
空间结构
2原子10电子
CO、N2、CN-、Ceq \\al(2-,2)、NO+
直线形
2原子14电子
F2、Oeq \\al(2-,2)、Cl2
直线形
3原子16电子
CO2、N2O、CNO-、Neq \\al(-,3)、NOeq \\al(+,2)、SCN-、HgCl2、BeCl2(g)、CS2
直线形
3原子18电子
O3、SO2、NOeq \\al(-,2)
角形
4原子8电子
NH3、PH3、CHeq \\al(-,3)、H3O+
三角锥形
4原子24电子
SO3(g)、COeq \\al(2-,3)、NOeq \\al(-,3)、BOeq \\al(3-,3)、BF3
平面三角形
4原子26电子
SOeq \\al(2-,3)、ClOeq \\al(-,3)、BrOeq \\al(-,3)、IOeq \\al(-,3)、XeO3
三角锥形
5原子8电子
CH4、SiH4、NHeq \\al(+,4)、PHeq \\al(+,4)、BHeq \\al(-,4)
正四面体形
5原子32电子
CCl4、SiF4、SiOeq \\al(4-,4)、SOeq \\al(2-,4)、ClOeq \\al(-,4)
正四面体形
12原子30电子
C6H6、N3B3H6(俗称无机苯)
平面六边形
相关学案
这是一份【化学up】高考化学全国版+ 结构与性质 02 考点八 配合物、超分子(教师版)+讲义,共6页。学案主要包含了必备知识,易错辨析,跟踪练习等内容,欢迎下载使用。
这是一份【化学up】高考化学全国版+ 结构与性质 02 考点六 分子性质(教师版)+讲义,共5页。学案主要包含了必备知识,易错辨析,跟踪练习等内容,欢迎下载使用。
这是一份【化学up】高考化学全国版+ 结构与性质 02 考点五 等电子体(学生版)+讲义,共2页。学案主要包含了必备知识,跟踪练习等内容,欢迎下载使用。









