






还剩22页未读,
继续阅读
所属成套资源:人教版化学九年级下册 全册课件+内嵌视频
成套系列资料,整套一键下载
第十单元复习 课件 2023-2024学年人教版化学九年级下册
展开
这是一份第十单元复习 课件 2023-2024学年人教版化学九年级下册,共30页。
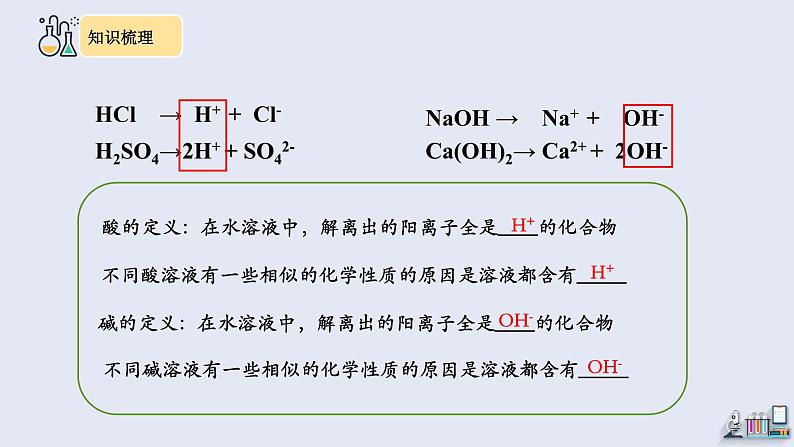
第十单元复习 酸和碱1.能从微观角度解释酸化学性质相似、碱的化学性质相似的原因。2.能列举盐酸、硫酸、氢氧化钠、氢氧化钙的物理性质和用途。3.能从微观角度认识中和反应的本质,并说出中和反应的应用。4.能说出溶液酸碱性的检验方法和变色规律。5.能掌握溶液酸碱度的表示方法和测定方法,并能说出溶液pH的调节方法。【知识点1】酸、碱的化学性质 铜线、铝线和盐酸、稀硫酸、氢氧化钠溶液、氢氧化钙溶液都能导电,其原因各是什么?金属导电溶液导电金属中存在带电的电子溶液中存在带电的离子物质导电HCl → H+ + Cl-H2SO4→2H+ + SO42-NaOH → Na+ + OH-Ca(OH)2→ Ca2+ + 2OH-酸的定义:在水溶液中,解离出的阳离子全是____的化合物碱的定义:在水溶液中,解离出的阳离子全是____的化合物H+OH-不同酸溶液有一些相似的化学性质的原因是溶液都含有_____不同碱溶液有一些相似的化学性质的原因是溶液都含有_____H+OH-1.酸的化学性质 与酸、碱指示剂作用酸+金属酸+金属氧化物盐+氢气盐+水酸能使紫色石蕊溶液变红,不能使无色酚酞溶液变色(注:金属是指在金属活动性顺序里,位于氢_____的金属)前面2.碱的化学性质 与酸、碱指示剂作用碱+非金属氧化物盐+水碱能使紫色石蕊溶液变蓝,使无色酚酞溶液变红。书写与酸、碱有关的化学方程式HCl+FeH2SO4+FeH2SO4+CuOHCl+CuONaOH+CO2Ca(OH)2+CO2Ca(OH)2+SO2Ca(OH)2+SO3【知识点2】酸和碱的中和反应1、概念:酸跟碱作用生成盐和水的反应,叫做中和反应。1.生成盐和水的反应不一定是中和反应如酸和金属氧化物,碱和非金属氧化物不是中和反应2.中和反应不属于基本反应类型2、表达式:酸+碱→盐+水3、中和反应的实质:H+ + OH–= H2O图 氢氧化钠与盐酸反应示意图HCl+NaOHH2SO4+Al(OH)3H2SO4+Ca(OH)2HCl+Cu(OH)2书写下列中和反应的化学方程式4.应用(1)改良酸性土壤,如用熟石灰改良酸性土壤。(2)处理工厂废水,如用熟石灰处理酸性废水。(3)用于医药,如用氢氧化铝治疗胃酸过多;蚊虫叮咬后涂抹肥皂水。【知识点3】溶液的酸碱性 变红变蓝不变色变红变色规律:紫色不变色1.检验溶液的酸碱性常用___________。酸碱指示剂2.溶液的酸碱度常用_____来表示。测定溶液的酸碱度常用_______pHpH试纸中性碱性增强酸性增强pH=7pH<7pH>72.溶液的酸碱度常用_____来表示。测定溶液的酸碱度常用_______pHpH试纸中性碱性增强酸性增强pH=7pH<7pH>73.调节溶液的pH(1)往稀盐酸中不断加水稀释(2)往稀盐酸中不断加氢氧化钠溶液(3)往稀氢氧化钠溶液中不断加水稀释(4)往稀氢氧化钠溶液中不断加稀盐酸【知识点4】浓盐酸、浓硫酸 无色液体无色、粘稠的油状液体在空气中会形成白雾(挥发性)不易挥发有刺激性气味无味将浓盐酸和浓硫酸分别敞口放置于空气中一段时间(忽略水分的蒸发)变化的结果(填“增大”“减小”或“不变” )减小不变减小减小不变增大增大减小【总结】浓盐酸具有挥发性,浓硫酸具有吸水性,均应______保存。密封浓硫酸的特性1.吸水性能干燥的气体____________________等。不能干燥的气体_______等。H2、O2、CO2、CH4NH32.腐蚀性(脱水性)立即用大量水冲洗,再涂上3%-5%的碳酸氢钠溶液。当稀硫酸沾到皮肤或衣服上,也必须及时这样处理,因为稀硫酸长期露置在空气中,随着水分的蒸发,将转变为浓硫酸,会对皮肤或衣服造成强烈的腐蚀。思考:(1)如果不慎将浓硫酸沾到皮肤或衣服上,应如何处理?(2)如果不慎将稀硫酸沾到皮肤或衣服上,是否也要进行这样的处理?为什么?浓硫酸的稀释酸入水慢慢倒沿内壁 将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里,用玻璃棒不断搅动,并用手接触烧杯外壁。盐酸和硫酸的用途(1)工业上稀盐酸和稀硫酸都可以除 。(2)人体胃液中含有 ,帮助消化。 (3)浓硫酸具有 性,在实验室中常用它做干燥剂,但不能干燥与浓硫酸反应的气体,如 。铁锈盐酸吸水氨气【知识点5】氢氧化钠、氢氧化钙 ①氢氧化钠是白色的固体。②氢氧化钠暴露在空气中容易吸收水分而潮解,故此氢氧化钠固体要密封保存。也鉴于此,氢氧化钠可用做某些气体的干燥剂(如:H2、O2等)。③氢氧化钠极易溶于水,溶解时会放出大量的热。1. 氢氧化钠(化学式:NaOH;俗名:烧碱、火碱、苛性钠)思考:1.氢氧化钠具有很强的腐蚀性,如果不慎将碱液沾到皮肤上,应如何处理?要用较多的水冲洗,再涂上硼酸溶液。2.氢氧化钠固体放在称量纸上称量,操作是否合理?氢氧化钠易潮解、腐蚀性很强的物质,放在称量纸上称量,易腐蚀托盘,应放在烧杯中称量。①氢氧化钙是白色的粉末;②氢氧化钙微溶于水;③氢氧化钙是生石灰(氧化钙)遇水以后制成的;反应时放出大量的热。CaO+H2O=Ca(OH)2;氢氧化钙对皮肤、衣服有腐蚀作用。使用时注意安全。2. 氢氧化钙(化学式:Ca(OH)2;俗名:熟石灰、消石灰)氢氧化钙的用途1.改良酸性土壤 2.配制波尔多液 3.作建筑材料氢氧化钠的用途1.造纸、纺织、印染 2.制造肥皂1、下列实验现象的描述中,正确的是( )A.打开盛浓盐酸的试剂瓶盖,瓶口有大量白烟产生B.铁锈与稀盐酸完全反应后,溶液由无色变成了浅蓝色C.硫在氧气中燃烧,发出淡蓝色的火焰,放出大量的热D.滴有石蕊试液的氢氧化钠溶液中逐滴加入过量盐酸,溶液由蓝色变成红色A2、食醋中含有醋酸,食醋除作调味剂外,生活中还有妙用,下列使用食醋肯定不能达到目的是( )A.除去水壶壁上的水垢 B.减弱皮蛋的涩性C.除去菜刀上的铁锈 D.鉴别黄金饰品中是否含有铜D3、如下图表示化学反应中溶液的颜色变化.下列叙述错误的是( )A.若X是稀硫酸,a可能是紫色石蕊试液 B.若X是稀硫酸,b可能是氧化物 C.若X是稀盐酸,c不可能是单质 D.若X是稀盐酸,d不可能是单质C4、盐酸和滴有酚酞的氢氧化钠溶液发生反应时,溶液pH变化如上右图所示,有关说法不正确的是( ) A.该实验是向氢氧化钠溶液中滴入盐酸 B.x点时,溶液中只含有一种溶质C.y点表示盐酸和氢氧化钠恰好完全反应 D.y点和z点时,溶液均呈现无色B酸和碱盐酸、硫酸、氢氧化钠、氢氧化钙的物理性质和用途酸、碱的化学性质酸和碱的中和反应溶液的酸碱性
第十单元复习 酸和碱1.能从微观角度解释酸化学性质相似、碱的化学性质相似的原因。2.能列举盐酸、硫酸、氢氧化钠、氢氧化钙的物理性质和用途。3.能从微观角度认识中和反应的本质,并说出中和反应的应用。4.能说出溶液酸碱性的检验方法和变色规律。5.能掌握溶液酸碱度的表示方法和测定方法,并能说出溶液pH的调节方法。【知识点1】酸、碱的化学性质 铜线、铝线和盐酸、稀硫酸、氢氧化钠溶液、氢氧化钙溶液都能导电,其原因各是什么?金属导电溶液导电金属中存在带电的电子溶液中存在带电的离子物质导电HCl → H+ + Cl-H2SO4→2H+ + SO42-NaOH → Na+ + OH-Ca(OH)2→ Ca2+ + 2OH-酸的定义:在水溶液中,解离出的阳离子全是____的化合物碱的定义:在水溶液中,解离出的阳离子全是____的化合物H+OH-不同酸溶液有一些相似的化学性质的原因是溶液都含有_____不同碱溶液有一些相似的化学性质的原因是溶液都含有_____H+OH-1.酸的化学性质 与酸、碱指示剂作用酸+金属酸+金属氧化物盐+氢气盐+水酸能使紫色石蕊溶液变红,不能使无色酚酞溶液变色(注:金属是指在金属活动性顺序里,位于氢_____的金属)前面2.碱的化学性质 与酸、碱指示剂作用碱+非金属氧化物盐+水碱能使紫色石蕊溶液变蓝,使无色酚酞溶液变红。书写与酸、碱有关的化学方程式HCl+FeH2SO4+FeH2SO4+CuOHCl+CuONaOH+CO2Ca(OH)2+CO2Ca(OH)2+SO2Ca(OH)2+SO3【知识点2】酸和碱的中和反应1、概念:酸跟碱作用生成盐和水的反应,叫做中和反应。1.生成盐和水的反应不一定是中和反应如酸和金属氧化物,碱和非金属氧化物不是中和反应2.中和反应不属于基本反应类型2、表达式:酸+碱→盐+水3、中和反应的实质:H+ + OH–= H2O图 氢氧化钠与盐酸反应示意图HCl+NaOHH2SO4+Al(OH)3H2SO4+Ca(OH)2HCl+Cu(OH)2书写下列中和反应的化学方程式4.应用(1)改良酸性土壤,如用熟石灰改良酸性土壤。(2)处理工厂废水,如用熟石灰处理酸性废水。(3)用于医药,如用氢氧化铝治疗胃酸过多;蚊虫叮咬后涂抹肥皂水。【知识点3】溶液的酸碱性 变红变蓝不变色变红变色规律:紫色不变色1.检验溶液的酸碱性常用___________。酸碱指示剂2.溶液的酸碱度常用_____来表示。测定溶液的酸碱度常用_______pHpH试纸中性碱性增强酸性增强pH=7pH<7pH>72.溶液的酸碱度常用_____来表示。测定溶液的酸碱度常用_______pHpH试纸中性碱性增强酸性增强pH=7pH<7pH>73.调节溶液的pH(1)往稀盐酸中不断加水稀释(2)往稀盐酸中不断加氢氧化钠溶液(3)往稀氢氧化钠溶液中不断加水稀释(4)往稀氢氧化钠溶液中不断加稀盐酸【知识点4】浓盐酸、浓硫酸 无色液体无色、粘稠的油状液体在空气中会形成白雾(挥发性)不易挥发有刺激性气味无味将浓盐酸和浓硫酸分别敞口放置于空气中一段时间(忽略水分的蒸发)变化的结果(填“增大”“减小”或“不变” )减小不变减小减小不变增大增大减小【总结】浓盐酸具有挥发性,浓硫酸具有吸水性,均应______保存。密封浓硫酸的特性1.吸水性能干燥的气体____________________等。不能干燥的气体_______等。H2、O2、CO2、CH4NH32.腐蚀性(脱水性)立即用大量水冲洗,再涂上3%-5%的碳酸氢钠溶液。当稀硫酸沾到皮肤或衣服上,也必须及时这样处理,因为稀硫酸长期露置在空气中,随着水分的蒸发,将转变为浓硫酸,会对皮肤或衣服造成强烈的腐蚀。思考:(1)如果不慎将浓硫酸沾到皮肤或衣服上,应如何处理?(2)如果不慎将稀硫酸沾到皮肤或衣服上,是否也要进行这样的处理?为什么?浓硫酸的稀释酸入水慢慢倒沿内壁 将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里,用玻璃棒不断搅动,并用手接触烧杯外壁。盐酸和硫酸的用途(1)工业上稀盐酸和稀硫酸都可以除 。(2)人体胃液中含有 ,帮助消化。 (3)浓硫酸具有 性,在实验室中常用它做干燥剂,但不能干燥与浓硫酸反应的气体,如 。铁锈盐酸吸水氨气【知识点5】氢氧化钠、氢氧化钙 ①氢氧化钠是白色的固体。②氢氧化钠暴露在空气中容易吸收水分而潮解,故此氢氧化钠固体要密封保存。也鉴于此,氢氧化钠可用做某些气体的干燥剂(如:H2、O2等)。③氢氧化钠极易溶于水,溶解时会放出大量的热。1. 氢氧化钠(化学式:NaOH;俗名:烧碱、火碱、苛性钠)思考:1.氢氧化钠具有很强的腐蚀性,如果不慎将碱液沾到皮肤上,应如何处理?要用较多的水冲洗,再涂上硼酸溶液。2.氢氧化钠固体放在称量纸上称量,操作是否合理?氢氧化钠易潮解、腐蚀性很强的物质,放在称量纸上称量,易腐蚀托盘,应放在烧杯中称量。①氢氧化钙是白色的粉末;②氢氧化钙微溶于水;③氢氧化钙是生石灰(氧化钙)遇水以后制成的;反应时放出大量的热。CaO+H2O=Ca(OH)2;氢氧化钙对皮肤、衣服有腐蚀作用。使用时注意安全。2. 氢氧化钙(化学式:Ca(OH)2;俗名:熟石灰、消石灰)氢氧化钙的用途1.改良酸性土壤 2.配制波尔多液 3.作建筑材料氢氧化钠的用途1.造纸、纺织、印染 2.制造肥皂1、下列实验现象的描述中,正确的是( )A.打开盛浓盐酸的试剂瓶盖,瓶口有大量白烟产生B.铁锈与稀盐酸完全反应后,溶液由无色变成了浅蓝色C.硫在氧气中燃烧,发出淡蓝色的火焰,放出大量的热D.滴有石蕊试液的氢氧化钠溶液中逐滴加入过量盐酸,溶液由蓝色变成红色A2、食醋中含有醋酸,食醋除作调味剂外,生活中还有妙用,下列使用食醋肯定不能达到目的是( )A.除去水壶壁上的水垢 B.减弱皮蛋的涩性C.除去菜刀上的铁锈 D.鉴别黄金饰品中是否含有铜D3、如下图表示化学反应中溶液的颜色变化.下列叙述错误的是( )A.若X是稀硫酸,a可能是紫色石蕊试液 B.若X是稀硫酸,b可能是氧化物 C.若X是稀盐酸,c不可能是单质 D.若X是稀盐酸,d不可能是单质C4、盐酸和滴有酚酞的氢氧化钠溶液发生反应时,溶液pH变化如上右图所示,有关说法不正确的是( ) A.该实验是向氢氧化钠溶液中滴入盐酸 B.x点时,溶液中只含有一种溶质C.y点表示盐酸和氢氧化钠恰好完全反应 D.y点和z点时,溶液均呈现无色B酸和碱盐酸、硫酸、氢氧化钠、氢氧化钙的物理性质和用途酸、碱的化学性质酸和碱的中和反应溶液的酸碱性
相关资料
更多










